СВИНЕ́Ц (лат. Plumbum; англ. Lead), Pb, химич. элемент IV группы короткой формы (14-й группы длинной формы) периодич. системы; ат. н. 82, ат. м. 207,2. Природный С. – смесь стабильных изотопов 204Рb (1,4%), 206Рb (23,6%), 207Рb (22,6%) и 208Рb (52,4%); 206Рb, 207Рb и 208Рb – члены природных радиоактивных рядов соответственно 238U, 235U и 232Th; природные радиоизотопы 210Рb (наиболее долгоживущий, T1/2 22,3 года), 211Рb, 212Рb и 214Рb. Наиболее долгоживущий искусственный радиоизотоп 205Pb (T1/2 ок. 15,3 млн. лет).
Историческая справка
С. выплавляли из руды в Месопотамии, Малой Азии, Египте, Греции и Риме 8 тыс. лет назад; вероятно, это первый известный человеку металлургич. процесс. С. применяли для покрытия керамики глазурью, изготовления монет и статуй (Древний Египет), листовой С. служил настилом для сохранения влаги (Вавилон), материалом труб водопровода, обшивки дерев. корпусов кораблей (Древний Рим), кровли зданий (Британия) и др. Использовали С. для очистки золота и серебра методом купелирования. Геродот в 5 в. до н. э. писал о методе укрепления железных и бронзовых скоб в каменных плитах путём заливки отверстий С. Такие скобы были найдены при раскопках Микен. С изобретением огнестрельного оружия С. стал материалом для изготовления пуль и дроби. Вплоть до 17 в. С. путали с оловом (лат. plumbum album – «белый свинец», т. е. олово; лат. plumbum nigrum – «чёрный свинец», собственно С.). Происхождение назв. «С.» неясно.
Распространённость в природе
Содержание С. в земной коре 1,3·10–3% по массе, в водах океана 0,03 мкг/дм3, в речных водах 0,2–8,7 мкг/дм3. Природный фон в атмосфере 2·10—9–5·10—4 мкг/м3. В теле взрослого человека содержится 7–15 мг Pb. Известно ок. 80 минералов, содержащих Pb; пром. значение имеют галенит PbS, англезит PbSO4, церуссит РbСО3, пироморфит Pb5(PO4)3Cl; см. также Свинцово-цинковые руды. В месте залегания свинцовых руд почва, растения и воды содержат до 1% Pb.
Свойства
Конфигурация внешних электронных оболочек атома С. 6s26p2; степени окисления +2 (наиболее характерная) и +4; энергии последоват. ионизации соответственно равны 715, 1450, 3081 и 4082 кДж/моль; электроотрицательность по Полингу 2,33; атомный радиус 175 пм, ковалентный радиус 146 пм, ионные радиусы (в скобках даны координац. числа) РbIV 79 пм (4), 92 пм (6), РbII 112 пм (4), 133 пм (6).
С. – металл синевато-серого цвета, легкоплавкий, tпл 327 °C, tкип 1751 °C; плотность 11341,5 кг/м3 (20 °C); кристаллизуется в гранецентрированной кубич. решётке. С. хороший поглотитель рентгеновского и γ-излучения; поперечное сечение захвата тепловых нейтронов ок. 0,2·10–28 м2. Слабо тепло- и электропроводен; диамагнетик; темп-ра перехода в сверхпроводящее состояние 7,2 К. С. мягок, пластичен, легко прокатывается в тончайшие листы. Твёрдость по Бринеллю 25–40 МПа; относит. удлинение при разрыве 50–70%. С. практически не растворяет газообразные N2, CO, CO2, O2, SO2, H2.
С. – химически инертен. В сухом воздухе не окисляется, во влажном – тускнеет, покрываясь плёнкой оксидов, переходящих в присутствии СО2 в осно́вную соль состава Рb2(CO3)(ОН)2. С кислородом образует оксиды Рb2О, РbО, РbО2, Рb3О4, Рb2О3 (см. Свинца оксиды). При комнатной темп-ре не реагирует с разбавленными H2SO4 и НСl, т. к. на поверхности образуются труднорастворимые PbSO4 и РbСl2. С разбавленными HNO3 и СН3СООН образует хорошо растворимые Pb(NO3)2 и Рb(СН3СОО)2, с концентрир. H2SO4 и НСl при нагревании – растворимые Pb(HSO4)2 и Н2[РbСl4]. Взаимодействует с HF и щелочами в водном растворе только при нагревании, реагирует с лимонной, муравьиной и винной кислотами. Растворимые соли Pb(II) подвержены гидролизу, который при кипячении растворов приводит к осаждению осно́вных солей.
Производные Pb(IV) можно получить электролизом подкислённых растворов солей Pb(II). Наиболее известные среди них Pb(SO4)2 и Рb(ОСОСН3)4 (см. также Свинца ацетаты). Производные Pb(IV), как правило, подвергаются необратимому гидролизу; в случае PbCl4 под действием воды происходит образование PbCl2 и выделение Cl2 (окислительно-восстановит. реакция). При разрядке свинцового аккумулятора Pb(IV) служит окислителем (Рb+РbO2+2H2SO4= =2PbSO4+2Н2О). С расплавами щелочей оксиды Pb(IV) и Pb(II) дают двойные оксиды, напр. (Na2Pb)O3, (Na2Pb)O2; в концентрир. растворах щелочей при нагревании образуются гидроксокомплексы типа Na2[Рb(ОН)6].
При нагревании С. реагирует с галогенами, образуя производные Pb(II) и Pb(IV): РbI2, РbВr2, PbCl2, РbВr4, PbCl4, PbF4; с серой при нагревании С. даёт PbS. Гидриды для С. не характерны. Важное органич. производное С. – тетраэтилсвинец Pb(C2H5)4; см. также Свинецорганические соединения.
Получение
Осн. источник Pb – сульфидные полиметаллич. руды. Обогащая руды (1–5% Рb) методом флотации, получают свинцовые концентраты (содержащие 40–75% Рb, 5–10% Zn, до 5% Сu, благородные металлы и Bi). Технология получения С. включает агломерирующий обжиг сульфидных концентратов, шахтную восстановит. плавку агломерата и рафинирование чернового С. При обжиге PbS окисляется кислородом воздуха, продуваемого в расплав, содержащий добавки флюсов (SiO2, CaCO3, Fe2O3): 2PbS+3О2=2РbО+2SO2. В готовом агломерате содержится 35–45% Рb и 1,2–3% S (в т. ч. в виде сульфатов). Агломерат смешивают с коксом и направляют на восстановит. плавку в шахтные печи, в которые подаётся воздух или воздушно-кислородная смесь. В печи протекает двухстадийная экзотермич. реакция (2PbS+3O2=2PbO+2SO2 и PbS+2РbО=3Рb+SO2), продукт которой – черновой С. (извлечение Рb достигает 90–94%). Отходы процесса плавки (шлаки) направляются на дальнейшую переработку для извлечения Zn. Образующаяся при шахтной плавке (и агломерации) пыль служит исходным сырьём для извлечения редких и рассеянных элементов. Черновой С. содержит 93–98% Рb и примеси: Сu (1–5%), Sb, As, Sn (0,5–3%), Bi (0,05–0,4%) и др. Очистку чернового С. производят пирометаллургич. или электролитич. способом. Объём мирового произ-ва С. ок. 9 млн. т/год.
Применение
До 45% от общего потребления С. идёт на произ-во электродов аккумуляторов; до 20% – на изготовление проводов, кабелей и покрытий к ним. С. используют для изготовления футеровки, труб и аппаратуры в химич. пром-сти. Применяют сплавы С. с Sn, Са, Sb, Cu, As, Cd. В строительстве С. используют в качестве изоляции, уплотнителя швов, стыков, при создании сейсмостойких фундаментов, в воен. технике – для изготовления шрапнели и сердечников пуль. Экраны из С. служат для защиты от радиоактивного и рентгеновского излучений. Соединения С. входят в состав пигментов, эмалей, стёкол, керамики, материалов оптоэлектроники и т. д.
С. токсичен. Осн. источники загрязнения С. окружающей среды: металлургич. предприятия, выхлопные газы двигателей внутр. сгорания, сточные воды пром. предприятий и др.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lead | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (led) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | metallic gray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Pb) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lead in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 14 (carbon group) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s2 6p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 600.61 K (327.46 °C, 621.43 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2022 K (1749 °C, 3180 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 11.34 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 10.66 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 4.77 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 179.5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.650 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −2, −1, 0,[3] +1, +2, +3, +4 (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.33 (in +4), 1.87 (in +2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 146±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of lead |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
a=495.08 pm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 1190 m/s (at r.t.) (annealed) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 28.9 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 35.3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 208 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −23.0×10−6 cm3/mol (at 298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 5.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 46 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 38–50 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-92-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Middle East (7000 BCE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Pb»: from Latin plumbum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of lead
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopic abundances vary greatly by sample[2] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Lead is a chemical element with the symbol Pb (from the Latin plumbum) and atomic number 82. It is a heavy metal that is denser than most common materials. Lead is soft and malleable, and also has a relatively low melting point. When freshly cut, lead is a shiny gray with a hint of blue. It tarnishes to a dull gray color when exposed to air. Lead has the highest atomic number of any stable element and three of its isotopes are endpoints of major nuclear decay chains of heavier elements. Lead is toxic, even in small amounts, especially to children.
Lead is a relatively unreactive post-transition metal. Its weak metallic character is illustrated by its amphoteric nature; lead and lead oxides react with acids and bases, and it tends to form covalent bonds. Compounds of lead are usually found in the +2 oxidation state rather than the +4 state common with lighter members of the carbon group. Exceptions are mostly limited to organolead compounds. Like the lighter members of the group, lead tends to bond with itself; it can form chains and polyhedral structures.
Since lead is easily extracted from its ores, prehistoric people in the Near East were aware of it. Galena is a principal ore of lead which often bears silver. Interest in silver helped initiate widespread extraction and use of lead in ancient Rome. Lead production declined after the fall of Rome and did not reach comparable levels until the Industrial Revolution. Lead played
a crucial role in the development of the printing press, as movable type could be relatively easily cast from lead alloys.[5] In 2014, the annual global production of lead was about ten million tonnes, over half of which was from recycling. Lead’s high density, low melting point, ductility and relative inertness to oxidation make it useful. These properties, combined with its relative abundance and low cost, resulted in its extensive use in construction, plumbing, batteries, bullets and shot, weights, solders, pewters, fusible alloys, white paints, leaded gasoline, and radiation shielding.
Lead’s toxicity became widely recognized in the late 19th century, although a number of well-educated ancient Greek and Roman writers were aware of this fact and even knew some of the symptoms of lead poisoning. Lead is a neurotoxin that accumulates in soft tissues and bones; it damages the nervous system and interferes with the function of biological enzymes, causing neurological disorders ranging from behavioral problems to brain damage, and also affects general health, cardiovascular, and renal systems.
Physical properties[edit]
Atomic[edit]
A lead atom has 82 electrons, arranged in an electron configuration of [Xe]4f145d106s26p2. The sum of lead’s first and second ionization energies—the total energy required to remove the two 6p electrons—is close to that of tin, lead’s upper neighbor in the carbon group. This is unusual; ionization energies generally fall going down a group, as an element’s outer electrons become more distant from the nucleus, and more shielded by smaller orbitals.
The sum of the first four ionization energies of lead exceeds that of tin,[6] contrary to what periodic trends would predict. This is explained by relativistic effects, which become significant in heavier atoms,[7] which contract s and p orbitals such that lead’s 6s electrons have larger binding energies than its 5s electrons.[8] A consequence is the so-called inert pair effect: the 6s electrons of lead become reluctant to participate in bonding, stabilising the +2 oxidation state and making the distance between nearest atoms in crystalline lead unusually long.[9]
Lead’s lighter carbon group congeners form stable or metastable allotropes with the tetrahedrally coordinated and covalently bonded diamond cubic structure. The energy levels of their outer s- and p-orbitals are close enough to allow mixing into four hybrid sp3 orbitals. In lead, the inert pair effect increases the separation between its s- and p-orbitals, and the gap cannot be overcome by the energy that would be released by extra bonds following hybridization.[10] Rather than having a diamond cubic structure, lead forms metallic bonds in which only the p-electrons are delocalized and shared between the Pb2+ ions. Lead consequently has a face-centered cubic structure[11] like the similarly sized[12] divalent metals calcium and strontium.[13][a][b][c]
Bulk[edit]
Pure lead has a bright, shiny gray appearance with a hint of blue.[18] It tarnishes on contact with moist air and takes on a dull appearance, the hue of which depends on the prevailing conditions. Characteristic properties of lead include high density, malleability, ductility, and high resistance to corrosion due to passivation.[19]
A sample of lead solidified from the molten state
Lead’s close-packed face-centered cubic structure and high atomic weight result in a density[20] of 11.34 g/cm3, which is greater than that of common metals such as iron (7.87 g/cm3), copper (8.93 g/cm3), and zinc (7.14 g/cm3).[21] This density is the origin of the idiom to go over like a lead balloon.[22][23][d] Some rarer metals are denser: tungsten and gold are both at 19.3 g/cm3, and osmium—the densest metal known—has a density of 22.59 g/cm3, almost twice that of lead.[24]
Lead is a very soft metal with a Mohs hardness of 1.5; it can be scratched with a fingernail.[25] It is quite malleable and somewhat ductile.[26][e] The bulk modulus of lead—a measure of its ease of compressibility—is 45.8 GPa. In comparison, that of aluminium is 75.2 GPa; copper 137.8 GPa; and mild steel 160–169 GPa.[27] Lead’s tensile strength, at 12–17 MPa, is low (that of aluminium is 6 times higher, copper 10 times, and mild steel 15 times higher); it can be strengthened by adding small amounts of copper or antimony.[28]
The melting point of lead—at 327.5 °C (621.5 °F)[29]—is very low compared to most metals.[20][f] Its boiling point of 1749 °C (3180 °F)[29] is the lowest among the carbon group elements. The electrical resistivity of lead at 20 °C is 192 nanoohm-meters, almost an order of magnitude higher than those of other industrial metals (copper at 15.43 nΩ·m; gold 20.51 nΩ·m; and aluminium at 24.15 nΩ·m).[31] Lead is a superconductor at temperatures lower than 7.19 K;[32] this is the highest critical temperature of all type-I superconductors and the third highest of the elemental superconductors.[33]
Isotopes[edit]
Natural lead consists of four stable isotopes with mass numbers of 204, 206, 207, and 208,[34] and traces of five short-lived radioisotopes.[35] The high number of isotopes is consistent with lead’s atomic number being even.[g] Lead has a magic number of protons (82), for which the nuclear shell model accurately predicts an especially stable nucleus.[36] Lead-208 has 126 neutrons, another magic number, which may explain why lead-208 is extraordinarily stable.[36]
With its high atomic number, lead is the heaviest element whose natural isotopes are regarded as stable; lead-208 is the heaviest stable nucleus. (This distinction formerly fell to bismuth, with an atomic number of 83, until its only primordial isotope, bismuth-209, was found in 2003 to decay very slowly.)[h] The four stable isotopes of lead could theoretically undergo alpha decay to isotopes of mercury with a release of energy, but this has not been observed for any of them; their predicted half-lives range from 1035 to 10189 years[39] (at least 1025 times the current age of the universe).
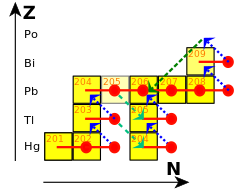
Three of the stable isotopes are found in three of the four major decay chains: lead-206, lead-207, and lead-208 are the final decay products of uranium-238, uranium-235, and thorium-232, respectively.[40] These decay chains are called the uranium chain, the actinium chain, and the thorium chain.[41] Their isotopic concentrations in a natural rock sample depends greatly on the presence of these three parent uranium and thorium isotopes. For example, the relative abundance of lead-208 can range from 52% in normal samples to 90% in thorium ores;[42] for this reason, the standard atomic weight of lead is given to only one decimal place.[43] As time passes, the ratio of lead-206 and lead-207 to lead-204 increases, since the former two are supplemented by radioactive decay of heavier elements while the latter is not; this allows for lead–lead dating. As uranium decays into lead, their relative amounts change; this is the basis for uranium–lead dating.[44] Lead-207 exhibits nuclear magnetic resonance, a property that has been used to study its compounds in solution and solid state,[45][46] including in the human body.[47]
Apart from the stable isotopes, which make up almost all lead that exists naturally, there are trace quantities of a few radioactive isotopes. One of them is lead-210; although it has a half-life of only 22.2 years,[34] small quantities occur in nature because lead-210 is produced by a long decay series that starts with uranium-238 (that has been present for billions of years on Earth). Lead-211, −212, and −214 are present in the decay chains of uranium-235, thorium-232, and uranium-238, respectively, so traces of all three of these lead isotopes are found naturally. Minute traces of lead-209 arise from the very rare cluster decay of radium-223, one of the daughter products of natural uranium-235, and the decay chain of neptunium-237, traces of which are produced by neutron capture in uranium ores. Lead-210 is particularly useful for helping to identify the ages of samples by measuring its ratio to lead-206 (both isotopes are present in a single decay chain).[48]
In total, 43 lead isotopes have been synthesized, with mass numbers 178–220.[34] Lead-205 is the most stable radioisotope, with a half-life of around 1.73×107 years.[i] The second-most stable is lead-202, which has a half-life of about 52,500 years, longer than any of the natural trace radioisotopes.[34]
Chemistry[edit]
Bulk lead exposed to moist air forms a protective layer of varying composition. Lead(II) carbonate is a common constituent;[50][51][52] the sulfate or chloride may also be present in urban or maritime settings.[53] This layer makes bulk lead effectively chemically inert in the air.[53] Finely powdered lead, as with many metals, is pyrophoric,[54] and burns with a bluish-white flame.[55]
Fluorine reacts with lead at room temperature, forming lead(II) fluoride. The reaction with chlorine is similar but requires heating, as the resulting chloride layer diminishes the reactivity of the elements.[53] Molten lead reacts with the chalcogens to give lead(II) chalcogenides.[56]
Lead metal resists sulfuric and phosphoric acid but not hydrochloric or nitric acid; the outcome depends on insolubility and subsequent passivation of the product salt.[57] Organic acids, such as acetic acid, dissolve lead in the presence of oxygen.[53] Concentrated alkalis will dissolve lead and form plumbites.[58]
Inorganic compounds[edit]
Lead shows two main oxidation states: +4 and +2. The tetravalent state is common for the carbon group. The divalent state is rare for carbon and silicon, minor for germanium, important (but not prevailing) for tin, and is the more important of the two oxidation states for lead.[53] This is attributable to relativistic effects, specifically the inert pair effect, which manifests itself when there is a large difference in electronegativity between lead and oxide, halide, or nitride anions, leading to a significant partial positive charge on lead. The result is a stronger contraction of the lead 6s orbital than is the case for the 6p orbital, making it rather inert in ionic compounds. The inert pair effect is less applicable to compounds in which lead forms covalent bonds with elements of similar electronegativity, such as carbon in organolead compounds. In these, the 6s and 6p orbitals remain similarly sized and sp3 hybridization is still energetically favorable. Lead, like carbon, is predominantly tetravalent in such compounds.[59]
There is a relatively large difference in the electronegativity of lead(II) at 1.87 and lead(IV) at 2.33. This difference marks the reversal in the trend of increasing stability of the +4 oxidation state going down the carbon group; tin, by comparison, has values of 1.80 in the +2 oxidation state and 1.96 in the +4 state.[60]
Lead(II)[edit]
Lead(II) compounds are characteristic of the inorganic chemistry of lead. Even strong oxidizing agents like fluorine and chlorine react with lead to give only PbF2 and PbCl2.[53] Lead(II) ions are usually colorless in solution,[61] and partially hydrolyze to form Pb(OH)+ and finally [Pb4(OH)4]4+ (in which the hydroxyl ions act as bridging ligands),[62][63] but are not reducing agents as tin(II) ions are. Techniques for identifying the presence of the Pb2+ ion in water generally rely on the precipitation of lead(II) chloride using dilute hydrochloric acid. As the chloride salt is sparingly soluble in water, in very dilute solutions the precipitation of lead(II) sulfide is instead achieved by bubbling hydrogen sulfide through the solution.[64]
Lead monoxide exists in two polymorphs, litharge α-PbO (red) and massicot β-PbO (yellow), the latter being stable only above around 488 °C. Litharge is the most commonly used inorganic compound of lead.[65] There is no lead(II) hydroxide; increasing the pH of solutions of lead(II) salts leads to hydrolysis and condensation.[66]
Lead commonly reacts with heavier chalcogens. Lead sulfide is a semiconductor, a photoconductor, and an extremely sensitive infrared radiation detector. The other two chalcogenides, lead selenide and lead telluride, are likewise photoconducting. They are unusual in that their color becomes lighter going down the group.[67]
Lead dihalides are well-characterized; this includes the diastatide[68] and mixed halides, such as PbFCl. The relative insolubility of the latter forms a useful basis for the gravimetric determination of fluorine. The difluoride was the first solid ionically conducting compound to be discovered (in 1834, by Michael Faraday).[69] The other dihalides decompose on exposure to ultraviolet or visible light, especially the diiodide.[70] Many lead(II) pseudohalides are known, such as the cyanide, cyanate, and thiocyanate.[67][71] Lead(II) forms an extensive variety of halide coordination complexes, such as [PbCl4]2−, [PbCl6]4−, and the [Pb2Cl9]n5n− chain anion.[70]
Lead(II) sulfate is insoluble in water, like the sulfates of other heavy divalent cations. Lead(II) nitrate and lead(II) acetate are very soluble, and this is exploited in the synthesis of other lead compounds.[72]
Lead(IV)[edit]
Few inorganic lead(IV) compounds are known. They are only formed in highly oxidizing solutions and do not normally exist under standard conditions.[73] Lead(II) oxide gives a mixed oxide on further oxidation, Pb3O4. It is described as lead(II,IV) oxide, or structurally 2PbO·PbO2, and is the best-known mixed valence lead compound. Lead dioxide is a strong oxidizing agent, capable of oxidizing hydrochloric acid to chlorine gas.[74] This is because the expected PbCl4 that would be produced is unstable and spontaneously decomposes to PbCl2 and Cl2.[75] Analogously to lead monoxide, lead dioxide is capable of forming plumbate anions. Lead disulfide[76] and lead diselenide[77] are only stable at high pressures. Lead tetrafluoride, a yellow crystalline powder, is stable, but less so than the difluoride. Lead tetrachloride (a yellow oil) decomposes at room temperature, lead tetrabromide is less stable still, and the existence of lead tetraiodide is questionable.[78]
Other oxidation states[edit]
Some lead compounds exist in formal oxidation states other than +4 or +2. Lead(III) may be obtained, as an intermediate between lead(II) and lead(IV), in larger organolead complexes; this oxidation state is not stable, as both the lead(III) ion and the larger complexes containing it are radicals.[80][81][82] The same applies for lead(I), which can be found in such radical species.[83]
Numerous mixed lead(II,IV) oxides are known. When PbO2 is heated in air, it becomes Pb12O19 at 293 °C, Pb12O17 at 351 °C, Pb3O4 at 374 °C, and finally PbO at 605 °C. A further sesquioxide, Pb2O3, can be obtained at high pressure, along with several non-stoichiometric phases. Many of them show defective fluorite structures in which some oxygen atoms are replaced by vacancies: PbO can be considered as having such a structure, with every alternate layer of oxygen atoms absent.[84]
Negative oxidation states can occur as Zintl phases, as either free lead anions, as in Ba2Pb, with lead formally being lead(−IV),[85] or in oxygen-sensitive ring-shaped or polyhedral cluster ions such as the trigonal bipyramidal Pb52− ion, where two lead atoms are lead(−I) and three are lead(0).[86] In such anions, each atom is at a polyhedral vertex and contributes two electrons to each covalent bond along an edge from their sp3 hybrid orbitals, the other two being an external lone pair.[62] They may be made in liquid ammonia via the reduction of lead by sodium.[87]
Organolead[edit]
Lead can form multiply-bonded chains, a property it shares with its lighter homologs in the carbon group. Its capacity to do so is much less because the Pb–Pb bond energy is over three and a half times lower than that of the C–C bond.[56] With itself, lead can build metal–metal bonds of an order up to three.[88] With carbon, lead forms organolead compounds similar to, but generally less stable than, typical organic compounds[89] (due to the Pb–C bond being rather weak).[62] This makes the organometallic chemistry of lead far less wide-ranging than that of tin.[90] Lead predominantly forms organolead(IV) compounds, even when starting with inorganic lead(II) reactants; very few organolead(II) compounds are known. The most well-characterized exceptions are Pb[CH(SiMe3)2]2 and Pb(η5-C5H5)2.[90]
The lead analog of the simplest organic compound, methane, is plumbane. Plumbane may be obtained in a reaction between metallic lead and atomic hydrogen.[91] Two simple derivatives, tetramethyllead and tetraethyllead, are the best-known organolead compounds. These compounds are relatively stable: tetraethyllead only starts to decompose if heated[92] or if exposed to sunlight or ultraviolet light.[93][j] With sodium metal, lead readily forms an equimolar alloy that reacts with alkyl halides to form organometallic compounds such as tetraethyllead.[94] The oxidizing nature of many organolead compounds is usefully exploited: lead tetraacetate is an important laboratory reagent for oxidation in organic synthesis.[95] Tetraethyllead, once added to gasoline, was produced in larger quantities than any other organometallic compound.[90] Other organolead compounds are less chemically stable.[89] For many organic compounds, a lead analog does not exist.[91]
Origin and occurrence[edit]
| Atomic number |
Element | Relative amount |
|---|---|---|
| 42 | Molybdenum | 0.798 |
| 46 | Palladium | 0.440 |
| 50 | Tin | 1.146 |
| 78 | Platinum | 0.417 |
| 80 | Mercury | 0.127 |
| 82 | Lead | 1 |
| 90 | Thorium | 0.011 |
| 92 | Uranium | 0.003 |
In space[edit]
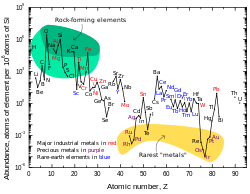
Lead’s per-particle abundance in the Solar System is 0.121 ppb (parts per billion).[96][k] This figure is two and a half times higher than that of platinum, eight times more than mercury, and seventeen times more than gold.[96] The amount of lead in the universe is slowly increasing[97] as most heavier atoms (all of which are unstable) gradually decay to lead.[98] The abundance of lead in the Solar System since its formation 4.5 billion years ago has increased by about 0.75%.[99] The solar system abundances table shows that lead, despite its relatively high atomic number, is more prevalent than most other elements with atomic numbers greater than 40.[96]
Primordial lead—which comprises the isotopes lead-204, lead-206, lead-207, and lead-208—was mostly created as a result of repetitive neutron capture processes occurring in stars. The two main modes of capture are the s- and r-processes.[100]
In the s-process (s is for «slow»), captures are separated by years or decades, allowing less stable nuclei to undergo beta decay.[101] A stable thallium-203 nucleus can capture a neutron and become thallium-204; this undergoes beta decay to give stable lead-204; on capturing another neutron, it becomes lead-205, which has a half-life of around 15 million years. Further captures result in lead-206, lead-207, and lead-208. On capturing another neutron, lead-208 becomes lead-209, which quickly decays into bismuth-209. Bismuth-209 is also radioactive and eventually decays into thallium-205 if left unperturbed. On capturing another neutron, bismuth-209 becomes bismuth-210, and this beta decays to polonium-210, which alpha decays to lead-206. The cycle hence ends at lead-206, lead-207, lead-208, and thallium-205.[102]
In the r-process (r is for «rapid»), captures happen faster than nuclei can decay.[103] This occurs in environments with a high neutron density, such as a supernova or the merger of two neutron stars. The neutron flux involved may be on the order of 1022 neutrons per square centimeter per second.[104] The r-process does not form as much lead as the s-process.[105] It tends to stop once neutron-rich nuclei reach 126 neutrons.[106] At this point, the neutrons are arranged in complete shells in the atomic nucleus, and it becomes harder to energetically accommodate more of them.[107] When the neutron flux subsides, these nuclei beta decay into stable isotopes of osmium, iridium, and platinum.[108]
On Earth[edit]
Lead is classified as a chalcophile under the Goldschmidt classification, meaning it is generally found combined with sulfur.[109] It rarely occurs in its native, metallic form.[110] Many lead minerals are relatively light and, over the course of the Earth’s history, have remained in the crust instead of sinking deeper into the Earth’s interior. This accounts for lead’s relatively high crustal abundance of 14 ppm; it is the 38th most abundant element in the crust.[111][l]
The main lead-bearing mineral is galena (PbS), which is mostly found with zinc ores.[113] Most other lead minerals are related to galena in some way; boulangerite, Pb5Sb4S11, is a mixed sulfide derived from galena; anglesite, PbSO4, is a product of galena oxidation; and cerussite or white lead ore, PbCO3, is a decomposition product of galena. Arsenic, tin, antimony, silver, gold, copper, and bismuth are common impurities in lead minerals.[113]
Lead is a fairly common element in the Earth’s crust for its high atomic number (82). Most elements of atomic number greater than 40 are less abundant.
World lead resources exceed two billion tons. Significant deposits are located in Australia, China, Ireland, Mexico, Peru, Portugal, Russia, and the United States. Global reserves—resources that are economically feasible to extract—totaled 88 million tons in 2016, of which Australia had 35 million, China 17 million, and Russia 6.4 million.[114]
Typical background concentrations of lead do not exceed 0.1 μg/m3 in the atmosphere; 100 mg/kg in soil; 4 mg/kg in vegetation and 5 μg/L in freshwater and seawater.[115]
Etymology[edit]
The modern English word lead is of Germanic origin; it comes from the Middle English leed and Old English lēad (with the macron above the «e» signifying that the vowel sound of that letter is long).[116] The Old English word is derived from the hypothetical reconstructed Proto-Germanic *lauda- (‘lead’).[117] According to linguistic theory, this word bore descendants in multiple Germanic languages of exactly the same meaning.[117]
There is no consensus on the origin of the Proto-Germanic *lauda-. One hypothesis suggests it is derived from Proto-Indo-European *lAudh- (‘lead’; capitalization of the vowel is equivalent to the macron).[118] Another hypothesis suggests it is borrowed from Proto-Celtic *ɸloud-io- (‘lead’). This word is related to the Latin plumbum, which gave the element its chemical symbol Pb. The word *ɸloud-io- is thought to be the origin of Proto-Germanic *bliwa- (which also means ‘lead’), from which stemmed the German Blei.[119]
The name of the chemical element is not related to the verb of the same spelling, which is derived from Proto-Germanic *laidijan- (‘to lead’).[120]
History[edit]
Prehistory and early history[edit]
Metallic lead beads dating back to 7000–6500 BCE have been found in Asia Minor and may represent the first example of metal smelting.[122] At that time lead had few (if any) applications due to its softness and dull appearance.[122] The major reason for the spread of lead production was its association with silver, which may be obtained by burning galena (a common lead mineral).[123] The Ancient Egyptians were the first to use lead minerals in cosmetics, an application that spread to Ancient Greece and beyond;[124] the Egyptians may have used lead for sinkers in fishing nets, glazes, glasses, enamels, and for ornaments.[123] Various civilizations of the Fertile Crescent used lead as a writing material, as coins,[125] and as a construction material.[123] Lead was used in the Ancient Chinese royal court as a stimulant,[123] as currency,[126] and as a contraceptive;[127] the Indus Valley civilization and the Mesoamericans[123] used it for making amulets; and the eastern and southern African peoples used lead in wire drawing.[128]
Classical era[edit]
Because silver was extensively used as a decorative material and an exchange medium, lead deposits came to be worked in Asia Minor from 3000 BCE; later, lead deposits were developed in the Aegean and Laurion.[129] These three regions collectively dominated production of mined lead until c. 1200 BCE.[130] Beginning circa 2000 BCE, the Phoenicians worked deposits in the Iberian peninsula; by 1600 BCE, lead mining existed in Cyprus, Greece, and Sardinia.[131]
Ancient Greek lead sling bullets with a winged thunderbolt molded on one side and the inscription «ΔΕΞΑΙ» («take that» or «catch») on the other side.[132]
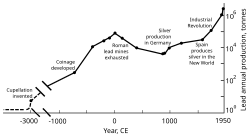
Rome’s territorial expansion in Europe and across the Mediterranean, and its development of mining, led to it becoming the greatest producer of lead during the classical era, with an estimated annual output peaking at 80,000 tonnes. Like their predecessors, the Romans obtained lead mostly as a by-product of silver smelting.[121][133] Lead mining occurred in Central Europe, Britain, the Balkans, Greece, Anatolia, and Hispania, the latter accounting for 40% of world production.[121]
Lead tablets were commonly used as a material for letters.[134] Lead coffins, cast in flat sand forms, with interchangeable motifs to suit the faith of the deceased were used in ancient Judea.[135] Lead was used to make sling bullets from the 5th century BC. In Roman times, lead sling bullets were amply used, and were effective at a distance of between 100 and 150 meters. The Balearic slingers, used as mercenaries in Carthaginian and Roman armies, were famous for their shooting distance and accuracy.[136]
Lead was used for making water pipes in the Roman Empire; the Latin word for the metal, plumbum, is the origin of the English word «plumbing». Its ease of working, its low melting point enabling the easy fabrication of completely waterproof welded joints, and its resistance to corrosion[137] ensured its widespread use in other applications, including pharmaceuticals, roofing, currency, and warfare.[138][139][140] Writers of the time, such as Cato the Elder, Columella, and Pliny the Elder, recommended lead (or lead-coated) vessels for the preparation of sweeteners and preservatives added to wine and food. The lead conferred an agreeable taste due to the formation of «sugar of lead» (lead(II) acetate), whereas copper or bronze vessels could impart a bitter flavor through verdigris formation.[141]
This metal was by far the most used material in classical antiquity, and it is appropriate to refer to the (Roman) Lead Age. Lead was to the Romans what plastic is to us.
Heinz Eschnauer and Markus Stoeppler
«Wine—An enological specimen bank», 1992[142]
The Roman author Vitruvius reported the health dangers of lead[143][144] and modern writers have suggested that lead poisoning played a major role in the decline of the Roman Empire.[145][146][n] Other researchers have criticized such claims, pointing out, for instance, that not all abdominal pain is caused by lead poisoning.[148][149] According to archaeological research, Roman lead pipes increased lead levels in tap water but such an effect was «unlikely to have been truly harmful».[150][151] When lead poisoning did occur, victims were called «saturnine», dark and cynical, after the ghoulish father of the gods, Saturn. By association, lead was considered the father of all metals.[152] Its status in Roman society was low as it was readily available[153] and cheap.[154]
Confusion with tin and antimony[edit]
Since the Bronze Age metallurgists and engineers have understood the difference between rare and valuable tin, essential for alloying with copper to produce tough and corrosion resistant bronze, and ‘cheap and cheerful’ lead. However the nomenclature in some languages is similar. Romans called lead plumbum nigrum («black lead»), and tin plumbum candidum («bright lead»). The association of lead and tin can be seen in other languages: the word olovo in Czech translates to «lead», but in Russian, its cognate олово (olovo) means «tin».[155] To add to the confusion, lead bore a close relation to antimony: both elements commonly occur as sulfides (galena and stibnite), often together. Pliny incorrectly wrote that stibnite would give lead on heating, instead of antimony.[156] In countries such as Turkey and India, the originally Persian name surma came to refer to either antimony sulfide or lead sulfide,[157] and in some languages, such as Russian, gave its name to antimony (сурьма).[158]
Middle Ages and the Renaissance[edit]
Elizabeth I of England was commonly depicted with a whitened face. Lead in face whiteners is thought to have contributed to her death.[159]
Lead mining in Western Europe declined after the fall of the Western Roman Empire, with Arabian Iberia being the only region having a significant output.[160][161] The largest production of lead occurred in South and East Asia, especially China and India, where lead mining grew rapidly.[161]
In Europe, lead production began to increase in the 11th and 12th centuries, when it was again used for roofing and piping. Starting in the 13th century, lead was used to create stained glass.[162] In the European and Arabian traditions of alchemy, lead (symbol ♄ in the European tradition)[163] was considered an impure base metal which, by the separation, purification and balancing of its constituent essences, could be transformed to pure and incorruptible gold.[164] During the period, lead was used increasingly for adulterating wine. The use of such wine was forbidden for use in Christian rites by a papal bull in 1498, but it continued to be imbibed and resulted in mass poisonings up to the late 18th century.[160][165] Lead was a key material in parts of the printing press, and lead dust was commonly inhaled by print workers, causing lead poisoning.[166] Lead also became the chief material for making bullets for firearms: it was cheap, less damaging to iron gun barrels, had a higher density (which allowed for better retention of velocity), and its lower melting point made the production of bullets easier as they could be made using a wood fire.[167] Lead, in the form of Venetian ceruse, was extensively used in cosmetics by Western European aristocracy as whitened faces were regarded as a sign of modesty.[168][169] This practice later expanded to white wigs and eyeliners, and only faded out with the French Revolution in the late 18th century. A similar fashion appeared in Japan in the 18th century with the emergence of the geishas, a practice that continued long into the 20th century. The white faces of women «came to represent their feminine virtue as Japanese women»,[170] with lead commonly used in the whitener.[171]
Outside Europe and Asia[edit]
In the New World, lead production was recorded soon after the arrival of European settlers. The earliest record dates to 1621 in the English Colony of Virginia, fourteen years after its foundation.[172] In Australia, the first mine opened by colonists on the continent was a lead mine, in 1841.[173] In Africa, lead mining and smelting were known in the Benue Trough[174] and the lower Congo Basin, where lead was used for trade with Europeans, and as a currency by the 17th century,[175] well before the scramble for Africa.
Industrial Revolution[edit]
In the second half of the 18th century, Britain, and later continental Europe and the United States, experienced the Industrial Revolution. This was the first time during which lead production rates exceeded those of Rome.[176] Britain was the leading producer, losing this status by the mid-19th century with the depletion of its mines and the development of lead mining in Germany, Spain, and the United States.[177] By 1900, the United States was the leader in global lead production, and other non-European nations—Canada, Mexico, and Australia—had begun significant production; production outside Europe exceeded that within.[178] A great share of the demand for lead came from plumbing and painting—lead paints were in regular use.[179] At this time, more (working class) people were exposed to the metal and lead poisoning cases escalated. This led to research into the effects of lead intake. Lead was proven to be more dangerous in its fume form than as a solid metal. Lead poisoning and gout were linked; British physician Alfred Baring Garrod noted a third of his gout patients were plumbers and painters. The effects of chronic ingestion of lead, including mental disorders, were also studied in the 19th century. The first laws aimed at decreasing lead poisoning in factories were enacted during the 1870s and 1880s in the United Kingdom.[179]
Modern era[edit]
Promotional poster for Dutch Boy lead paint, United States, 1912
Further evidence of the threat that lead posed to humans was discovered in the late 19th and early 20th centuries. Mechanisms of harm were better understood, lead blindness was documented, and the element was phased out of public use in the United States and Europe. The United Kingdom introduced mandatory factory inspections in 1878 and appointed the first Medical Inspector of Factories in 1898; as a result, a 25-fold decrease in lead poisoning incidents from 1900 to 1944 was reported.[180] Most European countries banned lead paint—commonly used because of its opacity and water resistance[181]—for interiors by 1930.[182]
The last major human exposure to lead was the addition of tetraethyllead to gasoline as an antiknock agent, a practice that originated in the United States in 1921. It was phased out in the United States and the European Union by 2000.[179]
In the 1970s, the United States and Western European countries introduced legislation to reduce lead air pollution.[183][184] The impact was significant: while a study conducted by the Centers for Disease Control and Prevention in the United States in 1976–1980 showed that 77.8% of the population had elevated blood lead levels, in 1991–1994, a study by the same institute showed the share of people with such high levels dropped to 2.2%.[185] The main product made of lead by the end of the 20th century was the lead–acid battery.[186]
From 1960 to 1990, lead output in the Western Bloc grew by about 31%.[187] The share of the world’s lead production by the Eastern Bloc increased from 10% to 30%, from 1950 to 1990, with the Soviet Union being the world’s largest producer during the mid-1970s and the 1980s, and China starting major lead production in the late 20th century.[188] Unlike the European communist countries, China was largely unindustrialized by the mid-20th century; in 2004, China surpassed Australia as the largest producer of lead.[189] As was the case during European industrialization, lead has had a negative effect on health in China.[190]
Production[edit]
Primary production of lead since 1840
As of 2014, production of lead is increasing worldwide due to its use in lead–acid batteries.[191] There are two major categories of production: primary from mined ores, and secondary from scrap. In 2014, 4.58 million metric tons came from primary production and 5.64 million from secondary production. The top three producers of mined lead concentrate in that year were China, Australia, and the United States.[114] The top three producers of refined lead were China, the United States, and India.[192] According to the International Resource Panel’s Metal Stocks in Society report of 2010, the total amount of lead in use, stockpiled, discarded, or dissipated into the environment, on a global basis, is 8 kg per capita. Much of this is in more developed countries (20–150 kg per capita) rather than less developed ones (1–4 kg per capita).[193]
The primary and secondary lead production processes are similar. Some primary production plants now supplement their operations with scrap lead, and this trend is likely to increase in the future. Given adequate techniques, lead obtained via secondary processes is indistinguishable from lead obtained via primary processes. Scrap lead from the building trade is usually fairly clean and is re-melted without the need for smelting, though refining is sometimes needed. Secondary lead production is therefore cheaper, in terms of energy requirements, than is primary production, often by 50% or more.[194]
Primary[edit]
Most lead ores contain a low percentage of lead (rich ores have a typical content of 3–8%) which must be concentrated for extraction.[195] During initial processing, ores typically undergo crushing, dense-medium separation, grinding, froth flotation, and drying. The resulting concentrate, which has a lead content of 30–80% by mass (regularly 50–60%),[195] is then turned into (impure) lead metal.
There are two main ways of doing this: a two-stage process involving roasting followed by blast furnace extraction, carried out in separate vessels; or a direct process in which the extraction of the concentrate occurs in a single vessel. The latter has become the most common route, though the former is still significant.[196]
Two-stage process[edit]
First, the sulfide concentrate is roasted in air to oxidize the lead sulfide:[197]
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
As the original concentrate was not pure lead sulfide, roasting yields not only the desired lead(II) oxide, but a mixture of oxides, sulfates, and silicates of lead and of the other metals contained in the ore.[198] This impure lead oxide is reduced in a coke-fired blast furnace to the (again, impure) metal:[199]
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
Impurities are mostly arsenic, antimony, bismuth, zinc, copper, silver, and gold. Typically they are removed in a series of pyrometallurgical processes. The melt is treated in a reverberatory furnace with air, steam, and sulfur, which oxidizes the impurities except for silver, gold, and bismuth. Oxidized contaminants float to the top of the melt and are skimmed off.[200][201] Metallic silver and gold are removed and recovered economically by means of the Parkes process, in which zinc is added to lead. Zinc, which is immiscible in lead, dissolves the silver and gold. The zinc solution can be separated from the lead, and the silver and gold retrieved.[201][202] De-silvered lead is freed of bismuth by the Betterton–Kroll process, treating it with metallic calcium and magnesium. The resulting bismuth dross can be skimmed off.[201]
Alternatively to the pyrometallurgical processes, very pure lead can be obtained by processing smelted lead electrolytically using the Betts process. Anodes of impure lead and cathodes of pure lead are placed in an electrolyte of lead fluorosilicate (PbSiF6). Once electrical potential is applied, impure lead at the anode dissolves and plates onto the cathode, leaving the majority of the impurities in solution.[201][203] This is a high-cost process and thus mostly reserved for refining bullion containing high percentages of impurities.[204]
Direct process[edit]
In this process, lead bullion and slag is obtained directly from lead concentrates. The lead sulfide concentrate is melted in a furnace and oxidized, forming lead monoxide. Carbon (as coke or coal gas[o]) is added to the molten charge along with fluxing agents. The lead monoxide is thereby reduced to metallic lead, in the midst of a slag rich in lead monoxide.[196]
If the input is rich in lead, as much as 80% of the original lead can be obtained as bullion; the remaining 20% forms a slag rich in lead monoxide. For a low-grade feed, all of the lead can be oxidized to a high-lead slag.[196] Metallic lead is further obtained from the high-lead (25–40%) slags via submerged fuel combustion or injection, reduction assisted by an electric furnace, or a combination of both.[196]
Alternatives[edit]
Research on a cleaner, less energy-intensive lead extraction process continues; a major drawback is that either too much lead is lost as waste, or the alternatives result in a high sulfur content in the resulting lead metal. Hydrometallurgical extraction, in which anodes of impure lead are immersed into an electrolyte and pure lead is deposited (electrowound) onto a cathode, is a technique that may have potential, but is not currently economical except in cases where electricity is very cheap.[205]
Secondary[edit]
Smelting, which is an essential part of the primary production, is often skipped during secondary production. It is only performed when metallic lead has undergone significant oxidation.[194] The process is similar to that of primary production in either a blast furnace or a rotary furnace, with the essential difference being the greater variability of yields: blast furnaces produce hard lead (10% antimony) while reverberatory and rotary kiln furnaces produced semisoft lead (3–4% antimony).[206]
The ISASMELT process is a more recent smelting method that may act as an extension to primary production; battery paste from spent lead–acid batteries (containing lead sulfate and lead oxides) has its sulfate removed by treating it with alkali, and is then treated in a coal-fueled furnace in the presence of oxygen, which yields impure lead, with antimony the most common impurity.[207] Refining of secondary lead is similar to that of primary lead; some refining processes may be skipped depending on the material recycled and its potential contamination.[207]
Of the sources of lead for recycling, lead–acid batteries are the most important; lead pipe, sheet, and cable sheathing are also significant.[194]
Applications[edit]
Bricks of lead (alloyed with 4% antimony) are used as radiation shielding.[208]
Contrary to popular belief, pencil leads in wooden pencils have never been made from lead. When the pencil originated as a wrapped graphite writing tool, the particular type of graphite used was named plumbago (literally, act for lead or lead mockup).[209]
Elemental form[edit]
Lead metal has several useful mechanical properties, including high density, low melting point, ductility, and relative inertness. Many metals are superior to lead in some of these aspects but are generally less common and more difficult to extract from parent ores. Lead’s toxicity has led to its phasing out for some uses.[210]
Lead has been used for bullets since their invention in the Middle Ages. It is inexpensive; its low melting point means small arms ammunition and shotgun pellets can be cast with minimal technical equipment; and it is denser than other common metals, which allows for better retention of velocity. It remains the main material for bullets, alloyed with other metals as hardeners.[167] Concerns have been raised that lead bullets used for hunting can damage the environment.[p]
Lead’s high density and resistance to corrosion have been exploited in a number of related applications. It is used as ballast in sailboat keels; its density allows it to take up a small volume and minimize water resistance, thus counterbalancing the heeling effect of wind on the sails.[212] It is used in scuba diving weight belts to counteract the diver’s buoyancy.[213] In 1993, the base of the Leaning Tower of Pisa was stabilized with 600 tonnes of lead.[214] Because of its corrosion resistance, lead is used as a protective sheath for underwater cables.[215]
A 17th-century gold-coated lead sculpture
Lead has many uses in the construction industry; lead sheets are used as architectural metals in roofing material, cladding, flashing, gutters and gutter joints, and on roof parapets.[216][217] Lead is still used in statues and sculptures,[q] including for armatures.[219] In the past it was often used to balance the wheels of cars; for environmental reasons this use is being phased out in favor of other materials.[114]
Lead is added to copper alloys, such as brass and bronze, to improve machinability and for its lubricating qualities. Being practically insoluble in copper the lead forms solid globules in imperfections throughout the alloy, such as grain boundaries. In low concentrations, as well as acting as a lubricant, the globules hinder the formation of swarf as the alloy is worked, thereby improving machinability. Copper alloys with larger concentrations of lead are used in bearings. The lead provides lubrication, and the copper provides the load-bearing support.[220]
Lead’s high density, atomic number, and formability form the basis for use of lead as a barrier that absorbs sound, vibration, and radiation.[221] Lead has no natural resonance frequencies;[221] as a result, sheet-lead is used as a sound deadening layer in the walls, floors, and ceilings of sound studios.[222] Organ pipes are often made from a lead alloy, mixed with various amounts of tin to control the tone of each pipe.[223][224] Lead is an established shielding material from radiation in nuclear science and in X-ray rooms[225] due to its denseness and high attenuation coefficient.[226] Molten lead has been used as a coolant for lead-cooled fast reactors.[227]
Batteries[edit]
The largest use of lead in the early 21st century is in lead–acid batteries. The lead in batteries undergoes no direct contact with humans, so there are fewer toxicity concerns.[r] People who work in lead battery production plants may be exposed to lead dust and inhale it.[229] The reactions in the battery between lead, lead dioxide, and sulfuric acid provide a reliable source of voltage.[s] Supercapacitors incorporating lead–acid batteries have been installed in kilowatt and megawatt scale applications in Australia, Japan, and the United States in frequency regulation, solar smoothing and shifting, wind smoothing, and other applications.[231] These batteries have lower energy density and charge-discharge efficiency than lithium-ion batteries, but are significantly cheaper.[232]
Coating for cables[edit]
Lead is used in high voltage power cables as shell material to prevent water diffusion into insulation; this use is decreasing as lead is being phased out.[233] Its use in solder for electronics is also being phased out by some countries to reduce the amount of environmentally hazardous waste.[234] Lead is one of three metals used in the Oddy test for museum materials, helping detect organic acids, aldehydes, and acidic gases.[235][236]
Compounds[edit]
In addition to being the main application for lead metal, lead-acid batteries are also the main consumer of lead compounds. The energy storage/release reaction used in these devices involves lead sulfate and lead dioxide:
- Pb(s) + PbO
2(s) + 2H
2SO
4(aq) → 2PbSO
4(s) + 2H
2O(l)
Other applications of lead compounds are very specialized and often fading. Lead-based coloring agents are used in ceramic glazes and glass, especially for red and yellow shades.[237] While lead paints are phased out in Europe and North America, they remain in use in less developed countries such as China,[238] India,[239] or Indonesia.[240] Lead tetraacetate and lead dioxide are used as oxidizing agents in organic chemistry. Lead is frequently used in the polyvinyl chloride coating of electrical cords.[241][242] It can be used to treat candle wicks to ensure a longer, more even burn. Because of its toxicity, European and North American manufacturers use alternatives such as zinc.[243][244] Lead glass is composed of 12–28% lead oxide, changing its optical characteristics and reducing the transmission of ionizing radiation,[245] a property used in old TVs and computer monitors with cathode-ray tubes. Lead-based semiconductors such as lead telluride and lead selenide are used in photovoltaic cells and infrared detectors.[246]
Biological effects[edit]
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H332, H351, H360Df, H373, H410 |
|
Precautionary statements |
P201, P261, P273, P304, P308, P312, P313, P340, P391[247] |
| NFPA 704 (fire diamond) |
2 0 0 |
Lead has no confirmed biological role, and there is no confirmed safe level of lead exposure.[248] A 2009 Canadian–American study concluded that even at levels that are considered to pose little to no risk, lead may cause «adverse mental health outcomes».[249] Its prevalence in the human body—at an adult average of 120 mg[t]—is nevertheless exceeded only by zinc (2500 mg) and iron (4000 mg) among the heavy metals.[251] Lead salts are very efficiently absorbed by the body.[252] A small amount of lead (1%) is stored in bones; the rest is excreted in urine and feces within a few weeks of exposure. Only about a third of lead is excreted by a child. Continual exposure may result in the bioaccumulation of lead.[253]
Toxicity[edit]
Lead is a highly poisonous metal (whether inhaled or swallowed), affecting almost every organ and system in the human body.[254] At airborne levels of 100 mg/m3, it is immediately dangerous to life and health.[255] Most ingested lead is absorbed into the bloodstream.[256] The primary cause of its toxicity is its predilection for interfering with the proper functioning of enzymes. It does so by binding to the sulfhydryl groups found on many enzymes,[257] or mimicking and displacing other metals which act as cofactors in many enzymatic reactions.[258] The essential metals that lead interacts with include calcium, iron, and zinc.[259] High levels of calcium and iron tend to provide some protection from lead poisoning; low levels cause increased susceptibility.[252]
Effects[edit]
Lead can cause severe damage to the brain and kidneys and, ultimately, death. By mimicking calcium, lead can cross the blood–brain barrier. It degrades the myelin sheaths of neurons, reduces their numbers, interferes with neurotransmission routes, and decreases neuronal growth.[257] In the human body, lead inhibits porphobilinogen synthase and ferrochelatase, preventing both porphobilinogen formation and the incorporation of iron into protoporphyrin IX, the final step in heme synthesis. This causes ineffective heme synthesis and microcytic anemia.[260]
Symptoms of lead poisoning
Symptoms of lead poisoning include nephropathy, colic-like abdominal pains, and possibly weakness in the fingers, wrists, or ankles. Small blood pressure increases, particularly in middle-aged and older people, may be apparent and can cause anemia.[citation needed] Several studies, mostly cross-sectional, found an association between increased lead exposure and decreased heart rate variability.[261] In pregnant women, high levels of exposure to lead may cause miscarriage. Chronic, high-level exposure has been shown to reduce fertility in males.[262]
In a child’s developing brain, lead interferes with synapse formation in the cerebral cortex, neurochemical development (including that of neurotransmitters), and the organization of ion channels.[263] Early childhood exposure has been linked with an increased risk of sleep disturbances and excessive daytime drowsiness in later childhood.[264] High blood levels are associated with delayed puberty in girls.[265] The rise and fall in exposure to airborne lead from the combustion of tetraethyl lead in gasoline during the 20th century has been linked with historical increases and decreases in crime levels.
Exposure sources[edit]
Lead exposure is a global issue since lead mining and smelting, and battery manufacturing, disposal, and recycling, are common in many countries. Lead enters the body via inhalation, ingestion, or skin absorption. Almost all inhaled lead is absorbed into the body; for ingestion, the rate is 20–70%, with children absorbing a higher percentage than adults.[266]
Poisoning typically results from ingestion of food or water contaminated with lead, and less commonly after accidental ingestion of contaminated soil, dust, or lead-based paint.[267] Seawater products can contain lead if affected by nearby industrial waters.[268] Fruit and vegetables can be contaminated by high levels of lead in the soils they were grown in. Soil can be contaminated through particulate accumulation from lead in pipes, lead paint, and residual emissions from leaded gasoline.[269]
The use of lead for water pipes is a problem in areas with soft or acidic water.[270] Hard water forms insoluble protective layers on the inner surface of the pipes, whereas soft and acidic water dissolves the lead pipes.[271] Dissolved carbon dioxide in the carried water may result in the formation of soluble lead bicarbonate; oxygenated water may similarly dissolve lead as lead(II) hydroxide. Drinking such water, over time, can cause health problems due to the toxicity of the dissolved lead. The harder the water the more calcium bicarbonate and sulfate it will contain, and the more the inside of the pipes will be coated with a protective layer of lead carbonate or lead sulfate.[272]
Kymographic recording of the effect of lead acetate on frog heart experimental set up.
Ingestion of applied lead-based paint is the major source of exposure for children:
a direct source is chewing on old painted window sills. Alternatively, as the applied dry paint deteriorates, it peels, is pulverized into dust and then enters the body through hand-to-mouth contact or contaminated food, water, or alcohol. Ingesting certain home remedies may result in exposure to lead or its compounds.[273]
Inhalation is the second major exposure pathway, affecting smokers and especially workers in lead-related occupations.[256] Cigarette smoke contains, among other toxic substances, radioactive lead-210.[274] «As a result of EPA’s regulatory efforts, levels of lead in the air [in the United States] decreased by 86 percent between 2010 and 2020.»[275] The concentration of lead in the air in the United States fell below the national standard of 0.15 μg/m3[276] in 2014.[277]
Skin exposure may be significant for people working with organic lead compounds. The rate of skin absorption is lower for inorganic lead.[278]
Lead in plastic toys[edit]
According to the United States Center for Disease Control, the use of lead in plastics has not been banned. Lead softens the plastic and makes it more flexible so that it can go back to its original shape. It may also be used in plastic toys to stabilize molecules from heat. Lead dust can be formed when plastic is exposed to sunlight, air, and detergents that break down the chemical bond between the lead and plastics.[279]
Treatment[edit]
Treatment for lead poisoning normally involves the administration of dimercaprol and succimer.[280] Acute cases may require the use of disodium calcium edetate, the calcium chelate, and the disodium salt of ethylenediaminetetraacetic acid (EDTA). It has a greater affinity for lead than calcium, with the result that lead chelate is formed by exchange and excreted in the urine, leaving behind harmless calcium.[281]
Environmental effects[edit]
Battery collection site in Dakar, Senegal, where at least 18 children died of lead poisoning in 2008
The extraction, production, use, and disposal of lead and its products have caused significant contamination of the Earth’s soils and waters. Atmospheric emissions of lead were at their peak during the Industrial Revolution, and the leaded gasoline period in the second half of the twentieth century. [282]
Lead releases originate from natural sources (i.e., concentration of the naturally occurring lead), industrial production, incineration and recycling, and mobilization of previously buried lead.[282] In particular, as lead has been phased out from other uses, in the Global South, lead recycling operations designed to extract cheap lead used for global manufacturing have become a well documented source of exposure.[283] Elevated concentrations of lead persist in soils and sediments in post-industrial and urban areas; industrial emissions, including those arising from coal burning,[284] continue in many parts of the world, particularly in the developing countries.[285]
Lead can accumulate in soils, especially those with a high organic content, where it remains for hundreds to thousands of years. Environmental lead can compete with other metals found in and on plants surfaces potentially inhibiting photosynthesis and at high enough concentrations, negatively affecting plant growth and survival. Contamination of soils and plants can allow lead to ascend the food chain affecting microorganisms and animals. In animals, lead exhibits toxicity in many organs, damaging the nervous, renal, reproductive, hematopoietic, and cardiovascular systems after ingestion, inhalation, or skin absorption.[286] Fish uptake lead from both water and sediment;[287] bioaccumulation in the food chain poses a hazard to fish, birds, and sea mammals.[288]
Anthropogenic lead includes lead from shot and sinkers. These are among the most potent sources of lead contamination along with lead production sites.[289] Lead was banned for shot and sinkers in the United States in 2017,[290] although that ban was only effective for a month,[291] and a similar ban is being considered in the European Union.[292]
Analytical methods for the determination of lead in the environment include spectrophotometry, X-ray fluorescence, atomic spectroscopy and electrochemical methods. A specific ion-selective electrode has been developed based on the ionophore S,S’-methylenebis (N,N-diisobutyldithiocarbamate).[293] An important biomarker assay for lead poisoning is δ-aminolevulinic acid levels in plasma, serum, and urine.[294]
Restriction and remediation[edit]
Radiography of a swan found dead in Condé-sur-l’Escaut (northern France), highlighting lead shot. There are hundreds of lead pellets (a dozen is enough to kill an adult swan within a few days). Such bodies are sources of environmental contamination by lead.
By the mid-1980s, there was significant decline in the use of lead in industry. In the United States, environmental regulations reduced or eliminated the use of lead in non-battery products, including gasoline, paints, solders, and water systems. Particulate control devices were installed in coal-fired power plants to capture lead emissions.[284] In 1992, U.S. Congress required the Environmental Protection Agency to reduce the blood lead levels of the country’s children.[295] Lead use was further curtailed by the European Union’s 2003 Restriction of Hazardous Substances Directive.[296] A large drop in lead deposition occurred in the Netherlands after the 1993 national ban on use of lead shot for hunting and sport shooting: from 230 tonnes in 1990 to 47.5 tonnes in 1995.[297]
In the United States, the permissible exposure limit for lead in the workplace, comprising metallic lead, inorganic lead compounds, and lead soaps, was set at 50 μg/m3 over an 8-hour workday, and the blood lead level limit at 5 μg per 100 g of blood in 2012.[298] Lead may still be found in harmful quantities in stoneware,[299] vinyl[300] (such as that used for tubing and the insulation of electrical cords), and Chinese brass.[u] Old houses may still contain lead paint.[300] White lead paint has been withdrawn from sale in industrialized countries, but specialized uses of other pigments such as yellow lead chromate remain.[181] Stripping old paint by sanding produces dust which can be inhaled.[302] Lead abatement programs have been mandated by some authorities in properties where young children live.[303]
Lead waste, depending on the jurisdiction and the nature of the waste, may be treated as household waste (to facilitate lead abatement activities),[304] or potentially hazardous waste requiring specialized treatment or storage.[305] Lead is released into the environment in shooting places and a number of lead management practices have been developed to counter the lead contamination.[306] Lead migration can be enhanced in acidic soils; to counter that, it is advised soils be treated with lime to neutralize the soils and prevent leaching of lead.[307]
Research has been conducted on how to remove lead from biosystems by biological means: Fish bones are being researched for their ability to bioremediate lead in contaminated soil.[308][309] The fungus Aspergillus versicolor is effective at absorbing lead ions from industrial waste before being released to water bodies.[310] Several bacteria have been researched for their ability to remove lead from the environment, including the sulfate-reducing bacteria Desulfovibrio and Desulfotomaculum, both of which are highly effective in aqueous solutions.[311]
See also[edit]
- Derek Bryce-Smith – one of the earliest campaigners against lead in petrol in the UK
- Thomas Midgley Jr. – discovered that the addition of tetraethyllead to gasoline prevented «knocking» in internal combustion engines
- Clair Patterson – instrumental in the banning of tetraethyllead in gasoline in the US and lead solder in food cans.
- Robert A. Kehoe – foremost medical advocate for the use of tetraethyllead as an additive in gasoline.
Notes[edit]
- ^ The tetrahedral allotrope of tin is called α- or gray tin and is stable only at or below 13.2 °C (55.8 °F). The stable form of tin above this temperature is called β- or white tin and has a distorted face centered cubic (tetragonal) structure which can be derived by compressing the tetrahedra of gray tin along their cubic axes. White tin effectively has a structure intermediate between the regular tetrahedral structure of gray tin, and the regular face centered cubic structure of lead, consistent with the general trend of increasing metallic character going down any representative group.[14]
- ^ A quasicrystalline thin-film allotrope of lead, with pentagonal symmetry, was reported in 2013. The allotrope was obtained by depositing lead atoms on the surface of an icosahedral silver-indium-ytterbium quasicrystal. Its conductivity was not recorded.[15][16]
- ^ Diamond cubic structures with lattice parameters around the lattice parameter of silicon exists both in thin lead and tin films, and in massive lead and tin, freshly solidified in vacuum of ~5 x 10−6 Torr. Experimental evidence for almost identical structures of at least three oxide types is presented, demonstrating that lead and tin behave like silicon not only in the initial stages of crystallization, but also in the initial stages of oxidation.[17]
- ^ British English: to go down like a lead balloon.
- ^ Malleability describes how easily it deforms under compression, whereas ductility means its ability to stretch.
- ^ A (wet) finger can be dipped into molten lead without risk of a burning injury.[30]
- ^ An even number of either protons or neutrons generally increases the nuclear stability of isotopes, compared to isotopes with odd numbers. No elements with odd atomic numbers have more than two stable isotopes; even-numbered elements have multiple stable isotopes, with tin (element 50) having the highest number of isotopes of all elements, ten.[34] See Even and odd atomic nuclei for more details.
- ^ The half-life found in the experiment was 1.9×1019 years.[37] A kilogram of natural bismuth would have an activity value of approximately 0.003 becquerels (decays per second). For comparison, the activity value of natural radiation in the human body is around 65 becquerels per kilogram of body weight (4500 becquerels on average).[38]
- ^ Lead-205 decays solely via electron capture, which means when there are no electrons available and lead is fully ionized with all 82 electrons removed it cannot decay. Fully ionized thallium-205, the isotope lead-205 would decay to, becomes unstable and can decay into a bound state of lead-205.[49]
- ^ Tetraphenyllead is even more thermally stable, decomposing at 270 °C.[90]
- ^ Abundances in the source are listed relative to silicon rather than in per-particle notation. The sum of all elements per 106 parts of silicon is 2.6682×1010 parts; lead comprises 3.258 parts.
- ^ Elemental abundance figures are estimates and their details may vary from source to source.[112]
- ^ The inscription reads: «Made when the Emperor Vespasian was consul for the ninth term and the Emperor Titus was consul for the seventh term, when Gnaeus Iulius Agricola was imperial governor (of Britain).»
- ^ The fact that Julius Caesar fathered only one child, as well as the alleged sterility of his successor, Caesar Augustus, have been attributed to lead poisoning.[147]
- ^ Gaseous by-product of the coking process, containing carbon monoxide, hydrogen and methane; used as a fuel.
- ^ California began banning lead bullets for hunting on that basis in July 2015.[211]
- ^ For example, a firm «…producing quality [lead] garden ornament from our studio in West London for over a century».[218]
- ^ Potential injuries to regular users of such batteries are not related to lead’s toxicity.[228]
- ^ See[230] for details on how a lead–acid battery works.
- ^ Rates vary greatly by country.[250]
- ^ An alloy of brass (copper and zinc) with lead, iron, tin, and sometimes antimony.[301]
References[edit]
- ^ «Standard Atomic Weights: Lead». CIAAW. 2020.
- ^ a b Meija et al. 2016.
- ^ Pb(0) carbonyls have been observered in reaction between lead atoms and carbon monoxide; see Ling, Jiang; Qiang, Xu (2005). «Observation of the lead carbonyls PbnCO (n=1–4): Reactions of lead atoms and small clusters with carbon monoxide in solid argon». The Journal of Chemical Physics. 122 (3): 034505. 122 (3): 34505. Bibcode:2005JChPh.122c4505J. doi:10.1063/1.1834915. ISSN 0021-9606. PMID 15740207.
- ^ Weast, Astle & Beyer 1983, p. E110.
- ^ Theodore Low De Vinne (1899). The Practice of Typography: A Treatise on the Processes of Type-making, the Point System, the Names, Sizes, Styles, and Prices of Plain Printing Types. Century Company. pp. 9–36.
- ^ Lide 2005, p. 10-179.
- ^ Pyykkö 1988, pp. 563–594.
- ^ Claudio, Godwin & Magyar 2002, pp. 1–144.
- ^ Norman 1996, p. 36.
- ^ Greenwood & Earnshaw 1998, pp. 226–227, 374.
- ^ Christensen 2002, p. 867.
- ^ Slater 1964.
- ^ Considine & Considine 2013, pp. 501, 2970.
- ^ Parthé 1964, p. 13.
- ^ Sharma et al. 2013.
- ^ Sharma et al. 2014, p. 174710.
- ^ Peneva, Djuneva & Tsukeva 1981.
- ^ Greenwood & Earnshaw 1998, p. 372.
- ^ Greenwood & Earnshaw 1998, pp. 372–373.
- ^ a b Thornton, Rautiu & Brush 2001, p. 6.
- ^ Lide 2005, pp. 12–35, 12–40.
- ^ Brenner 2003, p. 396.
- ^ Jones 2014, p. 42.
- ^ Lide 2005, pp. 4–13, 4–21, 4–33.
- ^ Vogel & Achilles 2013, p. 8.
- ^ Anderson 1869, pp. 341–343.
- ^ Gale & Totemeier 2003, pp. 15–2–15–3.
- ^ Thornton, Rautiu & Brush 2001, p. 8.
- ^ a b Lide 2005, p. 12-219.
- ^ Willey 1999.
- ^ Lide 2005, p. 12-45.
- ^ Blakemore 1985, p. 272.
- ^ Webb, Marsiglio & Hirsch 2015.
- ^ a b c d e IAEA — Nuclear Data Section 2017.
- ^ University of California Nuclear Forensic Search Project.
- ^ a b Stone 1997.
- ^ de Marcillac et al. 2003, pp. 876–78.
- ^ World Nuclear Association 2015.
- ^ Beeman et al. 2013.
- ^ Radioactive Decay Series 2012.
- ^ Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials et al. 1999.
- ^ Smirnov, Borisevich & Sulaberidze 2012.
- ^ Greenwood & Earnshaw 1998, p. 368.
- ^ Levin 2009, pp. 40–41.
- ^ Webb 2000, p. 115.
- ^ Wrackmeyer & Horchler 1990.
- ^ Cangelosi & Pecoraro 2015.
- ^ Fiorini 2010, pp. 7–8.
- ^ Takahashi et al. 1987.
- ^ Thürmer, Williams & Reutt-Robey 2002, pp. 2033–2035.
- ^ Tétreault, Sirois & Stamatopoulou 1998, pp. 17–32.
- ^ Thornton, Rautiu & Brush 2001, pp. 10–11.
- ^ a b c d e f Greenwood & Earnshaw 1998, p. 373.
- ^ Bretherick 2016, p. 1442.
- ^ Harbison, Bourgeois & Johnson 2015, p. 132.
- ^ a b Greenwood & Earnshaw 1998, p. 374.
- ^ Thornton, Rautiu & Brush 2001, pp. 11–12.
- ^ Polyanskiy 1986, p. 20.
- ^ Kaupp 2014, pp. 9–10.
- ^ Dieter & Watson 2009, p. 509.
- ^ Hunt 2014, p. 215.
- ^ a b c King 1995, pp. 43–63.
- ^ Bunker & Casey 2016, p. 89.
- ^ Whitten, Gailey & David 1996, pp. 904–905.
- ^ Greenwood & Earnshaw 1998, p. 384.
- ^ Greenwood & Earnshaw 1998, p. 387.
- ^ a b Greenwood & Earnshaw 1998, p. 389.
- ^ Zuckerman & Hagen 1989, p. 426.
- ^ Funke 2013.
- ^ a b Greenwood & Earnshaw 1998, p. 382.
- ^ Bharara & Atwood 2006, p. 4.
- ^ Greenwood & Earnshaw 1998, p. 388.
- ^ Toxicological Profile for Lead 2007, p. 277.
- ^ Downs & Adams 2017, p. 1128.
- ^ Brescia 2012, p. 234.
- ^ Macintyre 1992, p. 3775.
- ^ Silverman 1966, pp. 2067–2069.
- ^ Greenwood & Earnshaw 1998, p. 381.
- ^ Yong, Hoffmann & Fässler 2006, pp. 4774–4778.
- ^ Becker et al. 2008, pp. 9965–9978.
- ^ Mosseri, Henglein & Janata 1990, pp. 2722–2726.
- ^ Konu & Chivers 2011, pp. 391–392.
- ^ Hadlington 2017, p. 59.
- ^ Greenwood & Earnshaw 1998, pp. 384–386.
- ^ Röhr 2017.
- ^ Alsfasser 2007, pp. 261–263.
- ^ Greenwood & Earnshaw 1998, p. 393.
- ^ Stabenow, Saak & Weidenbruch 2003.
- ^ a b Polyanskiy 1986, p. 43.
- ^ a b c d Greenwood & Earnshaw 1998, p. 404.
- ^ a b Wiberg, Wiberg & Holleman 2001, p. 918.
- ^ Toxicological Profile for Lead 2007, p. 287.
- ^ Polyanskiy 1986, p. 44.
- ^ Windholz 1976.
- ^ Zýka 1966, p. 569.
- ^ a b c d Lodders 2003, pp. 1222–1223.
- ^ Roederer et al. 2009, pp. 1963–1980.
- ^ Lochner, Rohrbach & Cochrane 2005, p. 12.
- ^ Lodders 2003, p. 1224.
- ^ Burbidge et al. 1957, pp. 608–615.
- ^ Burbidge et al. 1957, p. 551.
- ^ Burbidge et al. 1957, pp. 608–609.
- ^ Burbidge et al. 1957, p. 553.
- ^ Frebel 2015, pp. 114–115.
- ^ Burbidge et al. 1957, pp. 608–610.
- ^ Burbidge et al. 1957, p. 595.
- ^ Burbidge et al. 1957, p. 596.
- ^ Burbidge et al. 1957, pp. 582, 609–615.
- ^ Langmuir & Broecker 2012, pp. 183–184.
- ^ Davidson et al. 2014, pp. 4–5.
- ^ Emsley 2011, pp. 286, passim.
- ^ Cox 1997, p. 182.
- ^ a b Davidson et al. 2014, p. 4.
- ^ a b c d United States Geological Survey 2017, p. 97.
- ^ Rieuwerts 2015, p. 225.
- ^ Merriam-Webster.
- ^ a b Kroonen 2013, *lauda-.
- ^ Nikolayev 2012.
- ^ Kroonen 2013, *bliwa- 2.
- ^ Kroonen 2013, *laidijan-.
- ^ a b c Hong et al. 1994, pp. 1841–1843.
- ^ a b Rich 1994, p. 4.
- ^ a b c d e Winder 1993b.
- ^ History of Cosmetics.
- ^ Chapurukha Kusimba, June 20, 2017. «Making Cents of Currency’s Ancient Rise». Smithsonian Magazine. Retrieved 5 November 2021.
- ^ Yu & Yu 2004, p. 26.
- ^ Toronto museum explores 2003.
- ^ Bisson & Vogel 2000, p. 105.
- ^ Wood, Hsu & Bell 2021.
- ^ Rich 1994, p. 5.
- ^ United States Geological Survey 1973.
- ^ Lead sling bullet.
- ^ de Callataÿ 2005, pp. 361–372.
- ^ Ceccarelli 2013, p. 35.
- ^ Ossuaries and Sarcophagi.
- ^ Calvo Rebollar 2019, p. 45.
- ^ Rich 1994, p. 6.
- ^ Thornton, Rautiu & Brush 2001, pp. 179–184.
- ^ Bisel & Bisel 2002, pp. 459–460.
- ^ Retief & Cilliers 2006, pp. 149–151.
- ^ Grout 2017.
- ^ Eschnauer & Stoeppler 1992, p. 58.
- ^ Hodge 1981, pp. 486–491.
- ^ Marcus Vitruvius Pollio (1914) [c. 15 BC]. De architectura. Book 8, 10-11 fulltext.
- ^ Gilfillan 1965, pp. 53–60.
- ^ Nriagu 1983, pp. 660–663.
- ^ Frankenburg 2014, p. 16.
- ^ Scarborough 1984.
- ^ Waldron 1985, pp. 107–108.
- ^ Reddy & Braun 2010, p. 1052.
- ^ Delile et al. 2014, pp. 6594–6599.
- ^ Finger 2006, p. 184.
- ^ Lewis 1985, p. 15.
- ^ Thornton, Rautiu & Brush 2001, p. 183.
- ^ Polyanskiy 1986, p. 8.
- ^ Thomson 1830, p. 74.
- ^ Oxford English Dictionary, surma.
- ^ Vasmer 1986–1987, сурьма.
- ^ Kellett 2012, pp. 106–107.
- ^ a b Winder 1993a.
- ^ a b Rich 1994, p. 7.
- ^ Rich 1994, p. 8.
- ^ Ede & Cormack 2016, p. 54.
- ^ Cotnoir 2006, p. 35.
- ^ Samson 1885, p. 388.
- ^ Sinha et al. 1993.
- ^ a b Ramage 1980, p. 8.
- ^ Tungate 2011, p. 14.
- ^ Donnelly 2014, pp. 171–172.
- ^ Ashikari 2003, p. 65.
- ^ Nakashima et al. 1998, p. 59.
- ^ Rabinowitz 1995, p. 66.
- ^ Gill & Libraries Board of South Australia 1974, p. 69.
- ^ Bisson & Vogel 2000, p. 85.
- ^ Bisson & Vogel 2000, pp. 131–132.
- ^ Hong et al. 1994, pp. 1841–43.
- ^ Lead mining.
- ^ Rich 1994, p. 11.
- ^ a b c Riva et al. 2012, pp. 11–16.
- ^ Hernberg 2000, p. 246.
- ^ a b Crow 2007.
- ^ Markowitz & Rosner 2000, p. 37.
- ^ More et al. 2017.
- ^ American Geophysical Union 2017.
- ^ Centers for Disease Control and Prevention 1997.
- ^ Rich 1994, p. 117.
- ^ Rich 1994, p. 17.
- ^ Rich 1994, pp. 91–92.
- ^ United States Geological Survey 2005.
- ^ Zhang et al. 2012, pp. 2261–2273.
- ^ Tolliday 2014.
- ^ Guberman 2016, pp. 42.14–15.
- ^ Graedel 2010.
- ^ a b c Thornton, Rautiu & Brush 2001, p. 56.
- ^ a b Davidson et al. 2014, p. 6.
- ^ a b c d Davidson et al. 2014, p. 17.
- ^ Thornton, Rautiu & Brush 2001, p. 51.
- ^ Davidson et al. 2014, pp. 11–12.
- ^ Thornton, Rautiu & Brush 2001, pp. 51–52.
- ^ Davidson et al. 2014, p. 25.
- ^ a b c d Primary Lead Refining.
- ^ Pauling 1947.
- ^ Davidson et al. 2014, p. 34.
- ^ Davidson et al. 2014, p. 23.
- ^ Thornton, Rautiu & Brush 2001, pp. 52–53.
- ^ United States Environmental Protection Agency 2010, p. 1.
- ^ a b Thornton, Rautiu & Brush 2001, p. 57.
- ^ Street & Alexander 1998, p. 181.
- ^ Evans 1908, pp. 133–179.
- ^ Baird & Cann 2012, pp. 537–538, 543–547.
- ^ California Department of Fish and Wildlife.
- ^ Parker 2005, pp. 194–195.
- ^ Krestovnikoff & Halls 2006, p. 70.
- ^ Street & Alexander 1998, p. 182.
- ^ Jensen 2013, p. 136.
- ^ Think Lead research.
- ^ Weatherings to Parapets.
- ^ Lead garden ornaments 2016.
- ^ Putnam 2003, p. 216.
- ^ Copper Development Association.
- ^ a b Rich 1994, p. 101.
- ^ Guruswamy 2000, p. 31.
- ^ Audsley 1965, pp. 250–251.
- ^ Palmieri 2006, pp. 412–413.
- ^ National Council on Radiation Protection and Measurements 2004, p. 16.
- ^ Thornton, Rautiu & Brush 2001, p. 7.
- ^ Tuček, Carlsson & Wider 2006, p. 1590.
- ^ Concordia University 2016.
- ^ Toxicological Profile for Lead 2007, pp. 5–6.
- ^ Progressive Dynamics, Inc.
- ^ Olinsky-Paul 2013.
- ^ Gulbinska 2014.
- ^ Rich 1994, pp. 133–134.
- ^ Zhao 2008, p. 440.
- ^ Beiner et al. 2015.
- ^ Szczepanowska 2013, pp. 84–85.
- ^ Burleson 2001, p. 23.
- ^ Insight Explorer & IPEN 2016.
- ^ Singh 2017.
- ^ Ismawati et al. 2013, p. 2.
- ^ Zweifel 2009, p. 438.
- ^ Wilkes et al. 2005, p. 106.
- ^ Randerson 2002.
- ^ Nriagu & Kim 2000, pp. 37–41.
- ^ Amstock 1997, pp. 116–119.
- ^ Rogalski 2010, pp. 485–541.
- ^ «Lead 695912».
- ^ World Health Organization 2018.
- ^ Bouchard et al. 2009.
- ^ World Health Organization 2000, pp. 149–153.
- ^ Emsley 2011, pp. 280, 621, 255.
- ^ a b Luckey & Venugopal 1979, pp. 177–178.
- ^ Toxic Substances Portal.
- ^ United States Food and Drug Administration 2015, p. 42.
- ^ National Institute for Occupational Safety and Health.
- ^ a b Occupational Safety and Health Administration.
- ^ a b Rudolph et al. 2003, p. 369.
- ^ Dart, Hurlbut & Boyer-Hassen 2004, p. 1426.
- ^ Kosnett 2006, p. 238.
- ^ Cohen, Trotzky & Pincus 1981, pp. 904–906.
- ^ Navas-Acien 2007.
- ^ Sokol 2005, p. 133, passim.
- ^ Mycyk, Hryhorczuk & Amitai 2005, p. 462.
- ^ Liu et al. 2015, pp. 1869–1874.
- ^ Schoeters et al. 2008, pp. 168–175.
- ^ Tarragó 2012, p. 16.
- ^ Toxicological Profile for Lead 2007, p. 4.
- ^ Bremner 2002, p. 101.
- ^ Agency for Toxic Substances and Disease Registry.
- ^ Thornton, Rautiu & Brush 2001, p. 17.
- ^ Moore 1977, pp. 109–115.
- ^ Wiberg, Wiberg & Holleman 2001, p. 914.
- ^ Tarragó 2012, p. 11.
- ^ Centers for Disease Control and Prevention 2015.
- ^ «Lead (Pb) Air Pollution». epa.gov. United States Environmental Protection Agency. 8 July 2022. Retrieved 22 July 2022.
As a result of EPA’s regulatory efforts, levels of lead in the air nationally decreased by 86 percent between 2010 and 2020.
- ^ «NAAQS Table». epa.gov. United States Environmental Protection Agency. 5 April 2022. Retrieved 22 July 2022.
National Ambient Air Quality Standards (40 CFR part 50) for six principal pollutants
- ^ «Lead Trends». epa.gov. United States Environmental Protection Agency. 1 June 2022.
- ^ Wani, Ara & Usman 2015, pp. 57, 58.
- ^ «Lead in Consumer Products | Sources of Lead | CDC». www.cdc.gov. 1 February 2022. Retrieved 16 June 2022.
- ^ Prasad 2010, pp. 651–652.
- ^ Masters, Trevor & Katzung 2008, pp. 481–483.
- ^ a b United Nations Environment Programme 2010, p. 4.
- ^ Renfrew, Daniel (2019). Life without lead : contamination, crisis, and hope in Uruguay. Oakland, California. p. 8. ISBN 978-0-520-96824-0. OCLC 1102765674.
- ^ a b Trace element emission 2012.
- ^ United Nations Environment Programme 2010, p. 6.
- ^ Assi et al. 2016.
- ^ World Health Organization 1995.
- ^ UK Marine SACs Project 1999.
- ^ United Nations Environment Programme 2010, p. 9.
- ^ McCoy 2017.
- ^ Cama 2017.
- ^ Layton 2017.
- ^ Hauser 2017, pp. 49–60.
- ^ Lauwerys & Hoet 2001, pp. 115, 116–117.
- ^ Auer et al. 2016, p. 4.
- ^ Petzel, Juuti & Sugimoto 2004, pp. 122–124.
- ^ Deltares & Netherlands Organisation for Applied Scientific Research 2016.
- ^ Agency for Toxic Substances and Disease Registry 2017.
- ^ Grandjean 1978, pp. 303–321.
- ^ a b Levin et al. 2008, p. 1288.
- ^ Duda 1996, p. 242.
- ^ Marino et al. 1990, pp. 1183–1185.
- ^ Schoch 1996, p. 111.
- ^ United States Environmental Protection Agency 2000.
- ^ Lead in Waste 2016.
- ^ United States Environmental Protection Agency 2005, p. I-1.
- ^ United States Environmental Protection Agency 2005, p. III-5–III-6.
- ^ Freeman 2012, pp. a20–a21.
- ^ Young 2012.
- ^ Acton 2013, pp. 94–95.
- ^ Park et al. 2011, pp. 162–174.
Bibliography[edit]
This article was submitted to WikiJournal of Science for external academic peer review in 2017 (reviewer reports). The updated content was reintegrated into the Wikipedia page under a CC-BY-SA-3.0 license (2018). The version of record as reviewed is:
Mikhail Boldyrev; et al. (3 July 2018). «Lead: properties, history, and applications» (PDF). WikiJournal of Science. 1 (2): 7. doi:10.15347/WJS/2018.007. ISSN 2470-6345. Wikidata Q56050531.
- Acton, Q. A., ed. (2013). Issues in Global Environment—Pollution and Waste Management: 2012 Edition. ScholarlyEditions. ISBN 978-1-4816-4665-9.
- Agency for Toxic Substances and Disease Registry. «Information for the Community: Lead Toxicity» (MP4 webcast, 82 MB). Retrieved 11 February 2017.
- Agency for Toxic Substances and Disease Registry (2017). «Lead Toxicity. What Are U.S. Standards for Lead Levels?». Retrieved 12 June 2018.
- Alsfasser, R. (2007). Moderne anorganische Chemie [Modern inorganic chemistry] (in German). Walter de Gruyter. ISBN 978-3-11-019060-1.
- American Geophysical Union (2017). «Human Activity Has Polluted European Air for 2000 Years». Eos Science News. Archived from the original on 27 June 2017. Retrieved 4 July 2017.
- Amstock, J. S. (1997). Handbook of Glass in Construction. McGraw-Hill Professional. ISBN 978-0-07-001619-4.
- Anderson, J. (1869). «Malleability and ductility of metals». Scientific American. 21 (22): 341–43. doi:10.1038/scientificamerican11271869-341.
- Ashikari, M. (2003). «The memory of the women’s white faces: Japaneseness and the ideal image of women». Japan Forum. 15 (1): 55–79. doi:10.1080/0955580032000077739. S2CID 144510689.
- Assi, M. A.; Hezmee, M. N. M.; Haron, A. W.; et al. (2016). «The detrimental effects of lead on human and animal health». Veterinary World. 9 (6): 660–671. doi:10.14202/vetworld.2016.660-671. ISSN 0972-8988. PMC 4937060. PMID 27397992.
- Auer, Charles M.; Kover, Frank D.; Aidala, James V.; Greenwood, Mark (1 March 2016). Toxic Substances: A Half Century of Progress (PDF) (Report). EPA Alumni Association. Retrieved 1 January 2019.
- Audsley, G. A. (1965). The Art of Organ Building. Vol. 2. Courier. ISBN 978-0-486-21315-6.
- Baird, C.; Cann, N. (2012). Environmental Chemistry (5th ed.). W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
- Becker, M.; Förster, C.; Franzen, C.; et al. (2008). «Persistent radicals of trivalent tin and lead». Inorganic Chemistry. 47 (21): 9965–78. doi:10.1021/ic801198p. PMID 18823115.
- Beeman, J. W.; Bellini, F.; Cardani, L.; et al. (2013). «New experimental limits on the α decays of lead isotopes». European Physical Journal A. 49 (50): 50. arXiv:1212.2422. Bibcode:2013EPJA…49…50B. doi:10.1140/epja/i2013-13050-7. S2CID 119280082.
- Beiner, G. G.; Lavi, M.; Seri, H.; et al. (2015). «Oddy Tests: Adding the Analytical Dimension». Collection Forum. 29 (1–2): 22–36. doi:10.14351/0831-4985-29.1.22. ISSN 0831-4985.
- Bharara, M. S.; Atwood, D. A. (2006). «Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in theEncyclopedia of Inorganic Chemistry, First Edition». Lead: Inorganic Chemistry. doi:10.1002/0470862106.ia118. ISBN 978-0470860786.
- Bisel, S. C.; Bisel, J. F. (2002). «Health and nutrition at Herculaneum». In Jashemski, W. F.; Meyer, F. G. (eds.). The Natural History of Pompeii. Cambridge University Press. pp. 451–75. ISBN 978-0-521-80054-9.
- Bisson, M. S.; Vogel, J. O. (2000). Ancient African Metallurgy: The Sociocultural Context. Rowman & Littlefield. ISBN 978-0-7425-0261-1.
- Blakemore, J. S. (1985). Solid State Physics. Cambridge University Press. ISBN 978-0-521-31391-9.
- Bouchard, M. F.; Bellinger, D. C.; Weuve, J.; et al. (2009). «Blood Lead Levels and Major Depressive Disorder, Panic Disorder, and Generalized Anxiety Disorder in US Young Adults». Archives of General Psychiatry. 66 (12): 1313–9. doi:10.1001/archgenpsychiatry.2009.164. ISSN 0003-990X. PMC 2917196. PMID 19996036.
- Bremner, H. A. (2002). Safety and Quality Issues in Fish Processing. Elsevier. ISBN 978-1-85573-678-8.
- Brenner, G. A. (2003). Webster’s New World American Idioms Handbook. John Wiley & Sons. ISBN 978-0-7645-2477-6.
- Brescia, F. (2012). Fundamentals of Chemistry: A Modern Introduction. Elsevier. ISBN 978-0-323-14231-1.
- Bretherick, L. (2016). Bretherick’s Handbook of Reactive Chemical Hazards. Elsevier. ISBN 978-1-4831-6250-8.
- Bunker, B. C.; Casey, W. H. (2016). The Aqueous Chemistry of Oxides. Oxford University Press. ISBN 978-0-19-938425-9.
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. (1957). «Synthesis of the Elements in Stars». Reviews of Modern Physics. 29 (4): 547–654. Bibcode:1957RvMP…29..547B. doi:10.1103/RevModPhys.29.547.
- Burleson, M. (2001). The Ceramic Glaze Handbook: Materials, Techniques, Formulas. Sterling. ISBN 9781579904395.
- California Department of Fish and Wildlife. «Nonlead Ammunition in California». www.wildlife.ca.gov. Retrieved 17 May 2017.
- de Callataÿ, F. (2005). «The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks». Journal of Roman Archaeology. 18: 361–72. doi:10.1017/S104775940000742X. S2CID 232346123.
- Cama, T. (2017). «Interior secretary repeals ban on lead bullets». The Hill. Retrieved 30 May 2018.
- Cangelosi, V. M.; Pecoraro, V. L. (2015). «Lead». In Roduner, E. (ed.). Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles. Royal Society of Chemistry. pp. 843–875. ISBN 978-1-78262-494-3.
- Casciani, D. (2014). «Did removing lead from petrol spark a decline in crime?». BBC News. Retrieved 30 January 2017.
- Calvo Rebollar, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. ISBN 978-84-8321-908-9.
- Ceccarelli, P. (2013). Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC). OUP Oxford. ISBN 978-0-19-967559-3.
- Centers for Disease Control and Prevention (1997). «Update: blood lead levels—United States, 1991-1994». Morbidity and Mortality Weekly Report. 46 (7): 141–146. ISSN 0149-2195. PMID 9072671.
- Centers for Disease Control and Prevention (2015). «Radiation and Your Health». Retrieved 28 February 2017.
- Christensen, N. E. (2002). «Relativistic Solid State Theory». In Schwerdtfeger, P. (ed.). Relativistic Electronic Structure Theory — Fundamentals. Theoretical and Computational Chemistry. Vol. 11. Elsevier. pp. 867–68. doi:10.1016/s1380-7323(02)80041-3. ISBN 978-0-08-054046-7.
- Claudio, Elizabeth S.; Godwin, Hilary Arnold; Magyar, John S. (2002). «Fundamental Coordination Chemistry, Environmental Chemistry, and Biochemistry of Lead(II)». Progress in Inorganic Chemistry, Volume 51. John Wiley & Sons, Inc. pp. 1–144. doi:10.1002/0471267287.ch1. ISBN 978-0-471-26534-4.
- Cohen, A. R.; Trotzky, M. S.; Pincus, D. (1981). «Reassessment of the Microcytic Anemia of Lead Poisoning». Pediatrics. 67 (6): 904–906. doi:10.1542/peds.67.6.904. PMID 7232054. S2CID 42146120.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials; Commission on Life Sciences; Division on Earth and Life Studies; National Research Council (1999). Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials. National Academies Press. pp. 26, 30–32. ISBN 978-0-309-58070-0.
- Concordia University (2016). Lead acid batteries (PDF) (Report). Retrieved 17 February 2019.
- Considine, D. M.; Considine, G. D. (2013). Van Nostrand’s Scientific Encyclopedia. Springer Science & Business Media. ISBN 978-1-4757-6918-0.
- Copper Development Association. «Leaded Coppers». copper.org. Retrieved 10 July 2016.
- Cotnoir, B. (2006). The Weiser Concise Guide to Alchemy. Weiser Books. ISBN 978-1-57863-379-1.
- Cox, P. A. (1997). The Elements: Their Origin, Abundance and Distribution. Oxford University Press. ISBN 978-0-19-855298-7.
- Crow, J. M. (2007). «Why use lead in paint?». Chemistry World. Royal Society of Chemistry. Retrieved 22 February 2017.
- Dart, R. C.; Hurlbut, K. M.; Boyer-Hassen, L. V. (2004). «Lead». In Dart, R. C. (ed.). Medical Toxicology (3rd ed.). Lippincott Williams & Wilkins. p. 1426. ISBN 978-0-7817-2845-4.
- Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). «Lead». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a15_193.pub3. ISBN 978-3-527-30673-2.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. (2003). «Experimental detection of α-particles from the radioactive decay of natural bismuth». Nature. 422 (6934): 876–78. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201. S2CID 4415582.
- Delile, H.; Blichert-Toft, J.; Goiran, J.-P.; et al. (2014). «Lead in ancient Rome’s city waters». Proceedings of the National Academy of Sciences. 111 (18): 6594–99. Bibcode:2014PNAS..111.6594D. doi:10.1073/pnas.1400097111. ISSN 0027-8424. PMC 4020092. PMID 24753588.
- Deltares; Netherlands Organisation for Applied Scientific Research (2016). Lood en zinkemissies door jacht [Lead and zinc emissions from hunting] (PDF) (Report) (in Dutch). Retrieved 18 February 2017.
- Dieter, R. K.; Watson, R. T. (2009). «Transmetalation reactions producing organocopper compounds». In Rappoport, Z.; Marek, I. (eds.). The Chemistry of Organocopper Compounds. Vol. 1. John Wiley & Sons. pp. 443–526. ISBN 978-0-470-77296-6.
- Donnelly, J. (2014). Deep Blue. Hachette Children’s Group. ISBN 978-1-4449-2119-9.
- Downs, A. J.; Adams, C. J. (2017). The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry. Elsevier. ISBN 978-1-4831-5832-7.
- Duda, M. B. (1996). Traditional Chinese Toggles: Counterweights and Charms. Editions Didier Millet. ISBN 978-981-4260-61-9.
- Ede, A.; Cormack, L. B. (2016). A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press. ISBN 978-1-4426-3503-6.
- Emsley, J. (2011). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-960563-7.
- «Encyclopedia Judaica: Ossuaries and Sarcophagi». www.jewishvirtuallibrary.org. Retrieved 14 July 2018.
- Eschnauer, H. R.; Stoeppler, M. (1992). «Wine—An enological specimen bank». In Stoeppler, M. (ed.). Hazardous Materials in the Environment. Elsevier Science. pp. 49–72 (58). doi:10.1016/s0167-9244(08)70103-3. ISBN 978-0-444-89078-8.
- Evans, J. W. (1908). «V.— The meanings and synonyms of plumbago». Transactions of the Philological Society. 26 (2): 133–79. doi:10.1111/j.1467-968X.1908.tb00513.x.
- Finger, S. (2006). Doctor Franklin’s Medicine. University of Pennsylvania Press. ISBN 978-0-8122-3913-3.
- Fiorini, E. (2010). «2.000 years-old Roman Lead for physics» (PDF). ASPERA: 7–8. Archived from the original (PDF) on 26 April 2018. Retrieved 29 October 2016.
- Frankenburg, F. R. (2014). Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History. ABC-CLIO. ISBN 978-1-4408-2932-1.
- Frebel, A. (2015). Searching for the Oldest Stars: Ancient Relics from the Early Universe. Princeton University. ISBN 978-0-691-16506-6.
- Freeman, K. S. (2012). «Remediating soil lead with fishbones». Environmental Health Perspectives. 120 (1): a20–a21. doi:10.1289/ehp.120-a20a. PMC 3261960. PMID 22214821.
- Funke, K. (2013). «Solid State Ionics: from Michael Faraday to green energy—the European dimension». Science and Technology of Advanced Materials. 14 (4): 1–50. Bibcode:2013STAdM..14d3502F. doi:10.1088/1468-6996/14/4/043502. PMC 5090311. PMID 27877585.
- Gale, W. F.; Totemeier, T. C. (2003). Smithells Metals Reference Book. Butterworth-Heinemann. ISBN 978-0-08-048096-1.
- Gilfillan, S. C. (1965). «Lead poisoning and the fall of Rome». Journal of Occupational Medicine. 7 (2): 53–60. ISSN 0096-1736. PMID 14261844.
- Gill, T.; Libraries Board of South Australia (1974). The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia. ISBN 9780724300358.
- Graedel, T. E.; et al. (2010). Metal stocks in Society – Scientific Synthesis (PDF) (Report). International Resource Panel. p. 17. ISBN 978-92-807-3082-1. Archived from the original (PDF) on 26 April 2018. Retrieved 18 April 2017.
- Grandjean, P. (1978). «Widening perspectives of lead toxicity». Environmental Research. 17 (2): 303–21. Bibcode:1978ER…..17..303G. doi:10.1016/0013-9351(78)90033-6. PMID 400972.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Grout, J. (2017). «Lead poisoning and Rome». Encyclopaedia Romana. Retrieved 15 February 2017.
- Guberman, D. E. (2016). «Lead» (PDF). 2014 Minerals Yearbook (Report). United States Geological Survey. Retrieved 8 May 2017.
- Gulbinska, M. K. (2014). Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective. Springer. p. 96. ISBN 978-1-4471-6548-4.
- Guruswamy, S. (2000). Engineering properties and applications of lead alloys. Marcel Dekker. ISBN 978-0-8247-8247-4.
- Hadlington, T. J. (2017). On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes. Springer. ISBN 978-3-319-51807-7.
- Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. (2015). Hamilton and Hardy’s Industrial Toxicology. John Wiley & Sons. ISBN 978-0-470-92973-5.
- Hauser, P. C. (2017). «Analytical Methods for the Determination of Lead in the Environment». In Astrid, S.; Helmut, S.; Sigel, R. K. O. (eds.). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. de Gruyter. pp. 49–60. doi:10.1515/9783110434330-003. ISBN 9783110434330. PMID 28731296.
- Hernberg, S. (2000). «Lead Poisoning in a Historical Perspective» (PDF). American Journal of Industrial Medicine. 38 (3): 244–54. doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F. PMID 10940962. Archived from the original (PDF) on 21 September 2017. Retrieved 1 March 2017.
- «A History of Cosmetics from Ancient Times». Cosmetics Info. Archived from the original on 14 July 2016. Retrieved 18 July 2016.
- Hodge, T. A. (1981). «Vitruvius, lead pipes and lead poisoning». American Journal of Archaeology. 85 (4): 486–91. doi:10.2307/504874. JSTOR 504874. S2CID 193094209.
- Hong, S.; Candelone, J.-P.; Patterson, C. C.; et al. (1994). «Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations» (PDF). Science. 265 (5180): 1841–43. Bibcode:1994Sci…265.1841H. doi:10.1126/science.265.5180.1841. PMID 17797222. S2CID 45080402.
- Hunt, A. (2014). Dictionary of Chemistry. Routledge. ISBN 978-1-135-94178-9.
- IAEA — Nuclear Data Section (2017). «Livechart — Table of Nuclides — Nuclear structure and decay data». www-nds.iaea.org. International Atomic Energy Agency. Retrieved 31 March 2017.
- Insight Explorer; IPEN (2016). New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves (PDF) (Report). Retrieved 3 May 2018.
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Scott; Weinberg, Jack; Denney, Valerie (2013). Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (Report) (in Indonesian). BaliFokus & IPEN. Retrieved 26 December 2018.
- Jensen, C. F. (2013). Online Location of Faults on AC Cables in Underground Transmission. Springer. ISBN 978-3-319-05397-4.
- Jones, P. A. (2014). Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions. Constable. ISBN 978-1-47211-389-4.
- Kaupp, M. (2014). «Chemical bonding of main-group elements» (PDF). In Frenking, G.; Shaik, S. (eds.). The Chemical Bond: Chemical Bonding Across the Periodic Table. John Wiley & Sons. pp. 1–24. doi:10.1002/9783527664658.ch1. ISBN 9783527664658. S2CID 17979350.
- Kellett, C. (2012). Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes. Accent Press. ISBN 978-1-909335-05-9.
- King, R. B. (1995). Inorganic Chemistry of Main Group Elements. VCH Publishers. ISBN 978-1-56081-679-9.
- Konu, J.; Chivers, T. (2011). «Stable Radicals of the Heavy p-Block Elements». In Hicks, R. G. (ed.). Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons. doi:10.1002/9780470666975.ch10. ISBN 978-0-470-77083-2.
- Kosnett, M. J. (2006). «Lead». In Olson, K. R. (ed.). Poisoning and Drug Overdose (5th ed.). McGraw-Hill Professional. p. 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M.; Halls, M. (2006). Scuba Diving. Dorling Kindersley. ISBN 978-0-7566-4063-7.
- Kroonen, G. (2013). Etymological Dictionary of Proto-Germanic. Leiden Indo-European Etymological Dictionary Series. Vol. 11. Brill. ISBN 978-90-04-18340-7.
- Langmuir, C. H.; Broecker, W. S. (2012). How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. Princeton University Press. ISBN 978-0-691-14006-3.
- Lauwerys, R. R.; Hoet, P. (2001). Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition. CRC Press. ISBN 978-1-4822-9383-8.
- Layton, M. (2017). «Lead faces threat of new Euro ban». shootinguk.co.uk. Retrieved 30 May 2018.
- «Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI «Catch!»«. The British Museum. Archived from the original on 14 February 2012. Retrieved 30 April 2012.
- «Lead garden ornaments». H. Crowther Ltd. 2016. Retrieved 20 February 2017.
- «Lead in Waste Disposal». United States Environmental Protection Agency. 2016. Retrieved 28 February 2017.
- «Lead mining». The Northern Echo. Retrieved 16 February 2016.
- Levin, H. L. (2009). The Earth Through Time. John Wiley & Sons. ISBN 978-0-470-38774-0.
- Levin, R.; Brown, M. J.; Kashtock, M. E.; et al. (2008). «Lead exposures in U.S. children, 2008: Implications for prevention». Environmental Health Perspectives. 116 (10): 1285–93. doi:10.1289/ehp.11241. PMC 2569084. PMID 18941567.
- Lewis, J. (1985). «Lead Poisoning: A Historical Perspective». EPA Journal. 11 (4): 15–18. Retrieved 31 January 2017.
- Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. ISBN 978-0-8493-0484-2.
- Liu, J.; Liu, X.; Pak, V.; et al. (2015). «Early blood lead levels and sleep disturbance in preadolescence». Sleep. 38 (12): 1869–74. doi:10.5665/sleep.5230. PMC 4667382. PMID 26194570.
- Lochner, J. C.; Rohrbach, G.; Cochrane, K. (2005). «What is Your Cosmic Connection to the Elements?» (PDF). Goddard Space Flight Center. Archived from the original (PDF) on 29 December 2016. Retrieved 2 July 2017.
- Lodders, K. (2003). «Solar System abundances and condensation temperatures of the elements» (PDF). The Astrophysical Journal. 591 (2): 1220–47. Bibcode:2003ApJ…591.1220L. doi:10.1086/375492. ISSN 0004-637X. S2CID 42498829.
- Luckey, T. D.; Venugopal, B. (1979). Physiologic and Chemical Basis for Metal Toxicity. Plenum Press. ISBN 978-1-4684-2952-7.
- Macintyre, J. E. (1992). Dictionary of Inorganic Compounds. CRC Press. ISBN 978-0-412-30120-9.
- Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. (1990). «A case report of lead paint poisoning during renovation of a Victorian farmhouse». American Journal of Public Health. 80 (10): 1183–85. doi:10.2105/AJPH.80.10.1183. PMC 1404824. PMID 2119148.
- Markowitz, G.; Rosner, D. (2000). ««Cater to the children»: the role of the lead industry in a public health tragedy, 1900–55″. American Journal of Public Health. 90 (1): 36–46. doi:10.2105/ajph.90.1.36. PMC 1446124. PMID 10630135.
- Masters, S. B.; Trevor, A. J.; Katzung, B. G. (2008). Katzung & Trevor’s Pharmacology: Examination & Board Review (8th ed.). McGraw-Hill Medical. ISBN 978-0-07-148869-3.
- McCoy, S. (2017). «The End of Lead? Federal Gov’t Order Bans Sinkers, Ammo». GearJunkie. Retrieved 30 May 2018.
- Meija, Juris; et al. (2016). «Atomic weights of the elements 2013 (IUPAC Technical Report)». Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Merriam-Webster. «Definition of LEAD». www.merriam-webster.com. Retrieved 12 August 2016.
- Moore, M. R. (1977). «Lead in drinking water in soft water areas—health hazards». Science of the Total Environment. 7 (2): 109–15. Bibcode:1977ScTEn…7..109M. doi:10.1016/0048-9697(77)90002-X. PMID 841299.
- More, A. F.; Spaulding, N. E.; Bohleber, P.; et al. (2017). «Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death» (PDF). GeoHealth. 1 (4): 211–219. doi:10.1002/2017GH000064. ISSN 2471-1403. PMC 7007106. PMID 32158988.
- Mosseri, S.; Henglein, A.; Janata, E. (1990). «Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species». Journal of Physical Chemistry. 94 (6): 2722–26. doi:10.1021/j100369a089.
- Mycyk, M.; Hryhorczuk, D.; Amitai, Y.; et al. (2005). «Lead». In Erickson, T. B.; Ahrens, W. R.; Aks, S. (eds.). Pediatric Toxicology: Diagnosis and Management of the Poisoned Child. McGraw-Hill Professional. ISBN 978-0-07-141736-5.
- Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. (1998). «Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period». Journal of Occupational Health. 40 (1): 55–60. doi:10.1539/joh.40.55.
- National Council on Radiation Protection and Measurements (2004). Structural Shielding Design for Medical X-ray Imaging Facilities. ISBN 978-0-929600-83-3.
- National Institute for Occupational Safety and Health. «NIOSH Pocket Guide to Chemical Hazards — Lead». www.cdc.gov. Retrieved 18 November 2016.
- Navas-Acien, A. (2007). «Lead Exposure and Cardiovascular Disease—A Systematic Review». Environmental Health Perspectives. 115 (3): 472–482. doi:10.1289/ehp.9785. PMC 1849948. PMID 17431501.
- Nikolayev, S., ed. (2012). «*lAudh-«. Indo-European Etymology. starling.rinet.ru. Retrieved 21 August 2016.
- Norman, N. C. (1996). Periodicity and the s- and p-Block Elements. Oxford University Press. ISBN 978-0-19-855961-0.
- Nriagu, J. O. (1983). «Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?». The New England Journal of Medicine. 308 (11): 660–63. doi:10.1056/NEJM198303173081123. PMID 6338384.
- Nriagu, J. O.; Kim, M-J. (2000). «Emissions of lead and zinc from candles with metal-core wicks». Science of the Total Environment. 250 (1–3): 37–41. Bibcode:2000ScTEn.250…37N. doi:10.1016/S0048-9697(00)00359-4. PMID 10811249.
- Occupational Safety and Health Administration. «Substance data sheet for occupational exposure to lead». www.osha.gov. Archived from the original on 16 March 2018. Retrieved 1 July 2017.
- Olinsky-Paul, T. (2013). «East Penn and Ecoult battery installation case study webinar» (PDF). Clean Energy States Alliance. Retrieved 28 February 2017.
- Palmieri, R., ed. (2006). The Organ. Psychology Press. ISBN 978-0-415-94174-7.
- «surma». Oxford English Dictionary (2nd ed.). Oxford University Press. 2009.
- Park, J. H.; Bolan, N.; Meghara, M.; et al. (2011). «Bacterial-assisted immobilization of lead in soils: Implications for remediation» (PDF). Pedologist: 162–74. Archived from the original (PDF) on 26 November 2015.
- Parker, R. B. (2005). The New Cold-Molded Boatbuilding: From Lofting to Launching. WoodenBoat Books. ISBN 978-0-937822-89-0.
- Parthé, E. (1964). Crystal Chemistry of Tetrahedral Structures. CRC Press. ISBN 978-0-677-00700-7.
- Pauling, L. (1947). General Chemistry. W. H. Freeman and Company. ISBN 978-0-486-65622-9.
- Peneva, S. K.; Djuneva, K. D.; Tsukeva, E. A. (1981). «RHEED study of the initial stages of crystallization and oxidation of lead and tin». Journal of Crystal Growth. 53 (2): 382–396. Bibcode:1981JCrGr..53..382P. doi:10.1016/0022-0248(81)90088-9. ISSN 0022-0248.
- Petzel, S.; Juuti, M.; Sugimoto, Yu. (2004). «Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue». In Puttlitz, K. J.; Stalter, K. A. (eds.). Handbook of Lead-Free Solder Technology for Microelectronic Assemblies. CRC Press. ISBN 978-0-8247-5249-1.
- Polyanskiy, N. G. (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead] (in Russian). Nauka.
- Prasad, P. J. (2010). Conceptual Pharmacology. Universities Press. ISBN 978-81-7371-679-9. Retrieved 21 June 2012.
- «Primary Lead Refining Technical Notes». LDA International. Archived from the original on 22 March 2007. Retrieved 7 April 2007.
- Progressive Dynamics, Inc. «How Lead Acid Batteries Work: Battery Basics». progressivedyn.com. Archived from the original on 19 November 2018. Retrieved 3 July 2016.
- Putnam, B. (2003). The Sculptor’s Way: A Guide to Modelling and Sculpture. Dover Publications. ISBN 978-0-486-42313-5.
- Pyykkö, P. (1988). «Relativistic effects in structural chemistry». Chemical Reviews. 88 (3): 563–94. doi:10.1021/cr00085a006.
- Rabinowitz, M. B. (1995). «Imputing lead sources from blood lead isotope ratios». In Beard, M. E.; Allen Iske, S. D. (eds.). Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance. ASTM. pp. 63–75. doi:10.1520/stp12967s. ISBN 978-0-8031-1884-3.
- «Radioactive Decay Series» (PDF). Nuclear Systematics. MIT OpenCourseWare. 2012. Retrieved 28 April 2018.
- Ramage, C. K., ed. (1980). Lyman Cast Bullet Handbook (3rd ed.). Lyman Products Corporation.
- Randerson, J. (2002). «Candle pollution». New Scientist (2348). Retrieved 7 April 2007.
- Reddy, A.; Braun, C. L. (2010). «Lead and the Romans». Journal of Chemical Education. 87 (10): 1052–55. Bibcode:2010JChEd..87.1052R. doi:10.1021/ed100631y.
- Retief, F.; Cilliers, L. P. (2006). «Lead poisoning in ancient Rome». Acta Theologica. 26 (2): 147–64 (149–51). doi:10.4314/actat.v26i2.52570.
- Rich, V. (1994). The International Lead Trade. Woodhead Publishing. ISBN 978-0-85709-994-5.
- Rieuwerts, J. (2015). The Elements of Environmental Pollution. Routledge. ISBN 978-0-415-85919-6.
- Riva, M. A.; Lafranconi, A.; d’Orso, M. I.; et al. (2012). «Lead poisoning: Historical aspects of a paradigmatic «occupational and environmental disease»«. Safety and Health at Work. 3 (1): 11–16. doi:10.5491/SHAW.2012.3.1.11. PMC 3430923. PMID 22953225.
- Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. (2009). «The end of nucleosynthesis: Production of lead and thorium in the early galaxy». The Astrophysical Journal. 698 (2): 1963–80. arXiv:0904.3105. Bibcode:2009ApJ…698.1963R. doi:10.1088/0004-637X/698/2/1963. S2CID 14814446.
- Rogalski, A. (2010). Infrared Detectors (2nd ed.). CRC Press. ISBN 978-1-4200-7671-4. Retrieved 19 November 2016.
- Röhr, C. (2017). «Binare Zintl-Phasen» [Binary Zintl Phases]. Intermetallische Phasen [Intermettallic Phases] (in German). Universitat Freiburg. Retrieved 18 February 2017.
- Rudolph, A. M.; Rudolph, C. D.; Hostetter, M. K.; et al. (2003). «Lead». Rudolph’s Pediatrics (21st ed.). McGraw-Hill Professional. p. 369. ISBN 978-0-8385-8285-5.
- Samson, G. W. (1885). The divine law as to wines. J. B. Lippincott & Co.
- Scarborough, J. (1984). «The myth of lead poisoning among the Romans: An essay review». Journal of the History of Medicine and Allied Sciences. 39 (4): 469–475. doi:10.1093/jhmas/39.4.469. PMID 6389691.
- Schoch, R. M. (1996). Case Studies in Environmental Science. West Publishing. ISBN 978-0-314-20397-7.
- Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. (2008). «Endocrine disruptors and abnormalities of pubertal development» (PDF). Basic & Clinical Pharmacology & Toxicology. 102 (2): 168–175. doi:10.1111/j.1742-7843.2007.00180.x. hdl:1854/LU-391408. PMID 18226071.
- Sharma, H. R.; Nozawa, K.; Smerdon, J. A.; et al. (2013). «Templated three-dimensional growth of quasicrystalline lead». Nature Communications. 4: 2715. Bibcode:2013NatCo…4.2715S. doi:10.1038/ncomms3715. PMID 24185350.
- Sharma, H. R.; Smerdon, J. A.; Nugent, P. J.; et al. (2014). «Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb». The Journal of Chemical Physics. 140 (17): 174710. Bibcode:2014JChPh.140q4710S. doi:10.1063/1.4873596. PMID 24811658.
- Silverman, M. S. (1966). «High-pressure (70-k) synthesis of new crystalline lead dichalcogenides». Inorganic Chemistry. 5 (11): 2067–69. doi:10.1021/ic50045a056.
- Singh, P. (2017). «Over 73% of paints found to have excessive lead: Study». Times of India. Retrieved 3 May 2018.
- Sinha, S. P.; Shelly; Sharma, V.; et al. (1993). «Neurotoxic effects of lead exposure among printing press workers». Bulletin of Environmental Contamination and Toxicology. 51 (4): 490–93. doi:10.1007/BF00192162. PMID 8400649. S2CID 26631583.
- Slater, J. C. (1964). «Atomic Radii in Crystals». The Journal of Chemical Physics. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697. ISSN 0021-9606.
- Smirnov, A. Yu.; Borisevich, V. D.; Sulaberidze, A. (2012). «Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials». Theoretical Foundations of Chemical Engineering. 46 (4): 373–78. doi:10.1134/s0040579512040161. S2CID 98821122.
- Sokol, R. C. (2005). «Lead exposure and its effects on the reproductive system». In Golub, M. S. (ed.). Metals, Fertility, and Reproductive Toxicity. CRC Press. pp. 117–53. doi:10.1201/9781420023282.ch6. ISBN 978-0-415-70040-5.
- Stabenow, F.; Saak, W.; Weidenbruch, M. (2003). «Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds». Chemical Communications (18): 2342–2343. doi:10.1039/B305217F. PMID 14518905.
- Stone, R. (1997). «An Element of Stability». Science. 278 (5338): 571–572. Bibcode:1997Sci…278..571S. doi:10.1126/science.278.5338.571. S2CID 117946028.
- Street, A.; Alexander, W. (1998). Metals in the Service of Man (11th ed.). Penguin Books. ISBN 978-0-14-025776-2.
- Szczepanowska, H. M. (2013). Conservation of Cultural Heritage: Key Principles and Approaches. Routledge. ISBN 978-0-415-67474-4.
- Takahashi, K.; Boyd, R. N.; Mathews, G. J.; et al. (1987). «Bound-state beta decay of highly ionized atoms» (PDF). Physical Review C. 36 (4): 1522–1528. Bibcode:1987PhRvC..36.1522T. doi:10.1103/physrevc.36.1522. OCLC 1639677. PMID 9954244. Archived from the original (PDF) on 21 October 2014. Retrieved 27 August 2013.
- Tarragó, A. (2012). «Case Studies in Environmental Medicine (CSEM) Lead Toxicity» (PDF). Agency for Toxic Substances and Disease Registry.
- Tétreault, J.; Sirois, J.; Stamatopoulou, E. (1998). «Studies of lead corrosion in acetic acid environments». Studies in Conservation. 43 (1): 17–32. doi:10.2307/1506633. JSTOR 1506633.
- «Think Lead research summary» (PDF). The Lead Sheet Association. Archived from the original (PDF) on 20 February 2017. Retrieved 20 February 2017.
- Thomson, T. (1830). The History of Chemistry. Henry Colburn and Richard Bentley (publishers). ISBN 9780405066238.
- Thornton, I.; Rautiu, R.; Brush, S. M. (2001). Lead: The Facts (PDF). International Lead Association. ISBN 978-0-9542496-0-1. Retrieved 5 February 2017.
- Thürmer, K.; Williams, E.; Reutt-Robey, J. (2002). «Autocatalytic oxidation of lead crystallite surfaces». Science. 297 (5589): 2033–35. Bibcode:2002Sci…297.2033T. doi:10.1126/science.297.5589.2033. PMID 12242437. S2CID 6166273.
- Tolliday, B. (2014). «Significant growth in lead usage underlines its importance to the global economy». International Lead Association. Archived from the original on 28 February 2017. Retrieved 28 February 2017.
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead-acid batteries
- «Toronto museum explores history of contraceptives». ABC News. 2003. Retrieved 13 February 2016.
- «Toxic Substances Portal – Lead». Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011.
- «Toxicological Profile for Lead» (PDF). Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine. 2007. Archived from the original (PDF) on 1 July 2017.
- «Trace element emission from coal». IEA Clean Coal Centre. 2012. Retrieved 1 March 2017.
- Tuček, K.; Carlsson, J.; Wider, H. (2006). «Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues» (PDF). Nuclear Engineering and Design. 236 (14–16): 1589–98. doi:10.1016/j.nucengdes.2006.04.019.
- Tungate, M. (2011). Branded Beauty: How Marketing Changed the Way We Look. Kogan Page Publishers. ISBN 978-0-7494-6182-9.
- UK Marine SACs Project (1999). «Lead». Water Quality (Report). Retrieved 10 June 2018.
- United Nations Environment Programme (2010). Final review of scientific information on lead (PDF). Chemicals Branch, Division of Technology, Industry and Economics. Retrieved 31 January 2017.
- United States Environmental Protection Agency (2010). «Metallurgical Industry:Secondary Lead Processing». AP 42 Compilation of Air Pollutant Emission Factors (5th ed.). Retrieved 20 May 2018.
- United States Environmental Protection Agency (2000). «Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000)». Retrieved 28 February 2017.
- United States Environmental Protection Agency (2005). «Best Management Practices for Lead at Outdoor Shooting Ranges» (PDF). Retrieved 12 June 2018.
- United States Food and Drug Administration (2015). Q3D Elemental Impurities Guidance for Industry (PDF) (Report). United States Department of Health and Human Services. p. 41. Retrieved 15 February 2017.
- United States Geological Survey (1973). Geological Survey Professional Paper. United States Government Publishing Office. p. 314.
- United States Geological Survey (2005). Lead (PDF) (Report). Retrieved 20 February 2016.
- United States Geological Survey (2017). «Lead» (PDF). Mineral Commodities Summaries. Retrieved 8 May 2017.
- University of California Nuclear Forensic Search Project. «Decay Chains». Nuclear Forensics: A Scientific Search Problem. Retrieved 23 November 2015.
- Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, O. N.; Larin, B. O. (eds.). Этимологический словарь русского языка [Russisches etymologisches Worterbuch] (in Russian) (2nd ed.). Progress. Retrieved 4 March 2017.
- Vogel, N. A.; Achilles, R. (2013). The Preservation and Repair of Historic Stained and Leaded Glass (PDF) (Report). United States Department of the Interior. Retrieved 30 October 2016.
- Waldron, H. A. (1985). «Lead and lead poisoning in antiquity». Medical History. 29 (1): 107–08. doi:10.1017/S0025727300043878. PMC 1139494.
- Wani, A. L.; Ara, A.; Usman, J. A. (2015). «Lead toxicity: A review». Interdisciplinary Toxicology. 8 (2): 55–64. doi:10.1515/intox-2015-0009. PMC 4961898. PMID 27486361.
- Weast, R. C.; Astle, M. J.; Beyer, W. H. (1983). CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data. CRC Press. ISBN 978-0-8493-0464-4.
- «Weatherings to Parapets and Cornices». The Lead Sheet Association. Archived from the original on 20 February 2017. Retrieved 20 February 2017.
- Webb, G. A. (2000). Nuclear Magnetic Resonance. Royal Society of Chemistry. ISBN 978-0-85404-327-9.
- Webb, G. W.; Marsiglio, F.; Hirsch, J. E. (2015). «Superconductivity in the elements, alloys and simple compounds». Physica C: Superconductivity and Its Applications. 514: 17–27. arXiv:1502.04724. Bibcode:2015PhyC..514…17W. doi:10.1016/j.physc.2015.02.037. S2CID 119290828.
- Whitten, K. W.; Gailey, K. D.; David, R. E. (1996). General chemistry with qualitative analysis (3rd ed.). Saunders College. ISBN 978-0-03-012864-6.
- Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- Wilkes, C. E.; Summers, J. W.; Daniels, C. A.; et al. (2005). PVC Handbook. Hanser. ISBN 978-1-56990-379-7.
- Willey, D. G. (1999). «The physics behind four amazing demonstrations — CSI». Skeptical Inquirer. 23 (6). Retrieved 6 September 2016.
- Winder, C. (1993a). «The history of lead — Part 1». LEAD Action News. 2 (1). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 5 February 2016.
- Winder, C. (1993b). «The history of lead — Part 3». LEAD Action News. 2 (3). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 12 February 2016.
- Windholz, M. (1976). Merck Index of Chemicals and Drugs (9th ed.). Merck & Co. ISBN 978-0-911910-26-1. Monograph 8393.
- Wood, J. R.; Hsu, Y-T.; Bell, C. (2021). «Sending Laurion Back to the Future: Bronze Age Silver and the Source of Confusion» (PDF). Internet Archaeology. 56 (9). doi:10.11141/ia.56.9. S2CID 236973111.
- World Health Organization (1995). Environmental Health Criteria 165: Inorganic Lead (Report). Retrieved 10 June 2018.
- World Health Organization (2000). «Lead» (PDF). Air quality guidelines for Europe. Regional Office for Europe. pp. 149–53. ISBN 978-92-890-1358-1. OCLC 475274390.
- World Health Organization (2018). «Lead poisoning and health». Retrieved 17 February 2019.
- World Nuclear Association (2015). «Nuclear Radiation and Health Effects». Retrieved 12 November 2015.
- Wrackmeyer, B.; Horchler, K. (1990). 207Pb-NMR Parameters. Annual Reports on NMR Spectroscopy. Vol. 22. Academic Press. pp. 249–303. doi:10.1016/S0066-4103(08)60257-4. ISBN 978-0-08-058405-8.
- Yong, L.; Hoffmann, S. D.; Fässler, T. F. (2006). «A low-dimensional arrangement of [Pb9]4· clusters in [K(18-crown-6)]2K2Pb9·(en)1.5«. Inorganica Chimica Acta. 359 (15): 4774–78. doi:10.1016/j.ica.2006.04.017.
- Young, S. (2012). «Battling lead contamination, one fish bone at a time». Compass. United States Coast Guard. Archived from the original on 14 June 2013. Retrieved 11 February 2017.
- Yu, L.; Yu, H. (2004). Chinese Coins: Money in History and Society. Long River Press. ISBN 978-1-59265-017-0.
- Zhang, X.; Yang, L.; Li, Y.; et al. (2012). «Impacts of lead/zinc mining and smelting on the environment and human health in China». Environmental Monitoring and Assessment. 184 (4): 2261–73. doi:10.1007/s10661-011-2115-6. PMID 21573711. S2CID 20372810.
- Zhao, F. (2008). Information Technology Entrepreneurship and Innovation. IGI Global. p. 440. ISBN 978-1-59904-902-1.
- Zuckerman, J. J.; Hagen, A. P. (1989). Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. ISBN 978-0-471-18656-4.
- Zweifel, H. (2009). Plastics Additives Handbook. Hanser. ISBN 978-3-446-40801-2.
- Zýka, J. (1966). «Analytical study of the basic properties of lead tetraacetate as oxidizing agent». Pure and Applied Chemistry. 13 (4): 569–81. doi:10.1351/pac196613040569. S2CID 96821219. Retrieved 2 March 2017.
Further reading[edit]
- Astrid, S.; Helmut, S.; Sigel, R. K. O., eds. (2017). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. De Gruyter. ISBN 978-3-11-044107-9. Table of contents
- Casas, J. S.; Sordo, J., eds. (2006). Lead Chemistry, Analytical Aspects. Environmental Impacts and Health Effects. Elsevier. ISBN 978-0-444-52945-9.
External links[edit]
Look up lead in Wiktionary, the free dictionary.
Wikimedia Commons has media related to Lead.
- The Toxicology of Heavy Metals: Getting the Lead Out, American Society for Clinical Pathology
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lead | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (led) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | metallic gray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Pb) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lead in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 14 (carbon group) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s2 6p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 600.61 K (327.46 °C, 621.43 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2022 K (1749 °C, 3180 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 11.34 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 10.66 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 4.77 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 179.5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.650 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −2, −1, 0,[3] +1, +2, +3, +4 (an amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.33 (in +4), 1.87 (in +2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 146±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of lead |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
a=495.08 pm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 1190 m/s (at r.t.) (annealed) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 28.9 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 35.3 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 208 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −23.0×10−6 cm3/mol (at 298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 5.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 46 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 38–50 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-92-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Middle East (7000 BCE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Pb»: from Latin plumbum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of lead
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopic abundances vary greatly by sample[2] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Lead is a chemical element with the symbol Pb (from the Latin plumbum) and atomic number 82. It is a heavy metal that is denser than most common materials. Lead is soft and malleable, and also has a relatively low melting point. When freshly cut, lead is a shiny gray with a hint of blue. It tarnishes to a dull gray color when exposed to air. Lead has the highest atomic number of any stable element and three of its isotopes are endpoints of major nuclear decay chains of heavier elements. Lead is toxic, even in small amounts, especially to children.
Lead is a relatively unreactive post-transition metal. Its weak metallic character is illustrated by its amphoteric nature; lead and lead oxides react with acids and bases, and it tends to form covalent bonds. Compounds of lead are usually found in the +2 oxidation state rather than the +4 state common with lighter members of the carbon group. Exceptions are mostly limited to organolead compounds. Like the lighter members of the group, lead tends to bond with itself; it can form chains and polyhedral structures.
Since lead is easily extracted from its ores, prehistoric people in the Near East were aware of it. Galena is a principal ore of lead which often bears silver. Interest in silver helped initiate widespread extraction and use of lead in ancient Rome. Lead production declined after the fall of Rome and did not reach comparable levels until the Industrial Revolution. Lead played
a crucial role in the development of the printing press, as movable type could be relatively easily cast from lead alloys.[5] In 2014, the annual global production of lead was about ten million tonnes, over half of which was from recycling. Lead’s high density, low melting point, ductility and relative inertness to oxidation make it useful. These properties, combined with its relative abundance and low cost, resulted in its extensive use in construction, plumbing, batteries, bullets and shot, weights, solders, pewters, fusible alloys, white paints, leaded gasoline, and radiation shielding.
Lead’s toxicity became widely recognized in the late 19th century, although a number of well-educated ancient Greek and Roman writers were aware of this fact and even knew some of the symptoms of lead poisoning. Lead is a neurotoxin that accumulates in soft tissues and bones; it damages the nervous system and interferes with the function of biological enzymes, causing neurological disorders ranging from behavioral problems to brain damage, and also affects general health, cardiovascular, and renal systems.
Physical properties[edit]
Atomic[edit]
A lead atom has 82 electrons, arranged in an electron configuration of [Xe]4f145d106s26p2. The sum of lead’s first and second ionization energies—the total energy required to remove the two 6p electrons—is close to that of tin, lead’s upper neighbor in the carbon group. This is unusual; ionization energies generally fall going down a group, as an element’s outer electrons become more distant from the nucleus, and more shielded by smaller orbitals.
The sum of the first four ionization energies of lead exceeds that of tin,[6] contrary to what periodic trends would predict. This is explained by relativistic effects, which become significant in heavier atoms,[7] which contract s and p orbitals such that lead’s 6s electrons have larger binding energies than its 5s electrons.[8] A consequence is the so-called inert pair effect: the 6s electrons of lead become reluctant to participate in bonding, stabilising the +2 oxidation state and making the distance between nearest atoms in crystalline lead unusually long.[9]
Lead’s lighter carbon group congeners form stable or metastable allotropes with the tetrahedrally coordinated and covalently bonded diamond cubic structure. The energy levels of their outer s- and p-orbitals are close enough to allow mixing into four hybrid sp3 orbitals. In lead, the inert pair effect increases the separation between its s- and p-orbitals, and the gap cannot be overcome by the energy that would be released by extra bonds following hybridization.[10] Rather than having a diamond cubic structure, lead forms metallic bonds in which only the p-electrons are delocalized and shared between the Pb2+ ions. Lead consequently has a face-centered cubic structure[11] like the similarly sized[12] divalent metals calcium and strontium.[13][a][b][c]
Bulk[edit]
Pure lead has a bright, shiny gray appearance with a hint of blue.[18] It tarnishes on contact with moist air and takes on a dull appearance, the hue of which depends on the prevailing conditions. Characteristic properties of lead include high density, malleability, ductility, and high resistance to corrosion due to passivation.[19]
A sample of lead solidified from the molten state
Lead’s close-packed face-centered cubic structure and high atomic weight result in a density[20] of 11.34 g/cm3, which is greater than that of common metals such as iron (7.87 g/cm3), copper (8.93 g/cm3), and zinc (7.14 g/cm3).[21] This density is the origin of the idiom to go over like a lead balloon.[22][23][d] Some rarer metals are denser: tungsten and gold are both at 19.3 g/cm3, and osmium—the densest metal known—has a density of 22.59 g/cm3, almost twice that of lead.[24]
Lead is a very soft metal with a Mohs hardness of 1.5; it can be scratched with a fingernail.[25] It is quite malleable and somewhat ductile.[26][e] The bulk modulus of lead—a measure of its ease of compressibility—is 45.8 GPa. In comparison, that of aluminium is 75.2 GPa; copper 137.8 GPa; and mild steel 160–169 GPa.[27] Lead’s tensile strength, at 12–17 MPa, is low (that of aluminium is 6 times higher, copper 10 times, and mild steel 15 times higher); it can be strengthened by adding small amounts of copper or antimony.[28]
The melting point of lead—at 327.5 °C (621.5 °F)[29]—is very low compared to most metals.[20][f] Its boiling point of 1749 °C (3180 °F)[29] is the lowest among the carbon group elements. The electrical resistivity of lead at 20 °C is 192 nanoohm-meters, almost an order of magnitude higher than those of other industrial metals (copper at 15.43 nΩ·m; gold 20.51 nΩ·m; and aluminium at 24.15 nΩ·m).[31] Lead is a superconductor at temperatures lower than 7.19 K;[32] this is the highest critical temperature of all type-I superconductors and the third highest of the elemental superconductors.[33]
Isotopes[edit]
Natural lead consists of four stable isotopes with mass numbers of 204, 206, 207, and 208,[34] and traces of five short-lived radioisotopes.[35] The high number of isotopes is consistent with lead’s atomic number being even.[g] Lead has a magic number of protons (82), for which the nuclear shell model accurately predicts an especially stable nucleus.[36] Lead-208 has 126 neutrons, another magic number, which may explain why lead-208 is extraordinarily stable.[36]
With its high atomic number, lead is the heaviest element whose natural isotopes are regarded as stable; lead-208 is the heaviest stable nucleus. (This distinction formerly fell to bismuth, with an atomic number of 83, until its only primordial isotope, bismuth-209, was found in 2003 to decay very slowly.)[h] The four stable isotopes of lead could theoretically undergo alpha decay to isotopes of mercury with a release of energy, but this has not been observed for any of them; their predicted half-lives range from 1035 to 10189 years[39] (at least 1025 times the current age of the universe).
Three of the stable isotopes are found in three of the four major decay chains: lead-206, lead-207, and lead-208 are the final decay products of uranium-238, uranium-235, and thorium-232, respectively.[40] These decay chains are called the uranium chain, the actinium chain, and the thorium chain.[41] Their isotopic concentrations in a natural rock sample depends greatly on the presence of these three parent uranium and thorium isotopes. For example, the relative abundance of lead-208 can range from 52% in normal samples to 90% in thorium ores;[42] for this reason, the standard atomic weight of lead is given to only one decimal place.[43] As time passes, the ratio of lead-206 and lead-207 to lead-204 increases, since the former two are supplemented by radioactive decay of heavier elements while the latter is not; this allows for lead–lead dating. As uranium decays into lead, their relative amounts change; this is the basis for uranium–lead dating.[44] Lead-207 exhibits nuclear magnetic resonance, a property that has been used to study its compounds in solution and solid state,[45][46] including in the human body.[47]
Apart from the stable isotopes, which make up almost all lead that exists naturally, there are trace quantities of a few radioactive isotopes. One of them is lead-210; although it has a half-life of only 22.2 years,[34] small quantities occur in nature because lead-210 is produced by a long decay series that starts with uranium-238 (that has been present for billions of years on Earth). Lead-211, −212, and −214 are present in the decay chains of uranium-235, thorium-232, and uranium-238, respectively, so traces of all three of these lead isotopes are found naturally. Minute traces of lead-209 arise from the very rare cluster decay of radium-223, one of the daughter products of natural uranium-235, and the decay chain of neptunium-237, traces of which are produced by neutron capture in uranium ores. Lead-210 is particularly useful for helping to identify the ages of samples by measuring its ratio to lead-206 (both isotopes are present in a single decay chain).[48]
In total, 43 lead isotopes have been synthesized, with mass numbers 178–220.[34] Lead-205 is the most stable radioisotope, with a half-life of around 1.73×107 years.[i] The second-most stable is lead-202, which has a half-life of about 52,500 years, longer than any of the natural trace radioisotopes.[34]
Chemistry[edit]
Bulk lead exposed to moist air forms a protective layer of varying composition. Lead(II) carbonate is a common constituent;[50][51][52] the sulfate or chloride may also be present in urban or maritime settings.[53] This layer makes bulk lead effectively chemically inert in the air.[53] Finely powdered lead, as with many metals, is pyrophoric,[54] and burns with a bluish-white flame.[55]
Fluorine reacts with lead at room temperature, forming lead(II) fluoride. The reaction with chlorine is similar but requires heating, as the resulting chloride layer diminishes the reactivity of the elements.[53] Molten lead reacts with the chalcogens to give lead(II) chalcogenides.[56]
Lead metal resists sulfuric and phosphoric acid but not hydrochloric or nitric acid; the outcome depends on insolubility and subsequent passivation of the product salt.[57] Organic acids, such as acetic acid, dissolve lead in the presence of oxygen.[53] Concentrated alkalis will dissolve lead and form plumbites.[58]
Inorganic compounds[edit]
Lead shows two main oxidation states: +4 and +2. The tetravalent state is common for the carbon group. The divalent state is rare for carbon and silicon, minor for germanium, important (but not prevailing) for tin, and is the more important of the two oxidation states for lead.[53] This is attributable to relativistic effects, specifically the inert pair effect, which manifests itself when there is a large difference in electronegativity between lead and oxide, halide, or nitride anions, leading to a significant partial positive charge on lead. The result is a stronger contraction of the lead 6s orbital than is the case for the 6p orbital, making it rather inert in ionic compounds. The inert pair effect is less applicable to compounds in which lead forms covalent bonds with elements of similar electronegativity, such as carbon in organolead compounds. In these, the 6s and 6p orbitals remain similarly sized and sp3 hybridization is still energetically favorable. Lead, like carbon, is predominantly tetravalent in such compounds.[59]
There is a relatively large difference in the electronegativity of lead(II) at 1.87 and lead(IV) at 2.33. This difference marks the reversal in the trend of increasing stability of the +4 oxidation state going down the carbon group; tin, by comparison, has values of 1.80 in the +2 oxidation state and 1.96 in the +4 state.[60]
Lead(II)[edit]
Lead(II) compounds are characteristic of the inorganic chemistry of lead. Even strong oxidizing agents like fluorine and chlorine react with lead to give only PbF2 and PbCl2.[53] Lead(II) ions are usually colorless in solution,[61] and partially hydrolyze to form Pb(OH)+ and finally [Pb4(OH)4]4+ (in which the hydroxyl ions act as bridging ligands),[62][63] but are not reducing agents as tin(II) ions are. Techniques for identifying the presence of the Pb2+ ion in water generally rely on the precipitation of lead(II) chloride using dilute hydrochloric acid. As the chloride salt is sparingly soluble in water, in very dilute solutions the precipitation of lead(II) sulfide is instead achieved by bubbling hydrogen sulfide through the solution.[64]
Lead monoxide exists in two polymorphs, litharge α-PbO (red) and massicot β-PbO (yellow), the latter being stable only above around 488 °C. Litharge is the most commonly used inorganic compound of lead.[65] There is no lead(II) hydroxide; increasing the pH of solutions of lead(II) salts leads to hydrolysis and condensation.[66]
Lead commonly reacts with heavier chalcogens. Lead sulfide is a semiconductor, a photoconductor, and an extremely sensitive infrared radiation detector. The other two chalcogenides, lead selenide and lead telluride, are likewise photoconducting. They are unusual in that their color becomes lighter going down the group.[67]
Lead dihalides are well-characterized; this includes the diastatide[68] and mixed halides, such as PbFCl. The relative insolubility of the latter forms a useful basis for the gravimetric determination of fluorine. The difluoride was the first solid ionically conducting compound to be discovered (in 1834, by Michael Faraday).[69] The other dihalides decompose on exposure to ultraviolet or visible light, especially the diiodide.[70] Many lead(II) pseudohalides are known, such as the cyanide, cyanate, and thiocyanate.[67][71] Lead(II) forms an extensive variety of halide coordination complexes, such as [PbCl4]2−, [PbCl6]4−, and the [Pb2Cl9]n5n− chain anion.[70]
Lead(II) sulfate is insoluble in water, like the sulfates of other heavy divalent cations. Lead(II) nitrate and lead(II) acetate are very soluble, and this is exploited in the synthesis of other lead compounds.[72]
Lead(IV)[edit]
Few inorganic lead(IV) compounds are known. They are only formed in highly oxidizing solutions and do not normally exist under standard conditions.[73] Lead(II) oxide gives a mixed oxide on further oxidation, Pb3O4. It is described as lead(II,IV) oxide, or structurally 2PbO·PbO2, and is the best-known mixed valence lead compound. Lead dioxide is a strong oxidizing agent, capable of oxidizing hydrochloric acid to chlorine gas.[74] This is because the expected PbCl4 that would be produced is unstable and spontaneously decomposes to PbCl2 and Cl2.[75] Analogously to lead monoxide, lead dioxide is capable of forming plumbate anions. Lead disulfide[76] and lead diselenide[77] are only stable at high pressures. Lead tetrafluoride, a yellow crystalline powder, is stable, but less so than the difluoride. Lead tetrachloride (a yellow oil) decomposes at room temperature, lead tetrabromide is less stable still, and the existence of lead tetraiodide is questionable.[78]
Other oxidation states[edit]
Some lead compounds exist in formal oxidation states other than +4 or +2. Lead(III) may be obtained, as an intermediate between lead(II) and lead(IV), in larger organolead complexes; this oxidation state is not stable, as both the lead(III) ion and the larger complexes containing it are radicals.[80][81][82] The same applies for lead(I), which can be found in such radical species.[83]
Numerous mixed lead(II,IV) oxides are known. When PbO2 is heated in air, it becomes Pb12O19 at 293 °C, Pb12O17 at 351 °C, Pb3O4 at 374 °C, and finally PbO at 605 °C. A further sesquioxide, Pb2O3, can be obtained at high pressure, along with several non-stoichiometric phases. Many of them show defective fluorite structures in which some oxygen atoms are replaced by vacancies: PbO can be considered as having such a structure, with every alternate layer of oxygen atoms absent.[84]
Negative oxidation states can occur as Zintl phases, as either free lead anions, as in Ba2Pb, with lead formally being lead(−IV),[85] or in oxygen-sensitive ring-shaped or polyhedral cluster ions such as the trigonal bipyramidal Pb52− ion, where two lead atoms are lead(−I) and three are lead(0).[86] In such anions, each atom is at a polyhedral vertex and contributes two electrons to each covalent bond along an edge from their sp3 hybrid orbitals, the other two being an external lone pair.[62] They may be made in liquid ammonia via the reduction of lead by sodium.[87]
Organolead[edit]
Lead can form multiply-bonded chains, a property it shares with its lighter homologs in the carbon group. Its capacity to do so is much less because the Pb–Pb bond energy is over three and a half times lower than that of the C–C bond.[56] With itself, lead can build metal–metal bonds of an order up to three.[88] With carbon, lead forms organolead compounds similar to, but generally less stable than, typical organic compounds[89] (due to the Pb–C bond being rather weak).[62] This makes the organometallic chemistry of lead far less wide-ranging than that of tin.[90] Lead predominantly forms organolead(IV) compounds, even when starting with inorganic lead(II) reactants; very few organolead(II) compounds are known. The most well-characterized exceptions are Pb[CH(SiMe3)2]2 and Pb(η5-C5H5)2.[90]
The lead analog of the simplest organic compound, methane, is plumbane. Plumbane may be obtained in a reaction between metallic lead and atomic hydrogen.[91] Two simple derivatives, tetramethyllead and tetraethyllead, are the best-known organolead compounds. These compounds are relatively stable: tetraethyllead only starts to decompose if heated[92] or if exposed to sunlight or ultraviolet light.[93][j] With sodium metal, lead readily forms an equimolar alloy that reacts with alkyl halides to form organometallic compounds such as tetraethyllead.[94] The oxidizing nature of many organolead compounds is usefully exploited: lead tetraacetate is an important laboratory reagent for oxidation in organic synthesis.[95] Tetraethyllead, once added to gasoline, was produced in larger quantities than any other organometallic compound.[90] Other organolead compounds are less chemically stable.[89] For many organic compounds, a lead analog does not exist.[91]
Origin and occurrence[edit]
| Atomic number |
Element | Relative amount |
|---|---|---|
| 42 | Molybdenum | 0.798 |
| 46 | Palladium | 0.440 |
| 50 | Tin | 1.146 |
| 78 | Platinum | 0.417 |
| 80 | Mercury | 0.127 |
| 82 | Lead | 1 |
| 90 | Thorium | 0.011 |
| 92 | Uranium | 0.003 |
In space[edit]
Lead’s per-particle abundance in the Solar System is 0.121 ppb (parts per billion).[96][k] This figure is two and a half times higher than that of platinum, eight times more than mercury, and seventeen times more than gold.[96] The amount of lead in the universe is slowly increasing[97] as most heavier atoms (all of which are unstable) gradually decay to lead.[98] The abundance of lead in the Solar System since its formation 4.5 billion years ago has increased by about 0.75%.[99] The solar system abundances table shows that lead, despite its relatively high atomic number, is more prevalent than most other elements with atomic numbers greater than 40.[96]
Primordial lead—which comprises the isotopes lead-204, lead-206, lead-207, and lead-208—was mostly created as a result of repetitive neutron capture processes occurring in stars. The two main modes of capture are the s- and r-processes.[100]
In the s-process (s is for «slow»), captures are separated by years or decades, allowing less stable nuclei to undergo beta decay.[101] A stable thallium-203 nucleus can capture a neutron and become thallium-204; this undergoes beta decay to give stable lead-204; on capturing another neutron, it becomes lead-205, which has a half-life of around 15 million years. Further captures result in lead-206, lead-207, and lead-208. On capturing another neutron, lead-208 becomes lead-209, which quickly decays into bismuth-209. Bismuth-209 is also radioactive and eventually decays into thallium-205 if left unperturbed. On capturing another neutron, bismuth-209 becomes bismuth-210, and this beta decays to polonium-210, which alpha decays to lead-206. The cycle hence ends at lead-206, lead-207, lead-208, and thallium-205.[102]
In the r-process (r is for «rapid»), captures happen faster than nuclei can decay.[103] This occurs in environments with a high neutron density, such as a supernova or the merger of two neutron stars. The neutron flux involved may be on the order of 1022 neutrons per square centimeter per second.[104] The r-process does not form as much lead as the s-process.[105] It tends to stop once neutron-rich nuclei reach 126 neutrons.[106] At this point, the neutrons are arranged in complete shells in the atomic nucleus, and it becomes harder to energetically accommodate more of them.[107] When the neutron flux subsides, these nuclei beta decay into stable isotopes of osmium, iridium, and platinum.[108]
On Earth[edit]
Lead is classified as a chalcophile under the Goldschmidt classification, meaning it is generally found combined with sulfur.[109] It rarely occurs in its native, metallic form.[110] Many lead minerals are relatively light and, over the course of the Earth’s history, have remained in the crust instead of sinking deeper into the Earth’s interior. This accounts for lead’s relatively high crustal abundance of 14 ppm; it is the 38th most abundant element in the crust.[111][l]
The main lead-bearing mineral is galena (PbS), which is mostly found with zinc ores.[113] Most other lead minerals are related to galena in some way; boulangerite, Pb5Sb4S11, is a mixed sulfide derived from galena; anglesite, PbSO4, is a product of galena oxidation; and cerussite or white lead ore, PbCO3, is a decomposition product of galena. Arsenic, tin, antimony, silver, gold, copper, and bismuth are common impurities in lead minerals.[113]
Lead is a fairly common element in the Earth’s crust for its high atomic number (82). Most elements of atomic number greater than 40 are less abundant.
World lead resources exceed two billion tons. Significant deposits are located in Australia, China, Ireland, Mexico, Peru, Portugal, Russia, and the United States. Global reserves—resources that are economically feasible to extract—totaled 88 million tons in 2016, of which Australia had 35 million, China 17 million, and Russia 6.4 million.[114]
Typical background concentrations of lead do not exceed 0.1 μg/m3 in the atmosphere; 100 mg/kg in soil; 4 mg/kg in vegetation and 5 μg/L in freshwater and seawater.[115]
Etymology[edit]
The modern English word lead is of Germanic origin; it comes from the Middle English leed and Old English lēad (with the macron above the «e» signifying that the vowel sound of that letter is long).[116] The Old English word is derived from the hypothetical reconstructed Proto-Germanic *lauda- (‘lead’).[117] According to linguistic theory, this word bore descendants in multiple Germanic languages of exactly the same meaning.[117]
There is no consensus on the origin of the Proto-Germanic *lauda-. One hypothesis suggests it is derived from Proto-Indo-European *lAudh- (‘lead’; capitalization of the vowel is equivalent to the macron).[118] Another hypothesis suggests it is borrowed from Proto-Celtic *ɸloud-io- (‘lead’). This word is related to the Latin plumbum, which gave the element its chemical symbol Pb. The word *ɸloud-io- is thought to be the origin of Proto-Germanic *bliwa- (which also means ‘lead’), from which stemmed the German Blei.[119]
The name of the chemical element is not related to the verb of the same spelling, which is derived from Proto-Germanic *laidijan- (‘to lead’).[120]
History[edit]
Prehistory and early history[edit]
Metallic lead beads dating back to 7000–6500 BCE have been found in Asia Minor and may represent the first example of metal smelting.[122] At that time lead had few (if any) applications due to its softness and dull appearance.[122] The major reason for the spread of lead production was its association with silver, which may be obtained by burning galena (a common lead mineral).[123] The Ancient Egyptians were the first to use lead minerals in cosmetics, an application that spread to Ancient Greece and beyond;[124] the Egyptians may have used lead for sinkers in fishing nets, glazes, glasses, enamels, and for ornaments.[123] Various civilizations of the Fertile Crescent used lead as a writing material, as coins,[125] and as a construction material.[123] Lead was used in the Ancient Chinese royal court as a stimulant,[123] as currency,[126] and as a contraceptive;[127] the Indus Valley civilization and the Mesoamericans[123] used it for making amulets; and the eastern and southern African peoples used lead in wire drawing.[128]
Classical era[edit]
Because silver was extensively used as a decorative material and an exchange medium, lead deposits came to be worked in Asia Minor from 3000 BCE; later, lead deposits were developed in the Aegean and Laurion.[129] These three regions collectively dominated production of mined lead until c. 1200 BCE.[130] Beginning circa 2000 BCE, the Phoenicians worked deposits in the Iberian peninsula; by 1600 BCE, lead mining existed in Cyprus, Greece, and Sardinia.[131]
Ancient Greek lead sling bullets with a winged thunderbolt molded on one side and the inscription «ΔΕΞΑΙ» («take that» or «catch») on the other side.[132]
Rome’s territorial expansion in Europe and across the Mediterranean, and its development of mining, led to it becoming the greatest producer of lead during the classical era, with an estimated annual output peaking at 80,000 tonnes. Like their predecessors, the Romans obtained lead mostly as a by-product of silver smelting.[121][133] Lead mining occurred in Central Europe, Britain, the Balkans, Greece, Anatolia, and Hispania, the latter accounting for 40% of world production.[121]
Lead tablets were commonly used as a material for letters.[134] Lead coffins, cast in flat sand forms, with interchangeable motifs to suit the faith of the deceased were used in ancient Judea.[135] Lead was used to make sling bullets from the 5th century BC. In Roman times, lead sling bullets were amply used, and were effective at a distance of between 100 and 150 meters. The Balearic slingers, used as mercenaries in Carthaginian and Roman armies, were famous for their shooting distance and accuracy.[136]
Lead was used for making water pipes in the Roman Empire; the Latin word for the metal, plumbum, is the origin of the English word «plumbing». Its ease of working, its low melting point enabling the easy fabrication of completely waterproof welded joints, and its resistance to corrosion[137] ensured its widespread use in other applications, including pharmaceuticals, roofing, currency, and warfare.[138][139][140] Writers of the time, such as Cato the Elder, Columella, and Pliny the Elder, recommended lead (or lead-coated) vessels for the preparation of sweeteners and preservatives added to wine and food. The lead conferred an agreeable taste due to the formation of «sugar of lead» (lead(II) acetate), whereas copper or bronze vessels could impart a bitter flavor through verdigris formation.[141]
This metal was by far the most used material in classical antiquity, and it is appropriate to refer to the (Roman) Lead Age. Lead was to the Romans what plastic is to us.
Heinz Eschnauer and Markus Stoeppler
«Wine—An enological specimen bank», 1992[142]
The Roman author Vitruvius reported the health dangers of lead[143][144] and modern writers have suggested that lead poisoning played a major role in the decline of the Roman Empire.[145][146][n] Other researchers have criticized such claims, pointing out, for instance, that not all abdominal pain is caused by lead poisoning.[148][149] According to archaeological research, Roman lead pipes increased lead levels in tap water but such an effect was «unlikely to have been truly harmful».[150][151] When lead poisoning did occur, victims were called «saturnine», dark and cynical, after the ghoulish father of the gods, Saturn. By association, lead was considered the father of all metals.[152] Its status in Roman society was low as it was readily available[153] and cheap.[154]
Confusion with tin and antimony[edit]
Since the Bronze Age metallurgists and engineers have understood the difference between rare and valuable tin, essential for alloying with copper to produce tough and corrosion resistant bronze, and ‘cheap and cheerful’ lead. However the nomenclature in some languages is similar. Romans called lead plumbum nigrum («black lead»), and tin plumbum candidum («bright lead»). The association of lead and tin can be seen in other languages: the word olovo in Czech translates to «lead», but in Russian, its cognate олово (olovo) means «tin».[155] To add to the confusion, lead bore a close relation to antimony: both elements commonly occur as sulfides (galena and stibnite), often together. Pliny incorrectly wrote that stibnite would give lead on heating, instead of antimony.[156] In countries such as Turkey and India, the originally Persian name surma came to refer to either antimony sulfide or lead sulfide,[157] and in some languages, such as Russian, gave its name to antimony (сурьма).[158]
Middle Ages and the Renaissance[edit]
Elizabeth I of England was commonly depicted with a whitened face. Lead in face whiteners is thought to have contributed to her death.[159]
Lead mining in Western Europe declined after the fall of the Western Roman Empire, with Arabian Iberia being the only region having a significant output.[160][161] The largest production of lead occurred in South and East Asia, especially China and India, where lead mining grew rapidly.[161]
In Europe, lead production began to increase in the 11th and 12th centuries, when it was again used for roofing and piping. Starting in the 13th century, lead was used to create stained glass.[162] In the European and Arabian traditions of alchemy, lead (symbol ♄ in the European tradition)[163] was considered an impure base metal which, by the separation, purification and balancing of its constituent essences, could be transformed to pure and incorruptible gold.[164] During the period, lead was used increasingly for adulterating wine. The use of such wine was forbidden for use in Christian rites by a papal bull in 1498, but it continued to be imbibed and resulted in mass poisonings up to the late 18th century.[160][165] Lead was a key material in parts of the printing press, and lead dust was commonly inhaled by print workers, causing lead poisoning.[166] Lead also became the chief material for making bullets for firearms: it was cheap, less damaging to iron gun barrels, had a higher density (which allowed for better retention of velocity), and its lower melting point made the production of bullets easier as they could be made using a wood fire.[167] Lead, in the form of Venetian ceruse, was extensively used in cosmetics by Western European aristocracy as whitened faces were regarded as a sign of modesty.[168][169] This practice later expanded to white wigs and eyeliners, and only faded out with the French Revolution in the late 18th century. A similar fashion appeared in Japan in the 18th century with the emergence of the geishas, a practice that continued long into the 20th century. The white faces of women «came to represent their feminine virtue as Japanese women»,[170] with lead commonly used in the whitener.[171]
Outside Europe and Asia[edit]
In the New World, lead production was recorded soon after the arrival of European settlers. The earliest record dates to 1621 in the English Colony of Virginia, fourteen years after its foundation.[172] In Australia, the first mine opened by colonists on the continent was a lead mine, in 1841.[173] In Africa, lead mining and smelting were known in the Benue Trough[174] and the lower Congo Basin, where lead was used for trade with Europeans, and as a currency by the 17th century,[175] well before the scramble for Africa.
Industrial Revolution[edit]
In the second half of the 18th century, Britain, and later continental Europe and the United States, experienced the Industrial Revolution. This was the first time during which lead production rates exceeded those of Rome.[176] Britain was the leading producer, losing this status by the mid-19th century with the depletion of its mines and the development of lead mining in Germany, Spain, and the United States.[177] By 1900, the United States was the leader in global lead production, and other non-European nations—Canada, Mexico, and Australia—had begun significant production; production outside Europe exceeded that within.[178] A great share of the demand for lead came from plumbing and painting—lead paints were in regular use.[179] At this time, more (working class) people were exposed to the metal and lead poisoning cases escalated. This led to research into the effects of lead intake. Lead was proven to be more dangerous in its fume form than as a solid metal. Lead poisoning and gout were linked; British physician Alfred Baring Garrod noted a third of his gout patients were plumbers and painters. The effects of chronic ingestion of lead, including mental disorders, were also studied in the 19th century. The first laws aimed at decreasing lead poisoning in factories were enacted during the 1870s and 1880s in the United Kingdom.[179]
Modern era[edit]
Promotional poster for Dutch Boy lead paint, United States, 1912
Further evidence of the threat that lead posed to humans was discovered in the late 19th and early 20th centuries. Mechanisms of harm were better understood, lead blindness was documented, and the element was phased out of public use in the United States and Europe. The United Kingdom introduced mandatory factory inspections in 1878 and appointed the first Medical Inspector of Factories in 1898; as a result, a 25-fold decrease in lead poisoning incidents from 1900 to 1944 was reported.[180] Most European countries banned lead paint—commonly used because of its opacity and water resistance[181]—for interiors by 1930.[182]
The last major human exposure to lead was the addition of tetraethyllead to gasoline as an antiknock agent, a practice that originated in the United States in 1921. It was phased out in the United States and the European Union by 2000.[179]
In the 1970s, the United States and Western European countries introduced legislation to reduce lead air pollution.[183][184] The impact was significant: while a study conducted by the Centers for Disease Control and Prevention in the United States in 1976–1980 showed that 77.8% of the population had elevated blood lead levels, in 1991–1994, a study by the same institute showed the share of people with such high levels dropped to 2.2%.[185] The main product made of lead by the end of the 20th century was the lead–acid battery.[186]
From 1960 to 1990, lead output in the Western Bloc grew by about 31%.[187] The share of the world’s lead production by the Eastern Bloc increased from 10% to 30%, from 1950 to 1990, with the Soviet Union being the world’s largest producer during the mid-1970s and the 1980s, and China starting major lead production in the late 20th century.[188] Unlike the European communist countries, China was largely unindustrialized by the mid-20th century; in 2004, China surpassed Australia as the largest producer of lead.[189] As was the case during European industrialization, lead has had a negative effect on health in China.[190]
Production[edit]
Primary production of lead since 1840
As of 2014, production of lead is increasing worldwide due to its use in lead–acid batteries.[191] There are two major categories of production: primary from mined ores, and secondary from scrap. In 2014, 4.58 million metric tons came from primary production and 5.64 million from secondary production. The top three producers of mined lead concentrate in that year were China, Australia, and the United States.[114] The top three producers of refined lead were China, the United States, and India.[192] According to the International Resource Panel’s Metal Stocks in Society report of 2010, the total amount of lead in use, stockpiled, discarded, or dissipated into the environment, on a global basis, is 8 kg per capita. Much of this is in more developed countries (20–150 kg per capita) rather than less developed ones (1–4 kg per capita).[193]
The primary and secondary lead production processes are similar. Some primary production plants now supplement their operations with scrap lead, and this trend is likely to increase in the future. Given adequate techniques, lead obtained via secondary processes is indistinguishable from lead obtained via primary processes. Scrap lead from the building trade is usually fairly clean and is re-melted without the need for smelting, though refining is sometimes needed. Secondary lead production is therefore cheaper, in terms of energy requirements, than is primary production, often by 50% or more.[194]
Primary[edit]
Most lead ores contain a low percentage of lead (rich ores have a typical content of 3–8%) which must be concentrated for extraction.[195] During initial processing, ores typically undergo crushing, dense-medium separation, grinding, froth flotation, and drying. The resulting concentrate, which has a lead content of 30–80% by mass (regularly 50–60%),[195] is then turned into (impure) lead metal.
There are two main ways of doing this: a two-stage process involving roasting followed by blast furnace extraction, carried out in separate vessels; or a direct process in which the extraction of the concentrate occurs in a single vessel. The latter has become the most common route, though the former is still significant.[196]
Two-stage process[edit]
First, the sulfide concentrate is roasted in air to oxidize the lead sulfide:[197]
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
As the original concentrate was not pure lead sulfide, roasting yields not only the desired lead(II) oxide, but a mixture of oxides, sulfates, and silicates of lead and of the other metals contained in the ore.[198] This impure lead oxide is reduced in a coke-fired blast furnace to the (again, impure) metal:[199]
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
Impurities are mostly arsenic, antimony, bismuth, zinc, copper, silver, and gold. Typically they are removed in a series of pyrometallurgical processes. The melt is treated in a reverberatory furnace with air, steam, and sulfur, which oxidizes the impurities except for silver, gold, and bismuth. Oxidized contaminants float to the top of the melt and are skimmed off.[200][201] Metallic silver and gold are removed and recovered economically by means of the Parkes process, in which zinc is added to lead. Zinc, which is immiscible in lead, dissolves the silver and gold. The zinc solution can be separated from the lead, and the silver and gold retrieved.[201][202] De-silvered lead is freed of bismuth by the Betterton–Kroll process, treating it with metallic calcium and magnesium. The resulting bismuth dross can be skimmed off.[201]
Alternatively to the pyrometallurgical processes, very pure lead can be obtained by processing smelted lead electrolytically using the Betts process. Anodes of impure lead and cathodes of pure lead are placed in an electrolyte of lead fluorosilicate (PbSiF6). Once electrical potential is applied, impure lead at the anode dissolves and plates onto the cathode, leaving the majority of the impurities in solution.[201][203] This is a high-cost process and thus mostly reserved for refining bullion containing high percentages of impurities.[204]
Direct process[edit]
In this process, lead bullion and slag is obtained directly from lead concentrates. The lead sulfide concentrate is melted in a furnace and oxidized, forming lead monoxide. Carbon (as coke or coal gas[o]) is added to the molten charge along with fluxing agents. The lead monoxide is thereby reduced to metallic lead, in the midst of a slag rich in lead monoxide.[196]
If the input is rich in lead, as much as 80% of the original lead can be obtained as bullion; the remaining 20% forms a slag rich in lead monoxide. For a low-grade feed, all of the lead can be oxidized to a high-lead slag.[196] Metallic lead is further obtained from the high-lead (25–40%) slags via submerged fuel combustion or injection, reduction assisted by an electric furnace, or a combination of both.[196]
Alternatives[edit]
Research on a cleaner, less energy-intensive lead extraction process continues; a major drawback is that either too much lead is lost as waste, or the alternatives result in a high sulfur content in the resulting lead metal. Hydrometallurgical extraction, in which anodes of impure lead are immersed into an electrolyte and pure lead is deposited (electrowound) onto a cathode, is a technique that may have potential, but is not currently economical except in cases where electricity is very cheap.[205]
Secondary[edit]
Smelting, which is an essential part of the primary production, is often skipped during secondary production. It is only performed when metallic lead has undergone significant oxidation.[194] The process is similar to that of primary production in either a blast furnace or a rotary furnace, with the essential difference being the greater variability of yields: blast furnaces produce hard lead (10% antimony) while reverberatory and rotary kiln furnaces produced semisoft lead (3–4% antimony).[206]
The ISASMELT process is a more recent smelting method that may act as an extension to primary production; battery paste from spent lead–acid batteries (containing lead sulfate and lead oxides) has its sulfate removed by treating it with alkali, and is then treated in a coal-fueled furnace in the presence of oxygen, which yields impure lead, with antimony the most common impurity.[207] Refining of secondary lead is similar to that of primary lead; some refining processes may be skipped depending on the material recycled and its potential contamination.[207]
Of the sources of lead for recycling, lead–acid batteries are the most important; lead pipe, sheet, and cable sheathing are also significant.[194]
Applications[edit]
Bricks of lead (alloyed with 4% antimony) are used as radiation shielding.[208]
Contrary to popular belief, pencil leads in wooden pencils have never been made from lead. When the pencil originated as a wrapped graphite writing tool, the particular type of graphite used was named plumbago (literally, act for lead or lead mockup).[209]
Elemental form[edit]
Lead metal has several useful mechanical properties, including high density, low melting point, ductility, and relative inertness. Many metals are superior to lead in some of these aspects but are generally less common and more difficult to extract from parent ores. Lead’s toxicity has led to its phasing out for some uses.[210]
Lead has been used for bullets since their invention in the Middle Ages. It is inexpensive; its low melting point means small arms ammunition and shotgun pellets can be cast with minimal technical equipment; and it is denser than other common metals, which allows for better retention of velocity. It remains the main material for bullets, alloyed with other metals as hardeners.[167] Concerns have been raised that lead bullets used for hunting can damage the environment.[p]
Lead’s high density and resistance to corrosion have been exploited in a number of related applications. It is used as ballast in sailboat keels; its density allows it to take up a small volume and minimize water resistance, thus counterbalancing the heeling effect of wind on the sails.[212] It is used in scuba diving weight belts to counteract the diver’s buoyancy.[213] In 1993, the base of the Leaning Tower of Pisa was stabilized with 600 tonnes of lead.[214] Because of its corrosion resistance, lead is used as a protective sheath for underwater cables.[215]
A 17th-century gold-coated lead sculpture
Lead has many uses in the construction industry; lead sheets are used as architectural metals in roofing material, cladding, flashing, gutters and gutter joints, and on roof parapets.[216][217] Lead is still used in statues and sculptures,[q] including for armatures.[219] In the past it was often used to balance the wheels of cars; for environmental reasons this use is being phased out in favor of other materials.[114]
Lead is added to copper alloys, such as brass and bronze, to improve machinability and for its lubricating qualities. Being practically insoluble in copper the lead forms solid globules in imperfections throughout the alloy, such as grain boundaries. In low concentrations, as well as acting as a lubricant, the globules hinder the formation of swarf as the alloy is worked, thereby improving machinability. Copper alloys with larger concentrations of lead are used in bearings. The lead provides lubrication, and the copper provides the load-bearing support.[220]
Lead’s high density, atomic number, and formability form the basis for use of lead as a barrier that absorbs sound, vibration, and radiation.[221] Lead has no natural resonance frequencies;[221] as a result, sheet-lead is used as a sound deadening layer in the walls, floors, and ceilings of sound studios.[222] Organ pipes are often made from a lead alloy, mixed with various amounts of tin to control the tone of each pipe.[223][224] Lead is an established shielding material from radiation in nuclear science and in X-ray rooms[225] due to its denseness and high attenuation coefficient.[226] Molten lead has been used as a coolant for lead-cooled fast reactors.[227]
Batteries[edit]
The largest use of lead in the early 21st century is in lead–acid batteries. The lead in batteries undergoes no direct contact with humans, so there are fewer toxicity concerns.[r] People who work in lead battery production plants may be exposed to lead dust and inhale it.[229] The reactions in the battery between lead, lead dioxide, and sulfuric acid provide a reliable source of voltage.[s] Supercapacitors incorporating lead–acid batteries have been installed in kilowatt and megawatt scale applications in Australia, Japan, and the United States in frequency regulation, solar smoothing and shifting, wind smoothing, and other applications.[231] These batteries have lower energy density and charge-discharge efficiency than lithium-ion batteries, but are significantly cheaper.[232]
Coating for cables[edit]
Lead is used in high voltage power cables as shell material to prevent water diffusion into insulation; this use is decreasing as lead is being phased out.[233] Its use in solder for electronics is also being phased out by some countries to reduce the amount of environmentally hazardous waste.[234] Lead is one of three metals used in the Oddy test for museum materials, helping detect organic acids, aldehydes, and acidic gases.[235][236]
Compounds[edit]
In addition to being the main application for lead metal, lead-acid batteries are also the main consumer of lead compounds. The energy storage/release reaction used in these devices involves lead sulfate and lead dioxide:
- Pb(s) + PbO
2(s) + 2H
2SO
4(aq) → 2PbSO
4(s) + 2H
2O(l)
Other applications of lead compounds are very specialized and often fading. Lead-based coloring agents are used in ceramic glazes and glass, especially for red and yellow shades.[237] While lead paints are phased out in Europe and North America, they remain in use in less developed countries such as China,[238] India,[239] or Indonesia.[240] Lead tetraacetate and lead dioxide are used as oxidizing agents in organic chemistry. Lead is frequently used in the polyvinyl chloride coating of electrical cords.[241][242] It can be used to treat candle wicks to ensure a longer, more even burn. Because of its toxicity, European and North American manufacturers use alternatives such as zinc.[243][244] Lead glass is composed of 12–28% lead oxide, changing its optical characteristics and reducing the transmission of ionizing radiation,[245] a property used in old TVs and computer monitors with cathode-ray tubes. Lead-based semiconductors such as lead telluride and lead selenide are used in photovoltaic cells and infrared detectors.[246]
Biological effects[edit]
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H332, H351, H360Df, H373, H410 |
|
Precautionary statements |
P201, P261, P273, P304, P308, P312, P313, P340, P391[247] |
| NFPA 704 (fire diamond) |
2 0 0 |
Lead has no confirmed biological role, and there is no confirmed safe level of lead exposure.[248] A 2009 Canadian–American study concluded that even at levels that are considered to pose little to no risk, lead may cause «adverse mental health outcomes».[249] Its prevalence in the human body—at an adult average of 120 mg[t]—is nevertheless exceeded only by zinc (2500 mg) and iron (4000 mg) among the heavy metals.[251] Lead salts are very efficiently absorbed by the body.[252] A small amount of lead (1%) is stored in bones; the rest is excreted in urine and feces within a few weeks of exposure. Only about a third of lead is excreted by a child. Continual exposure may result in the bioaccumulation of lead.[253]
Toxicity[edit]
Lead is a highly poisonous metal (whether inhaled or swallowed), affecting almost every organ and system in the human body.[254] At airborne levels of 100 mg/m3, it is immediately dangerous to life and health.[255] Most ingested lead is absorbed into the bloodstream.[256] The primary cause of its toxicity is its predilection for interfering with the proper functioning of enzymes. It does so by binding to the sulfhydryl groups found on many enzymes,[257] or mimicking and displacing other metals which act as cofactors in many enzymatic reactions.[258] The essential metals that lead interacts with include calcium, iron, and zinc.[259] High levels of calcium and iron tend to provide some protection from lead poisoning; low levels cause increased susceptibility.[252]
Effects[edit]
Lead can cause severe damage to the brain and kidneys and, ultimately, death. By mimicking calcium, lead can cross the blood–brain barrier. It degrades the myelin sheaths of neurons, reduces their numbers, interferes with neurotransmission routes, and decreases neuronal growth.[257] In the human body, lead inhibits porphobilinogen synthase and ferrochelatase, preventing both porphobilinogen formation and the incorporation of iron into protoporphyrin IX, the final step in heme synthesis. This causes ineffective heme synthesis and microcytic anemia.[260]
Symptoms of lead poisoning
Symptoms of lead poisoning include nephropathy, colic-like abdominal pains, and possibly weakness in the fingers, wrists, or ankles. Small blood pressure increases, particularly in middle-aged and older people, may be apparent and can cause anemia.[citation needed] Several studies, mostly cross-sectional, found an association between increased lead exposure and decreased heart rate variability.[261] In pregnant women, high levels of exposure to lead may cause miscarriage. Chronic, high-level exposure has been shown to reduce fertility in males.[262]
In a child’s developing brain, lead interferes with synapse formation in the cerebral cortex, neurochemical development (including that of neurotransmitters), and the organization of ion channels.[263] Early childhood exposure has been linked with an increased risk of sleep disturbances and excessive daytime drowsiness in later childhood.[264] High blood levels are associated with delayed puberty in girls.[265] The rise and fall in exposure to airborne lead from the combustion of tetraethyl lead in gasoline during the 20th century has been linked with historical increases and decreases in crime levels.
Exposure sources[edit]
Lead exposure is a global issue since lead mining and smelting, and battery manufacturing, disposal, and recycling, are common in many countries. Lead enters the body via inhalation, ingestion, or skin absorption. Almost all inhaled lead is absorbed into the body; for ingestion, the rate is 20–70%, with children absorbing a higher percentage than adults.[266]
Poisoning typically results from ingestion of food or water contaminated with lead, and less commonly after accidental ingestion of contaminated soil, dust, or lead-based paint.[267] Seawater products can contain lead if affected by nearby industrial waters.[268] Fruit and vegetables can be contaminated by high levels of lead in the soils they were grown in. Soil can be contaminated through particulate accumulation from lead in pipes, lead paint, and residual emissions from leaded gasoline.[269]
The use of lead for water pipes is a problem in areas with soft or acidic water.[270] Hard water forms insoluble protective layers on the inner surface of the pipes, whereas soft and acidic water dissolves the lead pipes.[271] Dissolved carbon dioxide in the carried water may result in the formation of soluble lead bicarbonate; oxygenated water may similarly dissolve lead as lead(II) hydroxide. Drinking such water, over time, can cause health problems due to the toxicity of the dissolved lead. The harder the water the more calcium bicarbonate and sulfate it will contain, and the more the inside of the pipes will be coated with a protective layer of lead carbonate or lead sulfate.[272]
Kymographic recording of the effect of lead acetate on frog heart experimental set up.
Ingestion of applied lead-based paint is the major source of exposure for children:
a direct source is chewing on old painted window sills. Alternatively, as the applied dry paint deteriorates, it peels, is pulverized into dust and then enters the body through hand-to-mouth contact or contaminated food, water, or alcohol. Ingesting certain home remedies may result in exposure to lead or its compounds.[273]
Inhalation is the second major exposure pathway, affecting smokers and especially workers in lead-related occupations.[256] Cigarette smoke contains, among other toxic substances, radioactive lead-210.[274] «As a result of EPA’s regulatory efforts, levels of lead in the air [in the United States] decreased by 86 percent between 2010 and 2020.»[275] The concentration of lead in the air in the United States fell below the national standard of 0.15 μg/m3[276] in 2014.[277]
Skin exposure may be significant for people working with organic lead compounds. The rate of skin absorption is lower for inorganic lead.[278]
Lead in plastic toys[edit]
According to the United States Center for Disease Control, the use of lead in plastics has not been banned. Lead softens the plastic and makes it more flexible so that it can go back to its original shape. It may also be used in plastic toys to stabilize molecules from heat. Lead dust can be formed when plastic is exposed to sunlight, air, and detergents that break down the chemical bond between the lead and plastics.[279]
Treatment[edit]
Treatment for lead poisoning normally involves the administration of dimercaprol and succimer.[280] Acute cases may require the use of disodium calcium edetate, the calcium chelate, and the disodium salt of ethylenediaminetetraacetic acid (EDTA). It has a greater affinity for lead than calcium, with the result that lead chelate is formed by exchange and excreted in the urine, leaving behind harmless calcium.[281]
Environmental effects[edit]
Battery collection site in Dakar, Senegal, where at least 18 children died of lead poisoning in 2008
The extraction, production, use, and disposal of lead and its products have caused significant contamination of the Earth’s soils and waters. Atmospheric emissions of lead were at their peak during the Industrial Revolution, and the leaded gasoline period in the second half of the twentieth century. [282]
Lead releases originate from natural sources (i.e., concentration of the naturally occurring lead), industrial production, incineration and recycling, and mobilization of previously buried lead.[282] In particular, as lead has been phased out from other uses, in the Global South, lead recycling operations designed to extract cheap lead used for global manufacturing have become a well documented source of exposure.[283] Elevated concentrations of lead persist in soils and sediments in post-industrial and urban areas; industrial emissions, including those arising from coal burning,[284] continue in many parts of the world, particularly in the developing countries.[285]
Lead can accumulate in soils, especially those with a high organic content, where it remains for hundreds to thousands of years. Environmental lead can compete with other metals found in and on plants surfaces potentially inhibiting photosynthesis and at high enough concentrations, negatively affecting plant growth and survival. Contamination of soils and plants can allow lead to ascend the food chain affecting microorganisms and animals. In animals, lead exhibits toxicity in many organs, damaging the nervous, renal, reproductive, hematopoietic, and cardiovascular systems after ingestion, inhalation, or skin absorption.[286] Fish uptake lead from both water and sediment;[287] bioaccumulation in the food chain poses a hazard to fish, birds, and sea mammals.[288]
Anthropogenic lead includes lead from shot and sinkers. These are among the most potent sources of lead contamination along with lead production sites.[289] Lead was banned for shot and sinkers in the United States in 2017,[290] although that ban was only effective for a month,[291] and a similar ban is being considered in the European Union.[292]
Analytical methods for the determination of lead in the environment include spectrophotometry, X-ray fluorescence, atomic spectroscopy and electrochemical methods. A specific ion-selective electrode has been developed based on the ionophore S,S’-methylenebis (N,N-diisobutyldithiocarbamate).[293] An important biomarker assay for lead poisoning is δ-aminolevulinic acid levels in plasma, serum, and urine.[294]
Restriction and remediation[edit]
Radiography of a swan found dead in Condé-sur-l’Escaut (northern France), highlighting lead shot. There are hundreds of lead pellets (a dozen is enough to kill an adult swan within a few days). Such bodies are sources of environmental contamination by lead.
By the mid-1980s, there was significant decline in the use of lead in industry. In the United States, environmental regulations reduced or eliminated the use of lead in non-battery products, including gasoline, paints, solders, and water systems. Particulate control devices were installed in coal-fired power plants to capture lead emissions.[284] In 1992, U.S. Congress required the Environmental Protection Agency to reduce the blood lead levels of the country’s children.[295] Lead use was further curtailed by the European Union’s 2003 Restriction of Hazardous Substances Directive.[296] A large drop in lead deposition occurred in the Netherlands after the 1993 national ban on use of lead shot for hunting and sport shooting: from 230 tonnes in 1990 to 47.5 tonnes in 1995.[297]
In the United States, the permissible exposure limit for lead in the workplace, comprising metallic lead, inorganic lead compounds, and lead soaps, was set at 50 μg/m3 over an 8-hour workday, and the blood lead level limit at 5 μg per 100 g of blood in 2012.[298] Lead may still be found in harmful quantities in stoneware,[299] vinyl[300] (such as that used for tubing and the insulation of electrical cords), and Chinese brass.[u] Old houses may still contain lead paint.[300] White lead paint has been withdrawn from sale in industrialized countries, but specialized uses of other pigments such as yellow lead chromate remain.[181] Stripping old paint by sanding produces dust which can be inhaled.[302] Lead abatement programs have been mandated by some authorities in properties where young children live.[303]
Lead waste, depending on the jurisdiction and the nature of the waste, may be treated as household waste (to facilitate lead abatement activities),[304] or potentially hazardous waste requiring specialized treatment or storage.[305] Lead is released into the environment in shooting places and a number of lead management practices have been developed to counter the lead contamination.[306] Lead migration can be enhanced in acidic soils; to counter that, it is advised soils be treated with lime to neutralize the soils and prevent leaching of lead.[307]
Research has been conducted on how to remove lead from biosystems by biological means: Fish bones are being researched for their ability to bioremediate lead in contaminated soil.[308][309] The fungus Aspergillus versicolor is effective at absorbing lead ions from industrial waste before being released to water bodies.[310] Several bacteria have been researched for their ability to remove lead from the environment, including the sulfate-reducing bacteria Desulfovibrio and Desulfotomaculum, both of which are highly effective in aqueous solutions.[311]
See also[edit]
- Derek Bryce-Smith – one of the earliest campaigners against lead in petrol in the UK
- Thomas Midgley Jr. – discovered that the addition of tetraethyllead to gasoline prevented «knocking» in internal combustion engines
- Clair Patterson – instrumental in the banning of tetraethyllead in gasoline in the US and lead solder in food cans.
- Robert A. Kehoe – foremost medical advocate for the use of tetraethyllead as an additive in gasoline.
Notes[edit]
- ^ The tetrahedral allotrope of tin is called α- or gray tin and is stable only at or below 13.2 °C (55.8 °F). The stable form of tin above this temperature is called β- or white tin and has a distorted face centered cubic (tetragonal) structure which can be derived by compressing the tetrahedra of gray tin along their cubic axes. White tin effectively has a structure intermediate between the regular tetrahedral structure of gray tin, and the regular face centered cubic structure of lead, consistent with the general trend of increasing metallic character going down any representative group.[14]
- ^ A quasicrystalline thin-film allotrope of lead, with pentagonal symmetry, was reported in 2013. The allotrope was obtained by depositing lead atoms on the surface of an icosahedral silver-indium-ytterbium quasicrystal. Its conductivity was not recorded.[15][16]
- ^ Diamond cubic structures with lattice parameters around the lattice parameter of silicon exists both in thin lead and tin films, and in massive lead and tin, freshly solidified in vacuum of ~5 x 10−6 Torr. Experimental evidence for almost identical structures of at least three oxide types is presented, demonstrating that lead and tin behave like silicon not only in the initial stages of crystallization, but also in the initial stages of oxidation.[17]
- ^ British English: to go down like a lead balloon.
- ^ Malleability describes how easily it deforms under compression, whereas ductility means its ability to stretch.
- ^ A (wet) finger can be dipped into molten lead without risk of a burning injury.[30]
- ^ An even number of either protons or neutrons generally increases the nuclear stability of isotopes, compared to isotopes with odd numbers. No elements with odd atomic numbers have more than two stable isotopes; even-numbered elements have multiple stable isotopes, with tin (element 50) having the highest number of isotopes of all elements, ten.[34] See Even and odd atomic nuclei for more details.
- ^ The half-life found in the experiment was 1.9×1019 years.[37] A kilogram of natural bismuth would have an activity value of approximately 0.003 becquerels (decays per second). For comparison, the activity value of natural radiation in the human body is around 65 becquerels per kilogram of body weight (4500 becquerels on average).[38]
- ^ Lead-205 decays solely via electron capture, which means when there are no electrons available and lead is fully ionized with all 82 electrons removed it cannot decay. Fully ionized thallium-205, the isotope lead-205 would decay to, becomes unstable and can decay into a bound state of lead-205.[49]
- ^ Tetraphenyllead is even more thermally stable, decomposing at 270 °C.[90]
- ^ Abundances in the source are listed relative to silicon rather than in per-particle notation. The sum of all elements per 106 parts of silicon is 2.6682×1010 parts; lead comprises 3.258 parts.
- ^ Elemental abundance figures are estimates and their details may vary from source to source.[112]
- ^ The inscription reads: «Made when the Emperor Vespasian was consul for the ninth term and the Emperor Titus was consul for the seventh term, when Gnaeus Iulius Agricola was imperial governor (of Britain).»
- ^ The fact that Julius Caesar fathered only one child, as well as the alleged sterility of his successor, Caesar Augustus, have been attributed to lead poisoning.[147]
- ^ Gaseous by-product of the coking process, containing carbon monoxide, hydrogen and methane; used as a fuel.
- ^ California began banning lead bullets for hunting on that basis in July 2015.[211]
- ^ For example, a firm «…producing quality [lead] garden ornament from our studio in West London for over a century».[218]
- ^ Potential injuries to regular users of such batteries are not related to lead’s toxicity.[228]
- ^ See[230] for details on how a lead–acid battery works.
- ^ Rates vary greatly by country.[250]
- ^ An alloy of brass (copper and zinc) with lead, iron, tin, and sometimes antimony.[301]
References[edit]
- ^ «Standard Atomic Weights: Lead». CIAAW. 2020.
- ^ a b Meija et al. 2016.
- ^ Pb(0) carbonyls have been observered in reaction between lead atoms and carbon monoxide; see Ling, Jiang; Qiang, Xu (2005). «Observation of the lead carbonyls PbnCO (n=1–4): Reactions of lead atoms and small clusters with carbon monoxide in solid argon». The Journal of Chemical Physics. 122 (3): 034505. 122 (3): 34505. Bibcode:2005JChPh.122c4505J. doi:10.1063/1.1834915. ISSN 0021-9606. PMID 15740207.
- ^ Weast, Astle & Beyer 1983, p. E110.
- ^ Theodore Low De Vinne (1899). The Practice of Typography: A Treatise on the Processes of Type-making, the Point System, the Names, Sizes, Styles, and Prices of Plain Printing Types. Century Company. pp. 9–36.
- ^ Lide 2005, p. 10-179.
- ^ Pyykkö 1988, pp. 563–594.
- ^ Claudio, Godwin & Magyar 2002, pp. 1–144.
- ^ Norman 1996, p. 36.
- ^ Greenwood & Earnshaw 1998, pp. 226–227, 374.
- ^ Christensen 2002, p. 867.
- ^ Slater 1964.
- ^ Considine & Considine 2013, pp. 501, 2970.
- ^ Parthé 1964, p. 13.
- ^ Sharma et al. 2013.
- ^ Sharma et al. 2014, p. 174710.
- ^ Peneva, Djuneva & Tsukeva 1981.
- ^ Greenwood & Earnshaw 1998, p. 372.
- ^ Greenwood & Earnshaw 1998, pp. 372–373.
- ^ a b Thornton, Rautiu & Brush 2001, p. 6.
- ^ Lide 2005, pp. 12–35, 12–40.
- ^ Brenner 2003, p. 396.
- ^ Jones 2014, p. 42.
- ^ Lide 2005, pp. 4–13, 4–21, 4–33.
- ^ Vogel & Achilles 2013, p. 8.
- ^ Anderson 1869, pp. 341–343.
- ^ Gale & Totemeier 2003, pp. 15–2–15–3.
- ^ Thornton, Rautiu & Brush 2001, p. 8.
- ^ a b Lide 2005, p. 12-219.
- ^ Willey 1999.
- ^ Lide 2005, p. 12-45.
- ^ Blakemore 1985, p. 272.
- ^ Webb, Marsiglio & Hirsch 2015.
- ^ a b c d e IAEA — Nuclear Data Section 2017.
- ^ University of California Nuclear Forensic Search Project.
- ^ a b Stone 1997.
- ^ de Marcillac et al. 2003, pp. 876–78.
- ^ World Nuclear Association 2015.
- ^ Beeman et al. 2013.
- ^ Radioactive Decay Series 2012.
- ^ Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials et al. 1999.
- ^ Smirnov, Borisevich & Sulaberidze 2012.
- ^ Greenwood & Earnshaw 1998, p. 368.
- ^ Levin 2009, pp. 40–41.
- ^ Webb 2000, p. 115.
- ^ Wrackmeyer & Horchler 1990.
- ^ Cangelosi & Pecoraro 2015.
- ^ Fiorini 2010, pp. 7–8.
- ^ Takahashi et al. 1987.
- ^ Thürmer, Williams & Reutt-Robey 2002, pp. 2033–2035.
- ^ Tétreault, Sirois & Stamatopoulou 1998, pp. 17–32.
- ^ Thornton, Rautiu & Brush 2001, pp. 10–11.
- ^ a b c d e f Greenwood & Earnshaw 1998, p. 373.
- ^ Bretherick 2016, p. 1442.
- ^ Harbison, Bourgeois & Johnson 2015, p. 132.
- ^ a b Greenwood & Earnshaw 1998, p. 374.
- ^ Thornton, Rautiu & Brush 2001, pp. 11–12.
- ^ Polyanskiy 1986, p. 20.
- ^ Kaupp 2014, pp. 9–10.
- ^ Dieter & Watson 2009, p. 509.
- ^ Hunt 2014, p. 215.
- ^ a b c King 1995, pp. 43–63.
- ^ Bunker & Casey 2016, p. 89.
- ^ Whitten, Gailey & David 1996, pp. 904–905.
- ^ Greenwood & Earnshaw 1998, p. 384.
- ^ Greenwood & Earnshaw 1998, p. 387.
- ^ a b Greenwood & Earnshaw 1998, p. 389.
- ^ Zuckerman & Hagen 1989, p. 426.
- ^ Funke 2013.
- ^ a b Greenwood & Earnshaw 1998, p. 382.
- ^ Bharara & Atwood 2006, p. 4.
- ^ Greenwood & Earnshaw 1998, p. 388.
- ^ Toxicological Profile for Lead 2007, p. 277.
- ^ Downs & Adams 2017, p. 1128.
- ^ Brescia 2012, p. 234.
- ^ Macintyre 1992, p. 3775.
- ^ Silverman 1966, pp. 2067–2069.
- ^ Greenwood & Earnshaw 1998, p. 381.
- ^ Yong, Hoffmann & Fässler 2006, pp. 4774–4778.
- ^ Becker et al. 2008, pp. 9965–9978.
- ^ Mosseri, Henglein & Janata 1990, pp. 2722–2726.
- ^ Konu & Chivers 2011, pp. 391–392.
- ^ Hadlington 2017, p. 59.
- ^ Greenwood & Earnshaw 1998, pp. 384–386.
- ^ Röhr 2017.
- ^ Alsfasser 2007, pp. 261–263.
- ^ Greenwood & Earnshaw 1998, p. 393.
- ^ Stabenow, Saak & Weidenbruch 2003.
- ^ a b Polyanskiy 1986, p. 43.
- ^ a b c d Greenwood & Earnshaw 1998, p. 404.
- ^ a b Wiberg, Wiberg & Holleman 2001, p. 918.
- ^ Toxicological Profile for Lead 2007, p. 287.
- ^ Polyanskiy 1986, p. 44.
- ^ Windholz 1976.
- ^ Zýka 1966, p. 569.
- ^ a b c d Lodders 2003, pp. 1222–1223.
- ^ Roederer et al. 2009, pp. 1963–1980.
- ^ Lochner, Rohrbach & Cochrane 2005, p. 12.
- ^ Lodders 2003, p. 1224.
- ^ Burbidge et al. 1957, pp. 608–615.
- ^ Burbidge et al. 1957, p. 551.
- ^ Burbidge et al. 1957, pp. 608–609.
- ^ Burbidge et al. 1957, p. 553.
- ^ Frebel 2015, pp. 114–115.
- ^ Burbidge et al. 1957, pp. 608–610.
- ^ Burbidge et al. 1957, p. 595.
- ^ Burbidge et al. 1957, p. 596.
- ^ Burbidge et al. 1957, pp. 582, 609–615.
- ^ Langmuir & Broecker 2012, pp. 183–184.
- ^ Davidson et al. 2014, pp. 4–5.
- ^ Emsley 2011, pp. 286, passim.
- ^ Cox 1997, p. 182.
- ^ a b Davidson et al. 2014, p. 4.
- ^ a b c d United States Geological Survey 2017, p. 97.
- ^ Rieuwerts 2015, p. 225.
- ^ Merriam-Webster.
- ^ a b Kroonen 2013, *lauda-.
- ^ Nikolayev 2012.
- ^ Kroonen 2013, *bliwa- 2.
- ^ Kroonen 2013, *laidijan-.
- ^ a b c Hong et al. 1994, pp. 1841–1843.
- ^ a b Rich 1994, p. 4.
- ^ a b c d e Winder 1993b.
- ^ History of Cosmetics.
- ^ Chapurukha Kusimba, June 20, 2017. «Making Cents of Currency’s Ancient Rise». Smithsonian Magazine. Retrieved 5 November 2021.
- ^ Yu & Yu 2004, p. 26.
- ^ Toronto museum explores 2003.
- ^ Bisson & Vogel 2000, p. 105.
- ^ Wood, Hsu & Bell 2021.
- ^ Rich 1994, p. 5.
- ^ United States Geological Survey 1973.
- ^ Lead sling bullet.
- ^ de Callataÿ 2005, pp. 361–372.
- ^ Ceccarelli 2013, p. 35.
- ^ Ossuaries and Sarcophagi.
- ^ Calvo Rebollar 2019, p. 45.
- ^ Rich 1994, p. 6.
- ^ Thornton, Rautiu & Brush 2001, pp. 179–184.
- ^ Bisel & Bisel 2002, pp. 459–460.
- ^ Retief & Cilliers 2006, pp. 149–151.
- ^ Grout 2017.
- ^ Eschnauer & Stoeppler 1992, p. 58.
- ^ Hodge 1981, pp. 486–491.
- ^ Marcus Vitruvius Pollio (1914) [c. 15 BC]. De architectura. Book 8, 10-11 fulltext.
- ^ Gilfillan 1965, pp. 53–60.
- ^ Nriagu 1983, pp. 660–663.
- ^ Frankenburg 2014, p. 16.
- ^ Scarborough 1984.
- ^ Waldron 1985, pp. 107–108.
- ^ Reddy & Braun 2010, p. 1052.
- ^ Delile et al. 2014, pp. 6594–6599.
- ^ Finger 2006, p. 184.
- ^ Lewis 1985, p. 15.
- ^ Thornton, Rautiu & Brush 2001, p. 183.
- ^ Polyanskiy 1986, p. 8.
- ^ Thomson 1830, p. 74.
- ^ Oxford English Dictionary, surma.
- ^ Vasmer 1986–1987, сурьма.
- ^ Kellett 2012, pp. 106–107.
- ^ a b Winder 1993a.
- ^ a b Rich 1994, p. 7.
- ^ Rich 1994, p. 8.
- ^ Ede & Cormack 2016, p. 54.
- ^ Cotnoir 2006, p. 35.
- ^ Samson 1885, p. 388.
- ^ Sinha et al. 1993.
- ^ a b Ramage 1980, p. 8.
- ^ Tungate 2011, p. 14.
- ^ Donnelly 2014, pp. 171–172.
- ^ Ashikari 2003, p. 65.
- ^ Nakashima et al. 1998, p. 59.
- ^ Rabinowitz 1995, p. 66.
- ^ Gill & Libraries Board of South Australia 1974, p. 69.
- ^ Bisson & Vogel 2000, p. 85.
- ^ Bisson & Vogel 2000, pp. 131–132.
- ^ Hong et al. 1994, pp. 1841–43.
- ^ Lead mining.
- ^ Rich 1994, p. 11.
- ^ a b c Riva et al. 2012, pp. 11–16.
- ^ Hernberg 2000, p. 246.
- ^ a b Crow 2007.
- ^ Markowitz & Rosner 2000, p. 37.
- ^ More et al. 2017.
- ^ American Geophysical Union 2017.
- ^ Centers for Disease Control and Prevention 1997.
- ^ Rich 1994, p. 117.
- ^ Rich 1994, p. 17.
- ^ Rich 1994, pp. 91–92.
- ^ United States Geological Survey 2005.
- ^ Zhang et al. 2012, pp. 2261–2273.
- ^ Tolliday 2014.
- ^ Guberman 2016, pp. 42.14–15.
- ^ Graedel 2010.
- ^ a b c Thornton, Rautiu & Brush 2001, p. 56.
- ^ a b Davidson et al. 2014, p. 6.
- ^ a b c d Davidson et al. 2014, p. 17.
- ^ Thornton, Rautiu & Brush 2001, p. 51.
- ^ Davidson et al. 2014, pp. 11–12.
- ^ Thornton, Rautiu & Brush 2001, pp. 51–52.
- ^ Davidson et al. 2014, p. 25.
- ^ a b c d Primary Lead Refining.
- ^ Pauling 1947.
- ^ Davidson et al. 2014, p. 34.
- ^ Davidson et al. 2014, p. 23.
- ^ Thornton, Rautiu & Brush 2001, pp. 52–53.
- ^ United States Environmental Protection Agency 2010, p. 1.
- ^ a b Thornton, Rautiu & Brush 2001, p. 57.
- ^ Street & Alexander 1998, p. 181.
- ^ Evans 1908, pp. 133–179.
- ^ Baird & Cann 2012, pp. 537–538, 543–547.
- ^ California Department of Fish and Wildlife.
- ^ Parker 2005, pp. 194–195.
- ^ Krestovnikoff & Halls 2006, p. 70.
- ^ Street & Alexander 1998, p. 182.
- ^ Jensen 2013, p. 136.
- ^ Think Lead research.
- ^ Weatherings to Parapets.
- ^ Lead garden ornaments 2016.
- ^ Putnam 2003, p. 216.
- ^ Copper Development Association.
- ^ a b Rich 1994, p. 101.
- ^ Guruswamy 2000, p. 31.
- ^ Audsley 1965, pp. 250–251.
- ^ Palmieri 2006, pp. 412–413.
- ^ National Council on Radiation Protection and Measurements 2004, p. 16.
- ^ Thornton, Rautiu & Brush 2001, p. 7.
- ^ Tuček, Carlsson & Wider 2006, p. 1590.
- ^ Concordia University 2016.
- ^ Toxicological Profile for Lead 2007, pp. 5–6.
- ^ Progressive Dynamics, Inc.
- ^ Olinsky-Paul 2013.
- ^ Gulbinska 2014.
- ^ Rich 1994, pp. 133–134.
- ^ Zhao 2008, p. 440.
- ^ Beiner et al. 2015.
- ^ Szczepanowska 2013, pp. 84–85.
- ^ Burleson 2001, p. 23.
- ^ Insight Explorer & IPEN 2016.
- ^ Singh 2017.
- ^ Ismawati et al. 2013, p. 2.
- ^ Zweifel 2009, p. 438.
- ^ Wilkes et al. 2005, p. 106.
- ^ Randerson 2002.
- ^ Nriagu & Kim 2000, pp. 37–41.
- ^ Amstock 1997, pp. 116–119.
- ^ Rogalski 2010, pp. 485–541.
- ^ «Lead 695912».
- ^ World Health Organization 2018.
- ^ Bouchard et al. 2009.
- ^ World Health Organization 2000, pp. 149–153.
- ^ Emsley 2011, pp. 280, 621, 255.
- ^ a b Luckey & Venugopal 1979, pp. 177–178.
- ^ Toxic Substances Portal.
- ^ United States Food and Drug Administration 2015, p. 42.
- ^ National Institute for Occupational Safety and Health.
- ^ a b Occupational Safety and Health Administration.
- ^ a b Rudolph et al. 2003, p. 369.
- ^ Dart, Hurlbut & Boyer-Hassen 2004, p. 1426.
- ^ Kosnett 2006, p. 238.
- ^ Cohen, Trotzky & Pincus 1981, pp. 904–906.
- ^ Navas-Acien 2007.
- ^ Sokol 2005, p. 133, passim.
- ^ Mycyk, Hryhorczuk & Amitai 2005, p. 462.
- ^ Liu et al. 2015, pp. 1869–1874.
- ^ Schoeters et al. 2008, pp. 168–175.
- ^ Tarragó 2012, p. 16.
- ^ Toxicological Profile for Lead 2007, p. 4.
- ^ Bremner 2002, p. 101.
- ^ Agency for Toxic Substances and Disease Registry.
- ^ Thornton, Rautiu & Brush 2001, p. 17.
- ^ Moore 1977, pp. 109–115.
- ^ Wiberg, Wiberg & Holleman 2001, p. 914.
- ^ Tarragó 2012, p. 11.
- ^ Centers for Disease Control and Prevention 2015.
- ^ «Lead (Pb) Air Pollution». epa.gov. United States Environmental Protection Agency. 8 July 2022. Retrieved 22 July 2022.
As a result of EPA’s regulatory efforts, levels of lead in the air nationally decreased by 86 percent between 2010 and 2020.
- ^ «NAAQS Table». epa.gov. United States Environmental Protection Agency. 5 April 2022. Retrieved 22 July 2022.
National Ambient Air Quality Standards (40 CFR part 50) for six principal pollutants
- ^ «Lead Trends». epa.gov. United States Environmental Protection Agency. 1 June 2022.
- ^ Wani, Ara & Usman 2015, pp. 57, 58.
- ^ «Lead in Consumer Products | Sources of Lead | CDC». www.cdc.gov. 1 February 2022. Retrieved 16 June 2022.
- ^ Prasad 2010, pp. 651–652.
- ^ Masters, Trevor & Katzung 2008, pp. 481–483.
- ^ a b United Nations Environment Programme 2010, p. 4.
- ^ Renfrew, Daniel (2019). Life without lead : contamination, crisis, and hope in Uruguay. Oakland, California. p. 8. ISBN 978-0-520-96824-0. OCLC 1102765674.
- ^ a b Trace element emission 2012.
- ^ United Nations Environment Programme 2010, p. 6.
- ^ Assi et al. 2016.
- ^ World Health Organization 1995.
- ^ UK Marine SACs Project 1999.
- ^ United Nations Environment Programme 2010, p. 9.
- ^ McCoy 2017.
- ^ Cama 2017.
- ^ Layton 2017.
- ^ Hauser 2017, pp. 49–60.
- ^ Lauwerys & Hoet 2001, pp. 115, 116–117.
- ^ Auer et al. 2016, p. 4.
- ^ Petzel, Juuti & Sugimoto 2004, pp. 122–124.
- ^ Deltares & Netherlands Organisation for Applied Scientific Research 2016.
- ^ Agency for Toxic Substances and Disease Registry 2017.
- ^ Grandjean 1978, pp. 303–321.
- ^ a b Levin et al. 2008, p. 1288.
- ^ Duda 1996, p. 242.
- ^ Marino et al. 1990, pp. 1183–1185.
- ^ Schoch 1996, p. 111.
- ^ United States Environmental Protection Agency 2000.
- ^ Lead in Waste 2016.
- ^ United States Environmental Protection Agency 2005, p. I-1.
- ^ United States Environmental Protection Agency 2005, p. III-5–III-6.
- ^ Freeman 2012, pp. a20–a21.
- ^ Young 2012.
- ^ Acton 2013, pp. 94–95.
- ^ Park et al. 2011, pp. 162–174.
Bibliography[edit]
This article was submitted to WikiJournal of Science for external academic peer review in 2017 (reviewer reports). The updated content was reintegrated into the Wikipedia page under a CC-BY-SA-3.0 license (2018). The version of record as reviewed is:
Mikhail Boldyrev; et al. (3 July 2018). «Lead: properties, history, and applications» (PDF). WikiJournal of Science. 1 (2): 7. doi:10.15347/WJS/2018.007. ISSN 2470-6345. Wikidata Q56050531.
- Acton, Q. A., ed. (2013). Issues in Global Environment—Pollution and Waste Management: 2012 Edition. ScholarlyEditions. ISBN 978-1-4816-4665-9.
- Agency for Toxic Substances and Disease Registry. «Information for the Community: Lead Toxicity» (MP4 webcast, 82 MB). Retrieved 11 February 2017.
- Agency for Toxic Substances and Disease Registry (2017). «Lead Toxicity. What Are U.S. Standards for Lead Levels?». Retrieved 12 June 2018.
- Alsfasser, R. (2007). Moderne anorganische Chemie [Modern inorganic chemistry] (in German). Walter de Gruyter. ISBN 978-3-11-019060-1.
- American Geophysical Union (2017). «Human Activity Has Polluted European Air for 2000 Years». Eos Science News. Archived from the original on 27 June 2017. Retrieved 4 July 2017.
- Amstock, J. S. (1997). Handbook of Glass in Construction. McGraw-Hill Professional. ISBN 978-0-07-001619-4.
- Anderson, J. (1869). «Malleability and ductility of metals». Scientific American. 21 (22): 341–43. doi:10.1038/scientificamerican11271869-341.
- Ashikari, M. (2003). «The memory of the women’s white faces: Japaneseness and the ideal image of women». Japan Forum. 15 (1): 55–79. doi:10.1080/0955580032000077739. S2CID 144510689.
- Assi, M. A.; Hezmee, M. N. M.; Haron, A. W.; et al. (2016). «The detrimental effects of lead on human and animal health». Veterinary World. 9 (6): 660–671. doi:10.14202/vetworld.2016.660-671. ISSN 0972-8988. PMC 4937060. PMID 27397992.
- Auer, Charles M.; Kover, Frank D.; Aidala, James V.; Greenwood, Mark (1 March 2016). Toxic Substances: A Half Century of Progress (PDF) (Report). EPA Alumni Association. Retrieved 1 January 2019.
- Audsley, G. A. (1965). The Art of Organ Building. Vol. 2. Courier. ISBN 978-0-486-21315-6.
- Baird, C.; Cann, N. (2012). Environmental Chemistry (5th ed.). W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
- Becker, M.; Förster, C.; Franzen, C.; et al. (2008). «Persistent radicals of trivalent tin and lead». Inorganic Chemistry. 47 (21): 9965–78. doi:10.1021/ic801198p. PMID 18823115.
- Beeman, J. W.; Bellini, F.; Cardani, L.; et al. (2013). «New experimental limits on the α decays of lead isotopes». European Physical Journal A. 49 (50): 50. arXiv:1212.2422. Bibcode:2013EPJA…49…50B. doi:10.1140/epja/i2013-13050-7. S2CID 119280082.
- Beiner, G. G.; Lavi, M.; Seri, H.; et al. (2015). «Oddy Tests: Adding the Analytical Dimension». Collection Forum. 29 (1–2): 22–36. doi:10.14351/0831-4985-29.1.22. ISSN 0831-4985.
- Bharara, M. S.; Atwood, D. A. (2006). «Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in theEncyclopedia of Inorganic Chemistry, First Edition». Lead: Inorganic Chemistry. doi:10.1002/0470862106.ia118. ISBN 978-0470860786.
- Bisel, S. C.; Bisel, J. F. (2002). «Health and nutrition at Herculaneum». In Jashemski, W. F.; Meyer, F. G. (eds.). The Natural History of Pompeii. Cambridge University Press. pp. 451–75. ISBN 978-0-521-80054-9.
- Bisson, M. S.; Vogel, J. O. (2000). Ancient African Metallurgy: The Sociocultural Context. Rowman & Littlefield. ISBN 978-0-7425-0261-1.
- Blakemore, J. S. (1985). Solid State Physics. Cambridge University Press. ISBN 978-0-521-31391-9.
- Bouchard, M. F.; Bellinger, D. C.; Weuve, J.; et al. (2009). «Blood Lead Levels and Major Depressive Disorder, Panic Disorder, and Generalized Anxiety Disorder in US Young Adults». Archives of General Psychiatry. 66 (12): 1313–9. doi:10.1001/archgenpsychiatry.2009.164. ISSN 0003-990X. PMC 2917196. PMID 19996036.
- Bremner, H. A. (2002). Safety and Quality Issues in Fish Processing. Elsevier. ISBN 978-1-85573-678-8.
- Brenner, G. A. (2003). Webster’s New World American Idioms Handbook. John Wiley & Sons. ISBN 978-0-7645-2477-6.
- Brescia, F. (2012). Fundamentals of Chemistry: A Modern Introduction. Elsevier. ISBN 978-0-323-14231-1.
- Bretherick, L. (2016). Bretherick’s Handbook of Reactive Chemical Hazards. Elsevier. ISBN 978-1-4831-6250-8.
- Bunker, B. C.; Casey, W. H. (2016). The Aqueous Chemistry of Oxides. Oxford University Press. ISBN 978-0-19-938425-9.
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. (1957). «Synthesis of the Elements in Stars». Reviews of Modern Physics. 29 (4): 547–654. Bibcode:1957RvMP…29..547B. doi:10.1103/RevModPhys.29.547.
- Burleson, M. (2001). The Ceramic Glaze Handbook: Materials, Techniques, Formulas. Sterling. ISBN 9781579904395.
- California Department of Fish and Wildlife. «Nonlead Ammunition in California». www.wildlife.ca.gov. Retrieved 17 May 2017.
- de Callataÿ, F. (2005). «The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks». Journal of Roman Archaeology. 18: 361–72. doi:10.1017/S104775940000742X. S2CID 232346123.
- Cama, T. (2017). «Interior secretary repeals ban on lead bullets». The Hill. Retrieved 30 May 2018.
- Cangelosi, V. M.; Pecoraro, V. L. (2015). «Lead». In Roduner, E. (ed.). Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles. Royal Society of Chemistry. pp. 843–875. ISBN 978-1-78262-494-3.
- Casciani, D. (2014). «Did removing lead from petrol spark a decline in crime?». BBC News. Retrieved 30 January 2017.
- Calvo Rebollar, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. ISBN 978-84-8321-908-9.
- Ceccarelli, P. (2013). Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC). OUP Oxford. ISBN 978-0-19-967559-3.
- Centers for Disease Control and Prevention (1997). «Update: blood lead levels—United States, 1991-1994». Morbidity and Mortality Weekly Report. 46 (7): 141–146. ISSN 0149-2195. PMID 9072671.
- Centers for Disease Control and Prevention (2015). «Radiation and Your Health». Retrieved 28 February 2017.
- Christensen, N. E. (2002). «Relativistic Solid State Theory». In Schwerdtfeger, P. (ed.). Relativistic Electronic Structure Theory — Fundamentals. Theoretical and Computational Chemistry. Vol. 11. Elsevier. pp. 867–68. doi:10.1016/s1380-7323(02)80041-3. ISBN 978-0-08-054046-7.
- Claudio, Elizabeth S.; Godwin, Hilary Arnold; Magyar, John S. (2002). «Fundamental Coordination Chemistry, Environmental Chemistry, and Biochemistry of Lead(II)». Progress in Inorganic Chemistry, Volume 51. John Wiley & Sons, Inc. pp. 1–144. doi:10.1002/0471267287.ch1. ISBN 978-0-471-26534-4.
- Cohen, A. R.; Trotzky, M. S.; Pincus, D. (1981). «Reassessment of the Microcytic Anemia of Lead Poisoning». Pediatrics. 67 (6): 904–906. doi:10.1542/peds.67.6.904. PMID 7232054. S2CID 42146120.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials; Commission on Life Sciences; Division on Earth and Life Studies; National Research Council (1999). Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials. National Academies Press. pp. 26, 30–32. ISBN 978-0-309-58070-0.
- Concordia University (2016). Lead acid batteries (PDF) (Report). Retrieved 17 February 2019.
- Considine, D. M.; Considine, G. D. (2013). Van Nostrand’s Scientific Encyclopedia. Springer Science & Business Media. ISBN 978-1-4757-6918-0.
- Copper Development Association. «Leaded Coppers». copper.org. Retrieved 10 July 2016.
- Cotnoir, B. (2006). The Weiser Concise Guide to Alchemy. Weiser Books. ISBN 978-1-57863-379-1.
- Cox, P. A. (1997). The Elements: Their Origin, Abundance and Distribution. Oxford University Press. ISBN 978-0-19-855298-7.
- Crow, J. M. (2007). «Why use lead in paint?». Chemistry World. Royal Society of Chemistry. Retrieved 22 February 2017.
- Dart, R. C.; Hurlbut, K. M.; Boyer-Hassen, L. V. (2004). «Lead». In Dart, R. C. (ed.). Medical Toxicology (3rd ed.). Lippincott Williams & Wilkins. p. 1426. ISBN 978-0-7817-2845-4.
- Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). «Lead». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a15_193.pub3. ISBN 978-3-527-30673-2.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. (2003). «Experimental detection of α-particles from the radioactive decay of natural bismuth». Nature. 422 (6934): 876–78. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201. S2CID 4415582.
- Delile, H.; Blichert-Toft, J.; Goiran, J.-P.; et al. (2014). «Lead in ancient Rome’s city waters». Proceedings of the National Academy of Sciences. 111 (18): 6594–99. Bibcode:2014PNAS..111.6594D. doi:10.1073/pnas.1400097111. ISSN 0027-8424. PMC 4020092. PMID 24753588.
- Deltares; Netherlands Organisation for Applied Scientific Research (2016). Lood en zinkemissies door jacht [Lead and zinc emissions from hunting] (PDF) (Report) (in Dutch). Retrieved 18 February 2017.
- Dieter, R. K.; Watson, R. T. (2009). «Transmetalation reactions producing organocopper compounds». In Rappoport, Z.; Marek, I. (eds.). The Chemistry of Organocopper Compounds. Vol. 1. John Wiley & Sons. pp. 443–526. ISBN 978-0-470-77296-6.
- Donnelly, J. (2014). Deep Blue. Hachette Children’s Group. ISBN 978-1-4449-2119-9.
- Downs, A. J.; Adams, C. J. (2017). The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry. Elsevier. ISBN 978-1-4831-5832-7.
- Duda, M. B. (1996). Traditional Chinese Toggles: Counterweights and Charms. Editions Didier Millet. ISBN 978-981-4260-61-9.
- Ede, A.; Cormack, L. B. (2016). A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press. ISBN 978-1-4426-3503-6.
- Emsley, J. (2011). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-960563-7.
- «Encyclopedia Judaica: Ossuaries and Sarcophagi». www.jewishvirtuallibrary.org. Retrieved 14 July 2018.
- Eschnauer, H. R.; Stoeppler, M. (1992). «Wine—An enological specimen bank». In Stoeppler, M. (ed.). Hazardous Materials in the Environment. Elsevier Science. pp. 49–72 (58). doi:10.1016/s0167-9244(08)70103-3. ISBN 978-0-444-89078-8.
- Evans, J. W. (1908). «V.— The meanings and synonyms of plumbago». Transactions of the Philological Society. 26 (2): 133–79. doi:10.1111/j.1467-968X.1908.tb00513.x.
- Finger, S. (2006). Doctor Franklin’s Medicine. University of Pennsylvania Press. ISBN 978-0-8122-3913-3.
- Fiorini, E. (2010). «2.000 years-old Roman Lead for physics» (PDF). ASPERA: 7–8. Archived from the original (PDF) on 26 April 2018. Retrieved 29 October 2016.
- Frankenburg, F. R. (2014). Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History. ABC-CLIO. ISBN 978-1-4408-2932-1.
- Frebel, A. (2015). Searching for the Oldest Stars: Ancient Relics from the Early Universe. Princeton University. ISBN 978-0-691-16506-6.
- Freeman, K. S. (2012). «Remediating soil lead with fishbones». Environmental Health Perspectives. 120 (1): a20–a21. doi:10.1289/ehp.120-a20a. PMC 3261960. PMID 22214821.
- Funke, K. (2013). «Solid State Ionics: from Michael Faraday to green energy—the European dimension». Science and Technology of Advanced Materials. 14 (4): 1–50. Bibcode:2013STAdM..14d3502F. doi:10.1088/1468-6996/14/4/043502. PMC 5090311. PMID 27877585.
- Gale, W. F.; Totemeier, T. C. (2003). Smithells Metals Reference Book. Butterworth-Heinemann. ISBN 978-0-08-048096-1.
- Gilfillan, S. C. (1965). «Lead poisoning and the fall of Rome». Journal of Occupational Medicine. 7 (2): 53–60. ISSN 0096-1736. PMID 14261844.
- Gill, T.; Libraries Board of South Australia (1974). The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia. ISBN 9780724300358.
- Graedel, T. E.; et al. (2010). Metal stocks in Society – Scientific Synthesis (PDF) (Report). International Resource Panel. p. 17. ISBN 978-92-807-3082-1. Archived from the original (PDF) on 26 April 2018. Retrieved 18 April 2017.
- Grandjean, P. (1978). «Widening perspectives of lead toxicity». Environmental Research. 17 (2): 303–21. Bibcode:1978ER…..17..303G. doi:10.1016/0013-9351(78)90033-6. PMID 400972.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Grout, J. (2017). «Lead poisoning and Rome». Encyclopaedia Romana. Retrieved 15 February 2017.
- Guberman, D. E. (2016). «Lead» (PDF). 2014 Minerals Yearbook (Report). United States Geological Survey. Retrieved 8 May 2017.
- Gulbinska, M. K. (2014). Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective. Springer. p. 96. ISBN 978-1-4471-6548-4.
- Guruswamy, S. (2000). Engineering properties and applications of lead alloys. Marcel Dekker. ISBN 978-0-8247-8247-4.
- Hadlington, T. J. (2017). On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes. Springer. ISBN 978-3-319-51807-7.
- Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. (2015). Hamilton and Hardy’s Industrial Toxicology. John Wiley & Sons. ISBN 978-0-470-92973-5.
- Hauser, P. C. (2017). «Analytical Methods for the Determination of Lead in the Environment». In Astrid, S.; Helmut, S.; Sigel, R. K. O. (eds.). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. de Gruyter. pp. 49–60. doi:10.1515/9783110434330-003. ISBN 9783110434330. PMID 28731296.
- Hernberg, S. (2000). «Lead Poisoning in a Historical Perspective» (PDF). American Journal of Industrial Medicine. 38 (3): 244–54. doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F. PMID 10940962. Archived from the original (PDF) on 21 September 2017. Retrieved 1 March 2017.
- «A History of Cosmetics from Ancient Times». Cosmetics Info. Archived from the original on 14 July 2016. Retrieved 18 July 2016.
- Hodge, T. A. (1981). «Vitruvius, lead pipes and lead poisoning». American Journal of Archaeology. 85 (4): 486–91. doi:10.2307/504874. JSTOR 504874. S2CID 193094209.
- Hong, S.; Candelone, J.-P.; Patterson, C. C.; et al. (1994). «Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations» (PDF). Science. 265 (5180): 1841–43. Bibcode:1994Sci…265.1841H. doi:10.1126/science.265.5180.1841. PMID 17797222. S2CID 45080402.
- Hunt, A. (2014). Dictionary of Chemistry. Routledge. ISBN 978-1-135-94178-9.
- IAEA — Nuclear Data Section (2017). «Livechart — Table of Nuclides — Nuclear structure and decay data». www-nds.iaea.org. International Atomic Energy Agency. Retrieved 31 March 2017.
- Insight Explorer; IPEN (2016). New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves (PDF) (Report). Retrieved 3 May 2018.
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Scott; Weinberg, Jack; Denney, Valerie (2013). Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (Report) (in Indonesian). BaliFokus & IPEN. Retrieved 26 December 2018.
- Jensen, C. F. (2013). Online Location of Faults on AC Cables in Underground Transmission. Springer. ISBN 978-3-319-05397-4.
- Jones, P. A. (2014). Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions. Constable. ISBN 978-1-47211-389-4.
- Kaupp, M. (2014). «Chemical bonding of main-group elements» (PDF). In Frenking, G.; Shaik, S. (eds.). The Chemical Bond: Chemical Bonding Across the Periodic Table. John Wiley & Sons. pp. 1–24. doi:10.1002/9783527664658.ch1. ISBN 9783527664658. S2CID 17979350.
- Kellett, C. (2012). Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes. Accent Press. ISBN 978-1-909335-05-9.
- King, R. B. (1995). Inorganic Chemistry of Main Group Elements. VCH Publishers. ISBN 978-1-56081-679-9.
- Konu, J.; Chivers, T. (2011). «Stable Radicals of the Heavy p-Block Elements». In Hicks, R. G. (ed.). Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons. doi:10.1002/9780470666975.ch10. ISBN 978-0-470-77083-2.
- Kosnett, M. J. (2006). «Lead». In Olson, K. R. (ed.). Poisoning and Drug Overdose (5th ed.). McGraw-Hill Professional. p. 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M.; Halls, M. (2006). Scuba Diving. Dorling Kindersley. ISBN 978-0-7566-4063-7.
- Kroonen, G. (2013). Etymological Dictionary of Proto-Germanic. Leiden Indo-European Etymological Dictionary Series. Vol. 11. Brill. ISBN 978-90-04-18340-7.
- Langmuir, C. H.; Broecker, W. S. (2012). How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. Princeton University Press. ISBN 978-0-691-14006-3.
- Lauwerys, R. R.; Hoet, P. (2001). Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition. CRC Press. ISBN 978-1-4822-9383-8.
- Layton, M. (2017). «Lead faces threat of new Euro ban». shootinguk.co.uk. Retrieved 30 May 2018.
- «Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI «Catch!»«. The British Museum. Archived from the original on 14 February 2012. Retrieved 30 April 2012.
- «Lead garden ornaments». H. Crowther Ltd. 2016. Retrieved 20 February 2017.
- «Lead in Waste Disposal». United States Environmental Protection Agency. 2016. Retrieved 28 February 2017.
- «Lead mining». The Northern Echo. Retrieved 16 February 2016.
- Levin, H. L. (2009). The Earth Through Time. John Wiley & Sons. ISBN 978-0-470-38774-0.
- Levin, R.; Brown, M. J.; Kashtock, M. E.; et al. (2008). «Lead exposures in U.S. children, 2008: Implications for prevention». Environmental Health Perspectives. 116 (10): 1285–93. doi:10.1289/ehp.11241. PMC 2569084. PMID 18941567.
- Lewis, J. (1985). «Lead Poisoning: A Historical Perspective». EPA Journal. 11 (4): 15–18. Retrieved 31 January 2017.
- Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. ISBN 978-0-8493-0484-2.
- Liu, J.; Liu, X.; Pak, V.; et al. (2015). «Early blood lead levels and sleep disturbance in preadolescence». Sleep. 38 (12): 1869–74. doi:10.5665/sleep.5230. PMC 4667382. PMID 26194570.
- Lochner, J. C.; Rohrbach, G.; Cochrane, K. (2005). «What is Your Cosmic Connection to the Elements?» (PDF). Goddard Space Flight Center. Archived from the original (PDF) on 29 December 2016. Retrieved 2 July 2017.
- Lodders, K. (2003). «Solar System abundances and condensation temperatures of the elements» (PDF). The Astrophysical Journal. 591 (2): 1220–47. Bibcode:2003ApJ…591.1220L. doi:10.1086/375492. ISSN 0004-637X. S2CID 42498829.
- Luckey, T. D.; Venugopal, B. (1979). Physiologic and Chemical Basis for Metal Toxicity. Plenum Press. ISBN 978-1-4684-2952-7.
- Macintyre, J. E. (1992). Dictionary of Inorganic Compounds. CRC Press. ISBN 978-0-412-30120-9.
- Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. (1990). «A case report of lead paint poisoning during renovation of a Victorian farmhouse». American Journal of Public Health. 80 (10): 1183–85. doi:10.2105/AJPH.80.10.1183. PMC 1404824. PMID 2119148.
- Markowitz, G.; Rosner, D. (2000). ««Cater to the children»: the role of the lead industry in a public health tragedy, 1900–55″. American Journal of Public Health. 90 (1): 36–46. doi:10.2105/ajph.90.1.36. PMC 1446124. PMID 10630135.
- Masters, S. B.; Trevor, A. J.; Katzung, B. G. (2008). Katzung & Trevor’s Pharmacology: Examination & Board Review (8th ed.). McGraw-Hill Medical. ISBN 978-0-07-148869-3.
- McCoy, S. (2017). «The End of Lead? Federal Gov’t Order Bans Sinkers, Ammo». GearJunkie. Retrieved 30 May 2018.
- Meija, Juris; et al. (2016). «Atomic weights of the elements 2013 (IUPAC Technical Report)». Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Merriam-Webster. «Definition of LEAD». www.merriam-webster.com. Retrieved 12 August 2016.
- Moore, M. R. (1977). «Lead in drinking water in soft water areas—health hazards». Science of the Total Environment. 7 (2): 109–15. Bibcode:1977ScTEn…7..109M. doi:10.1016/0048-9697(77)90002-X. PMID 841299.
- More, A. F.; Spaulding, N. E.; Bohleber, P.; et al. (2017). «Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death» (PDF). GeoHealth. 1 (4): 211–219. doi:10.1002/2017GH000064. ISSN 2471-1403. PMC 7007106. PMID 32158988.
- Mosseri, S.; Henglein, A.; Janata, E. (1990). «Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species». Journal of Physical Chemistry. 94 (6): 2722–26. doi:10.1021/j100369a089.
- Mycyk, M.; Hryhorczuk, D.; Amitai, Y.; et al. (2005). «Lead». In Erickson, T. B.; Ahrens, W. R.; Aks, S. (eds.). Pediatric Toxicology: Diagnosis and Management of the Poisoned Child. McGraw-Hill Professional. ISBN 978-0-07-141736-5.
- Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. (1998). «Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period». Journal of Occupational Health. 40 (1): 55–60. doi:10.1539/joh.40.55.
- National Council on Radiation Protection and Measurements (2004). Structural Shielding Design for Medical X-ray Imaging Facilities. ISBN 978-0-929600-83-3.
- National Institute for Occupational Safety and Health. «NIOSH Pocket Guide to Chemical Hazards — Lead». www.cdc.gov. Retrieved 18 November 2016.
- Navas-Acien, A. (2007). «Lead Exposure and Cardiovascular Disease—A Systematic Review». Environmental Health Perspectives. 115 (3): 472–482. doi:10.1289/ehp.9785. PMC 1849948. PMID 17431501.
- Nikolayev, S., ed. (2012). «*lAudh-«. Indo-European Etymology. starling.rinet.ru. Retrieved 21 August 2016.
- Norman, N. C. (1996). Periodicity and the s- and p-Block Elements. Oxford University Press. ISBN 978-0-19-855961-0.
- Nriagu, J. O. (1983). «Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?». The New England Journal of Medicine. 308 (11): 660–63. doi:10.1056/NEJM198303173081123. PMID 6338384.
- Nriagu, J. O.; Kim, M-J. (2000). «Emissions of lead and zinc from candles with metal-core wicks». Science of the Total Environment. 250 (1–3): 37–41. Bibcode:2000ScTEn.250…37N. doi:10.1016/S0048-9697(00)00359-4. PMID 10811249.
- Occupational Safety and Health Administration. «Substance data sheet for occupational exposure to lead». www.osha.gov. Archived from the original on 16 March 2018. Retrieved 1 July 2017.
- Olinsky-Paul, T. (2013). «East Penn and Ecoult battery installation case study webinar» (PDF). Clean Energy States Alliance. Retrieved 28 February 2017.
- Palmieri, R., ed. (2006). The Organ. Psychology Press. ISBN 978-0-415-94174-7.
- «surma». Oxford English Dictionary (2nd ed.). Oxford University Press. 2009.
- Park, J. H.; Bolan, N.; Meghara, M.; et al. (2011). «Bacterial-assisted immobilization of lead in soils: Implications for remediation» (PDF). Pedologist: 162–74. Archived from the original (PDF) on 26 November 2015.
- Parker, R. B. (2005). The New Cold-Molded Boatbuilding: From Lofting to Launching. WoodenBoat Books. ISBN 978-0-937822-89-0.
- Parthé, E. (1964). Crystal Chemistry of Tetrahedral Structures. CRC Press. ISBN 978-0-677-00700-7.
- Pauling, L. (1947). General Chemistry. W. H. Freeman and Company. ISBN 978-0-486-65622-9.
- Peneva, S. K.; Djuneva, K. D.; Tsukeva, E. A. (1981). «RHEED study of the initial stages of crystallization and oxidation of lead and tin». Journal of Crystal Growth. 53 (2): 382–396. Bibcode:1981JCrGr..53..382P. doi:10.1016/0022-0248(81)90088-9. ISSN 0022-0248.
- Petzel, S.; Juuti, M.; Sugimoto, Yu. (2004). «Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue». In Puttlitz, K. J.; Stalter, K. A. (eds.). Handbook of Lead-Free Solder Technology for Microelectronic Assemblies. CRC Press. ISBN 978-0-8247-5249-1.
- Polyanskiy, N. G. (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead] (in Russian). Nauka.
- Prasad, P. J. (2010). Conceptual Pharmacology. Universities Press. ISBN 978-81-7371-679-9. Retrieved 21 June 2012.
- «Primary Lead Refining Technical Notes». LDA International. Archived from the original on 22 March 2007. Retrieved 7 April 2007.
- Progressive Dynamics, Inc. «How Lead Acid Batteries Work: Battery Basics». progressivedyn.com. Archived from the original on 19 November 2018. Retrieved 3 July 2016.
- Putnam, B. (2003). The Sculptor’s Way: A Guide to Modelling and Sculpture. Dover Publications. ISBN 978-0-486-42313-5.
- Pyykkö, P. (1988). «Relativistic effects in structural chemistry». Chemical Reviews. 88 (3): 563–94. doi:10.1021/cr00085a006.
- Rabinowitz, M. B. (1995). «Imputing lead sources from blood lead isotope ratios». In Beard, M. E.; Allen Iske, S. D. (eds.). Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance. ASTM. pp. 63–75. doi:10.1520/stp12967s. ISBN 978-0-8031-1884-3.
- «Radioactive Decay Series» (PDF). Nuclear Systematics. MIT OpenCourseWare. 2012. Retrieved 28 April 2018.
- Ramage, C. K., ed. (1980). Lyman Cast Bullet Handbook (3rd ed.). Lyman Products Corporation.
- Randerson, J. (2002). «Candle pollution». New Scientist (2348). Retrieved 7 April 2007.
- Reddy, A.; Braun, C. L. (2010). «Lead and the Romans». Journal of Chemical Education. 87 (10): 1052–55. Bibcode:2010JChEd..87.1052R. doi:10.1021/ed100631y.
- Retief, F.; Cilliers, L. P. (2006). «Lead poisoning in ancient Rome». Acta Theologica. 26 (2): 147–64 (149–51). doi:10.4314/actat.v26i2.52570.
- Rich, V. (1994). The International Lead Trade. Woodhead Publishing. ISBN 978-0-85709-994-5.
- Rieuwerts, J. (2015). The Elements of Environmental Pollution. Routledge. ISBN 978-0-415-85919-6.
- Riva, M. A.; Lafranconi, A.; d’Orso, M. I.; et al. (2012). «Lead poisoning: Historical aspects of a paradigmatic «occupational and environmental disease»«. Safety and Health at Work. 3 (1): 11–16. doi:10.5491/SHAW.2012.3.1.11. PMC 3430923. PMID 22953225.
- Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. (2009). «The end of nucleosynthesis: Production of lead and thorium in the early galaxy». The Astrophysical Journal. 698 (2): 1963–80. arXiv:0904.3105. Bibcode:2009ApJ…698.1963R. doi:10.1088/0004-637X/698/2/1963. S2CID 14814446.
- Rogalski, A. (2010). Infrared Detectors (2nd ed.). CRC Press. ISBN 978-1-4200-7671-4. Retrieved 19 November 2016.
- Röhr, C. (2017). «Binare Zintl-Phasen» [Binary Zintl Phases]. Intermetallische Phasen [Intermettallic Phases] (in German). Universitat Freiburg. Retrieved 18 February 2017.
- Rudolph, A. M.; Rudolph, C. D.; Hostetter, M. K.; et al. (2003). «Lead». Rudolph’s Pediatrics (21st ed.). McGraw-Hill Professional. p. 369. ISBN 978-0-8385-8285-5.
- Samson, G. W. (1885). The divine law as to wines. J. B. Lippincott & Co.
- Scarborough, J. (1984). «The myth of lead poisoning among the Romans: An essay review». Journal of the History of Medicine and Allied Sciences. 39 (4): 469–475. doi:10.1093/jhmas/39.4.469. PMID 6389691.
- Schoch, R. M. (1996). Case Studies in Environmental Science. West Publishing. ISBN 978-0-314-20397-7.
- Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. (2008). «Endocrine disruptors and abnormalities of pubertal development» (PDF). Basic & Clinical Pharmacology & Toxicology. 102 (2): 168–175. doi:10.1111/j.1742-7843.2007.00180.x. hdl:1854/LU-391408. PMID 18226071.
- Sharma, H. R.; Nozawa, K.; Smerdon, J. A.; et al. (2013). «Templated three-dimensional growth of quasicrystalline lead». Nature Communications. 4: 2715. Bibcode:2013NatCo…4.2715S. doi:10.1038/ncomms3715. PMID 24185350.
- Sharma, H. R.; Smerdon, J. A.; Nugent, P. J.; et al. (2014). «Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb». The Journal of Chemical Physics. 140 (17): 174710. Bibcode:2014JChPh.140q4710S. doi:10.1063/1.4873596. PMID 24811658.
- Silverman, M. S. (1966). «High-pressure (70-k) synthesis of new crystalline lead dichalcogenides». Inorganic Chemistry. 5 (11): 2067–69. doi:10.1021/ic50045a056.
- Singh, P. (2017). «Over 73% of paints found to have excessive lead: Study». Times of India. Retrieved 3 May 2018.
- Sinha, S. P.; Shelly; Sharma, V.; et al. (1993). «Neurotoxic effects of lead exposure among printing press workers». Bulletin of Environmental Contamination and Toxicology. 51 (4): 490–93. doi:10.1007/BF00192162. PMID 8400649. S2CID 26631583.
- Slater, J. C. (1964). «Atomic Radii in Crystals». The Journal of Chemical Physics. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697. ISSN 0021-9606.
- Smirnov, A. Yu.; Borisevich, V. D.; Sulaberidze, A. (2012). «Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials». Theoretical Foundations of Chemical Engineering. 46 (4): 373–78. doi:10.1134/s0040579512040161. S2CID 98821122.
- Sokol, R. C. (2005). «Lead exposure and its effects on the reproductive system». In Golub, M. S. (ed.). Metals, Fertility, and Reproductive Toxicity. CRC Press. pp. 117–53. doi:10.1201/9781420023282.ch6. ISBN 978-0-415-70040-5.
- Stabenow, F.; Saak, W.; Weidenbruch, M. (2003). «Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds». Chemical Communications (18): 2342–2343. doi:10.1039/B305217F. PMID 14518905.
- Stone, R. (1997). «An Element of Stability». Science. 278 (5338): 571–572. Bibcode:1997Sci…278..571S. doi:10.1126/science.278.5338.571. S2CID 117946028.
- Street, A.; Alexander, W. (1998). Metals in the Service of Man (11th ed.). Penguin Books. ISBN 978-0-14-025776-2.
- Szczepanowska, H. M. (2013). Conservation of Cultural Heritage: Key Principles and Approaches. Routledge. ISBN 978-0-415-67474-4.
- Takahashi, K.; Boyd, R. N.; Mathews, G. J.; et al. (1987). «Bound-state beta decay of highly ionized atoms» (PDF). Physical Review C. 36 (4): 1522–1528. Bibcode:1987PhRvC..36.1522T. doi:10.1103/physrevc.36.1522. OCLC 1639677. PMID 9954244. Archived from the original (PDF) on 21 October 2014. Retrieved 27 August 2013.
- Tarragó, A. (2012). «Case Studies in Environmental Medicine (CSEM) Lead Toxicity» (PDF). Agency for Toxic Substances and Disease Registry.
- Tétreault, J.; Sirois, J.; Stamatopoulou, E. (1998). «Studies of lead corrosion in acetic acid environments». Studies in Conservation. 43 (1): 17–32. doi:10.2307/1506633. JSTOR 1506633.
- «Think Lead research summary» (PDF). The Lead Sheet Association. Archived from the original (PDF) on 20 February 2017. Retrieved 20 February 2017.
- Thomson, T. (1830). The History of Chemistry. Henry Colburn and Richard Bentley (publishers). ISBN 9780405066238.
- Thornton, I.; Rautiu, R.; Brush, S. M. (2001). Lead: The Facts (PDF). International Lead Association. ISBN 978-0-9542496-0-1. Retrieved 5 February 2017.
- Thürmer, K.; Williams, E.; Reutt-Robey, J. (2002). «Autocatalytic oxidation of lead crystallite surfaces». Science. 297 (5589): 2033–35. Bibcode:2002Sci…297.2033T. doi:10.1126/science.297.5589.2033. PMID 12242437. S2CID 6166273.
- Tolliday, B. (2014). «Significant growth in lead usage underlines its importance to the global economy». International Lead Association. Archived from the original on 28 February 2017. Retrieved 28 February 2017.
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead-acid batteries
- «Toronto museum explores history of contraceptives». ABC News. 2003. Retrieved 13 February 2016.
- «Toxic Substances Portal – Lead». Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011.
- «Toxicological Profile for Lead» (PDF). Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine. 2007. Archived from the original (PDF) on 1 July 2017.
- «Trace element emission from coal». IEA Clean Coal Centre. 2012. Retrieved 1 March 2017.
- Tuček, K.; Carlsson, J.; Wider, H. (2006). «Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues» (PDF). Nuclear Engineering and Design. 236 (14–16): 1589–98. doi:10.1016/j.nucengdes.2006.04.019.
- Tungate, M. (2011). Branded Beauty: How Marketing Changed the Way We Look. Kogan Page Publishers. ISBN 978-0-7494-6182-9.
- UK Marine SACs Project (1999). «Lead». Water Quality (Report). Retrieved 10 June 2018.
- United Nations Environment Programme (2010). Final review of scientific information on lead (PDF). Chemicals Branch, Division of Technology, Industry and Economics. Retrieved 31 January 2017.
- United States Environmental Protection Agency (2010). «Metallurgical Industry:Secondary Lead Processing». AP 42 Compilation of Air Pollutant Emission Factors (5th ed.). Retrieved 20 May 2018.
- United States Environmental Protection Agency (2000). «Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000)». Retrieved 28 February 2017.
- United States Environmental Protection Agency (2005). «Best Management Practices for Lead at Outdoor Shooting Ranges» (PDF). Retrieved 12 June 2018.
- United States Food and Drug Administration (2015). Q3D Elemental Impurities Guidance for Industry (PDF) (Report). United States Department of Health and Human Services. p. 41. Retrieved 15 February 2017.
- United States Geological Survey (1973). Geological Survey Professional Paper. United States Government Publishing Office. p. 314.
- United States Geological Survey (2005). Lead (PDF) (Report). Retrieved 20 February 2016.
- United States Geological Survey (2017). «Lead» (PDF). Mineral Commodities Summaries. Retrieved 8 May 2017.
- University of California Nuclear Forensic Search Project. «Decay Chains». Nuclear Forensics: A Scientific Search Problem. Retrieved 23 November 2015.
- Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, O. N.; Larin, B. O. (eds.). Этимологический словарь русского языка [Russisches etymologisches Worterbuch] (in Russian) (2nd ed.). Progress. Retrieved 4 March 2017.
- Vogel, N. A.; Achilles, R. (2013). The Preservation and Repair of Historic Stained and Leaded Glass (PDF) (Report). United States Department of the Interior. Retrieved 30 October 2016.
- Waldron, H. A. (1985). «Lead and lead poisoning in antiquity». Medical History. 29 (1): 107–08. doi:10.1017/S0025727300043878. PMC 1139494.
- Wani, A. L.; Ara, A.; Usman, J. A. (2015). «Lead toxicity: A review». Interdisciplinary Toxicology. 8 (2): 55–64. doi:10.1515/intox-2015-0009. PMC 4961898. PMID 27486361.
- Weast, R. C.; Astle, M. J.; Beyer, W. H. (1983). CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data. CRC Press. ISBN 978-0-8493-0464-4.
- «Weatherings to Parapets and Cornices». The Lead Sheet Association. Archived from the original on 20 February 2017. Retrieved 20 February 2017.
- Webb, G. A. (2000). Nuclear Magnetic Resonance. Royal Society of Chemistry. ISBN 978-0-85404-327-9.
- Webb, G. W.; Marsiglio, F.; Hirsch, J. E. (2015). «Superconductivity in the elements, alloys and simple compounds». Physica C: Superconductivity and Its Applications. 514: 17–27. arXiv:1502.04724. Bibcode:2015PhyC..514…17W. doi:10.1016/j.physc.2015.02.037. S2CID 119290828.
- Whitten, K. W.; Gailey, K. D.; David, R. E. (1996). General chemistry with qualitative analysis (3rd ed.). Saunders College. ISBN 978-0-03-012864-6.
- Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- Wilkes, C. E.; Summers, J. W.; Daniels, C. A.; et al. (2005). PVC Handbook. Hanser. ISBN 978-1-56990-379-7.
- Willey, D. G. (1999). «The physics behind four amazing demonstrations — CSI». Skeptical Inquirer. 23 (6). Retrieved 6 September 2016.
- Winder, C. (1993a). «The history of lead — Part 1». LEAD Action News. 2 (1). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 5 February 2016.
- Winder, C. (1993b). «The history of lead — Part 3». LEAD Action News. 2 (3). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 12 February 2016.
- Windholz, M. (1976). Merck Index of Chemicals and Drugs (9th ed.). Merck & Co. ISBN 978-0-911910-26-1. Monograph 8393.
- Wood, J. R.; Hsu, Y-T.; Bell, C. (2021). «Sending Laurion Back to the Future: Bronze Age Silver and the Source of Confusion» (PDF). Internet Archaeology. 56 (9). doi:10.11141/ia.56.9. S2CID 236973111.
- World Health Organization (1995). Environmental Health Criteria 165: Inorganic Lead (Report). Retrieved 10 June 2018.
- World Health Organization (2000). «Lead» (PDF). Air quality guidelines for Europe. Regional Office for Europe. pp. 149–53. ISBN 978-92-890-1358-1. OCLC 475274390.
- World Health Organization (2018). «Lead poisoning and health». Retrieved 17 February 2019.
- World Nuclear Association (2015). «Nuclear Radiation and Health Effects». Retrieved 12 November 2015.
- Wrackmeyer, B.; Horchler, K. (1990). 207Pb-NMR Parameters. Annual Reports on NMR Spectroscopy. Vol. 22. Academic Press. pp. 249–303. doi:10.1016/S0066-4103(08)60257-4. ISBN 978-0-08-058405-8.
- Yong, L.; Hoffmann, S. D.; Fässler, T. F. (2006). «A low-dimensional arrangement of [Pb9]4· clusters in [K(18-crown-6)]2K2Pb9·(en)1.5«. Inorganica Chimica Acta. 359 (15): 4774–78. doi:10.1016/j.ica.2006.04.017.
- Young, S. (2012). «Battling lead contamination, one fish bone at a time». Compass. United States Coast Guard. Archived from the original on 14 June 2013. Retrieved 11 February 2017.
- Yu, L.; Yu, H. (2004). Chinese Coins: Money in History and Society. Long River Press. ISBN 978-1-59265-017-0.
- Zhang, X.; Yang, L.; Li, Y.; et al. (2012). «Impacts of lead/zinc mining and smelting on the environment and human health in China». Environmental Monitoring and Assessment. 184 (4): 2261–73. doi:10.1007/s10661-011-2115-6. PMID 21573711. S2CID 20372810.
- Zhao, F. (2008). Information Technology Entrepreneurship and Innovation. IGI Global. p. 440. ISBN 978-1-59904-902-1.
- Zuckerman, J. J.; Hagen, A. P. (1989). Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. ISBN 978-0-471-18656-4.
- Zweifel, H. (2009). Plastics Additives Handbook. Hanser. ISBN 978-3-446-40801-2.
- Zýka, J. (1966). «Analytical study of the basic properties of lead tetraacetate as oxidizing agent». Pure and Applied Chemistry. 13 (4): 569–81. doi:10.1351/pac196613040569. S2CID 96821219. Retrieved 2 March 2017.
Further reading[edit]
- Astrid, S.; Helmut, S.; Sigel, R. K. O., eds. (2017). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. De Gruyter. ISBN 978-3-11-044107-9. Table of contents
- Casas, J. S.; Sordo, J., eds. (2006). Lead Chemistry, Analytical Aspects. Environmental Impacts and Health Effects. Elsevier. ISBN 978-0-444-52945-9.
External links[edit]
Look up lead in Wiktionary, the free dictionary.
Wikimedia Commons has media related to Lead.
- The Toxicology of Heavy Metals: Getting the Lead Out, American Society for Clinical Pathology
|
|
|
| Название, символ, номер | Свинец / Plumbum (Pb), 82 |
|---|---|
| Атомная масса (молярная масса) |
207,2(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Радиус атома | 175 пм |
| Ковалентный радиус | 147 пм |
| Радиус иона | (+4e) 84 (+2e) 120 пм |
| Электроотрицательность | 2,33 (шкала Полинга) |
| Электродный потенциал | Pb←Pb2+ −0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2, 0 |
| Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
| Плотность (при н. у.) | 11,3415 г/см³ |
| Температура плавления | 600,61 K (327,46 °C, 621,43 °F) |
| Температура кипения | 2022 K (1749 °C, 3180 °F) |
| Уд. теплота плавления | 4,77 кДж/моль |
| Уд. теплота испарения | 177,8 кДж/моль |
| Молярная теплоёмкость | 26,65 Дж/(K·моль) |
| Молярный объём | 18,3 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 Å |
| Температура Дебая | 88,00 K |
| Теплопроводность | (300 K) 35,3 Вт/(м·К) |
| Номер CAS | 7439-92-1 |
Содержание
- 1 Исторические сведения
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 4.1 Производство в мире
- 5 Физические свойства
- 6 Химические свойства
- 7 Основные соединения свинца
- 7.1 Галогениды свинца
- 7.2 Халькогениды свинца
- 7.2.1 Оксиды свинца
- 7.3 Соли свинца
- 8 Изотопы
- 8.1 Распространённость изотопов свинца
- 9 Применение
- 9.1 В медицине
- 9.2 В геологии
- 9.3 Экономические показатели
- 10 Физиологическое действие
Слитки свинца
Исторические сведения
Свинец используется многие тысячелетия, поскольку он широко распространён, легко добывается и обрабатывается. Он очень ковкий и легко плавится. Выплавка свинца была первым из известных человеку металлургических процессов. Бусины из свинца, датируемые 6400 г. до н. э., были найдены в культуре Чатал-Хююк. Самым древним предметом, сделанным из свинца, часто считается статуэтка стоящей женщины в длинной юбке времён первой династии Египта, датируемая 3100—2900 гг. до н. э., хранящаяся в Британском музее (инвентарный номер EA 32138). Она была найдена в храме Осириса в Абидосе и привезена из Египта в 1899 году. В Древнем Египте использовались медальоны из свинца. В раннем бронзовом веке свинец использовался наряду с сурьмой и мышьяком. Указание на свинец как на определённый металл имеется в Ветхом Завете.
Свинцовые трубы древнеримского водопровода с надписями
Самым крупным производителем свинца доиндустриальной эпохи был Древний Рим, с годовым производством 80 000 тонн. Добыча римлянами свинца происходила в Центральной Европе, римской Британии, на Балканах, в Греции, Малой Азии и Испании. Римляне широко применяли свинец в производстве труб для водопроводов, свинцовые трубы часто имели надписи римских императоров. Правда, ещё Плиний и Витрувий считали, что это нехорошо для общественного здоровья.
Папская булла 1637 года со свинцовой печатью
После падения Римской империи в V в. н. э. использование свинца в Европе упало и оставалось на низком уровне около 600 лет. Затем свинец начали добывать в восточной Германии. Свинцовый сахар ещё с римских времён добавляли в вино для улучшения его вкусовых качеств, это стало широко распространено и продолжалось даже после запрета папской буллой в 1498 году. Такое использование свинца в средние века приводило к эпидемиям свинцовой колики. В Древней Руси свинец использовали для покрытия крыш церквей, а также широко применяли в качестве материала навесных печатей к грамотам Позднее, в 1633 году, в Кремле был сооружён водопровод со свинцовыми трубами, вода по которому шла из Водовзводной башни, он просуществовал до 1737 года.
В алхимии свинец ассоциировался с планетой Сатурн и обозначался её символом ♄. В древности олово, свинец и сурьму часто не отличали друг от друга, считая их разными видами одного и того же металла, хотя ещё Плиний Старший различал олово и свинец, называя олово «plumbum album», а свинец — «plumbum nigrum».
Индустриальная революция привела к новому росту потребности в свинце. К началу 1840-х гг. годовое производство очищенного свинца впервые превысило 100 000 тонн и выросло до более чем 250 000 тонн в течение следующих 20 лет. До последних десятилетий XIX века добыча свинца в основном проводилась тремя странами: Британией, Германией и Испанией. К началу XX века добыча свинца в Европе стала меньше, чем в остальном мире, благодаря увеличившейся добыче в США, Канаде, Мексике и Австралии. До 1990 года большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Происхождение названия
Происхождение слова «свинец» неясно. Этот металл по-болгарски называется «оло́во», в большинстве других славянских языков (сербско-хорватском, чешском, польском свинец называется словом, близким по звучанию к «олово»: волава, olovo, ołów и т. п. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в нескольких славянских — русском, украинском (свинець), белорусском (свінец) и словенском (svinec).
Латинское plumbum дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомби, из которой, по некоторым данным, ухитрился бежать Казанова.
Нахождение в природе
Содержание в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу. В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.
Галенит, Дальнегорское скарновое месторождение
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову:
| Породы | Каменные метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Граниты и др. | Глины и др. | Земная кора |
|---|---|---|---|---|---|---|---|
| Содержание, масс.% | 0000002×10−5 | 0001×10−5 | 0008×10−4 | 0001,5×10−3 | 0002×10−3 | 0002×10−3 | 1,6×10−3 |
| Объекты | Живое вещество Земли | Литосфера | Почва0 | Растения (в золе) | Вода океанов (мг/л) |
|---|---|---|---|---|---|
| Содержание, масс.% | 000000005×10−5 | 000,0016 | 00,001 | 000000,001 | 0000000,00003 |
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов.
| Минерал | Свинец (общ) | Уран | Торий |
|---|---|---|---|
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
Получение
Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем возможно несколько способов переработки концентрата в веркблей (черновой свинец): прежде широко распространённый метод шахтной восстановительной плавки, разработанные в СССР метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов (КИВЦЭТ-ЦС), метод плавки Ванюкова (плавка в жидкой ванне). Для плавки в шахтной (ватержакетной) печи предварительно производят агломерационный обжиг концентрата, а затем его загружают в шахтную печь, где происходит восстановление свинца из оксида.
Веркблей, содержащий более 90 процентов свинца, подвергается дальнейшему очищению. Сначала для удаления меди применяют зейгерование и последующую обработку серой. Затем щелочным рафинированием удаляют мышьяк и сурьму. Далее выделяют серебро и золото с помощью цинковой пены и отгоняют цинк. Обработкой кальцием и магнием удаляют висмут. В результате содержание примесей падает до менее чем 0,2 %.
Производство в мире
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG):
| Страна | Количество в метрических килотоннах |
|---|---|
| Евросоюз | 2200 |
| США | 1400 |
| Китай | 1200 |
| Россия | 1100 |
| Южная Корея | 600 |
| Казахстан | 550 |
| Украина | 400 |
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К), при температуре 0 °C. Металл мягкий, режется ножом, легко царапается ногтем. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. Температура плавления — 600,61 K (327,46 °C), кипит при 2022 K (1749 °C). Относится к группе тяжёлых металлов; его плотность — 11,3415 г/см3 (при +20 °C). С повышением температуры плотность свинца падает:
| Температура, °C | Плотность, г/см3 |
|---|---|
| 327,6 | 10,686 |
| 450 | 10,536 |
| 650 | 10,302 |
| 850 | 10,078 |
Предел прочности на растяжение — 12—13 МПа (МН/м2).
При температуре 7,26 К становится сверхпроводником.
Химические свойства
Электронная формула: 5s25p65d106s26p2, энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ. На внешней электронной оболочке находятся 4 неспаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
- Соли двухвалентного свинца реагируют со щелочами, образуя почти нерастворимый гидроксид свинца:
- Pb2+ + 2OH− = Pb(OH)2
- При избытке щёлочи гидроксид растворяется:
- Pb(OH)2 + 2OH− = [Pb(OH)4]2−
- Реагирует со щелочами и кислотами:
- Pb + 2NaOH + 2H2O = Na2[Pb(OH)4] + H2↑
- Pb + 4HNO3 = Pb(NO3)2 + 2NO2↑ + 2H2O
- Pb + 2HCl = PbCl2 + H2↑
Свинец образует комплексные соединения с координационным числом 4, например, [Pb(OH)4]2−
Реакция диспропорционирования между PbO2 и Pb лежит в основе работы свинцовых аккумуляторов.
Основные соединения свинца
Основная статья: Категория:Соединения свинца
Свинец в соединениях может находиться в степенях окисления +2 и +4, образуя соединения Pb(II) и Pb(IV), соответственно. В обеих степенях окисления свинец является амфотерным и может как выступать в роли катионов Pb2+ и Pb4+, так и входить в состав анионов (плюмбита PbO2-
2 с Pb(II) и плюмбатов с Pb(IV): метаплюмбата PbO2-
3 и ортоплюмбата PbO4-
4), в связи с этим может образовывать четыре типа солей.
Галогениды свинца
Свинец образует галогениды в степени окисления +2 вида PbHal2 для всех галогенов. Известны также галогениды свинца(IV): PbF4 и PbCl4, тетрабромиды и тетрайодиды не получены.
- Фторид свинца(II)
- Хлорид свинца(II) — белый кристаллический порошок, растворим в горячей воде. Хорошо растворяется также в растворах других хлоридов, особенно в хлориде аммония NH4Cl.
- Бромид свинца(II)
- Йодид свинца(II)
Халькогениды свинца
Халькогениды свинца — сульфид свинца PbS, селенид свинца(II) PbSe и теллурид свинца PbTe — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Оксиды свинца
Основная статья: Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе. Свинец образует два простых оксида — оксид свинца(II) PbO и оксид свинца(IV) PbO2 — и один смешанный Pb3O4 (свинцовый сурик), фактически являющийся плюмбатом (IV) свинца(II) Pb2PbO4.
Соли свинца
- Сульфат свинца(II) PbSO4
- Нитрат свинца(II) Pb(NO3)2
- Ацетат свинца(II) Pb(CH3COO)2 (свинцовый сахар).
- Хромат свинца(II) PbCrO4
Изотопы
Основная статья: Изотопы свинца
Весь свинец в основном является смесью изотопов 204Pb, 206Pb, 207Pb, 208Pb. Эти изотопы не радиоактивны, то есть стабильны. Свинец — последний элемент в периодической таблице, у которого существуют стабильные изотопы, элементы после свинца стабильных изотопов не имеют (хотя висмут-209 на практике можно считать стабильным, т.к. его период полураспада примерно в миллиард раз больше возраста Вселенной). Изотопы 206Pb, 207Pb, 208Pb являются радиогенными и образуются в результате радиоактивного распада соответственно 238U, 235U и 232Th. Изотоп 208
82Pb126
является одним из пяти существующих в природе дважды магических ядер. Схемы радиоактивного распада имеют вид:
-
- 238U → 206Pb + 84He;
- 235U → 207Pb + 74He;
- 232Th → 208Pb + 64He.
Уравнения распада имеют вид соответственно:
-
- 206Pb =238 U (eλ8t − 1 ),
- 207Pb =235 U (eλ5t − 1 ),
- 208Pb =232 Th(eλ2t − 1 ),
где 238U, 235U, 232Th — современные концентрации изотопов; λ8 = 1,55125 ⋅ 10−10 год−1, λ5 = 9,8485 ⋅ 10−10 год−1, λ2 = 4,9475 ⋅ 10−11 год−1 — постоянные распада атомов соответственно урана 238U, урана 235U и тория 232Th.
Кроме этих изотопов, известны и нестабильные изотопы 194Pb — 203Pb, 205Pb, 209Pb — 214Pb. Из них наиболее долгоживущие — 202Pb и 205Pb (с периодами полураспада 52,5 тысяч и 15,3 млн лет). Короткоживущие изотопы свинца 210Pb (радий D), 211Pb (актиний B), 212Pb (торий B) и 214Pb (радий B) имеют периоды полураспада соответственно 22,2 года, 36,1 мин, 10,64 ч и 26,8 мин (в скобках приведены редко используемые исторические названия этих изотопов); эти четыре радиоактивных изотопа входят в состав радиоактивных рядов урана и тория и, следовательно, также встречаются в природе, хотя и в крайне малых количествах.
Количество ядер изотопа 204Pb (нерадиогенного и нерадиоактивного) является стабильным, в минералах свинца концентрация 204Pb во многом зависит от концентрации радиогенных изотопов, образованных как в процессе распада радиоактивных ядер, так и в процессах вторичного преобразования свинецсодержащих минералов. Поскольку число радиогенных ядер, образовавшихся в результате радиоактивного распада, зависит от времени, то и абсолютные, и относительные концентрации зависят от времени образования минерала. Этим свойством пользуются при определении возраста горных пород и минералов.
Распространённость изотопов свинца
| Изотоп | 204Pb | 206Pb | 207Pb | 208Pb |
|---|---|---|---|---|
| Содержание в природе (в %) | 01,40 | 024,10 | 22,1 | 52,4 |
Свинец, состав которого приведён в таблице, отражает изотопный состав свинца преимущественно в галенитах, в которых урана и тория практически нет, и породах, преимущественно осадочных, в которых количество урана находится в кларковых пределах. В радиоактивных минералах этот состав существенно отличается и зависит от вида радиоактивного элемента, слагающего минерал. В урановых минералах, таких, как уранинит UO2, настуран UO2 (урановая смолка), урановые черни, в которых существенно преобладает уран, радиогенный изотоп 206Pbрад существенно преобладает над другими изотопами свинца, и его концентрации могут достигать 90 %. Например, в урановой смолке (Сан-Сильвер, Франция) концентрация 206Pb равна 92,9 %, в урановой смолке из Шинколобве (Киншаса) — 94,25 %. В ториевых минералах, например, в торите ThSiO4, существенно преобладает радиогенный изотоп 208Pbрад. Так, в монаците из Казахстана концентрация 208Pb равна 94,02 %, в монаците из пегматита Бекета (Зимбабве) — 88,8 %. Имеется комплекс минералов, например, монацит (Ce, La, Nd)[PO4], циркон ZrSiO4 и др., в которых в переменных соотношениях находятся уран и торий и соответственно в разных соотношениях присутствуют все или большинство изотопов свинца. Следует отметить, что в цирконах содержание нерадиогенного свинца крайне мало, что делает их удобным объектом для уран-торий-свинцового метода датирования (цирконометрия).
Свинцовые пульки
Применение
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ.
Азид свинца применяется как наиболее широко употребляемый детонатор (инициирующее взрывчатое вещество).
Перхлорат свинца используется для приготовления тяжёлой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель.
Фторид свинца самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
Висмутат свинца, сульфид свинца PbS, йодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях.
Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока.
Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с. 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников.
Диоксид свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но и также на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве жёлтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Сульфат свинца PbSO4, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Тетраэтилсвинец (C2H5)4Pb до недавнего времени применялся к качестве присадки к бензину для повышения октанового числа.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Свинец издавна применялся для изготовления пуль (а до изобретения огнестрельного оружия — других метательных снарядов, — например, для пращи) благодаря своей высокой плотности и, как следствие, большому импульсу и пробивной способности снаряда.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысяч тонн в 2002 году.
В медицине
Используется для защиты пациентов от излучения рентгеновских аппаратов.
В геологии
Основная статья: Геохронология
Измерение содержания изотопов свинца используется для определения возраста минералов и горных пород в абсолютной геохронологии. Обобщённая сводка геохронологических методов приведена в работе. Уран-торий-свинцовый метод датирования основан на уравнениях распада изотопов урана и тория.
В большинстве природных объектов на Земле одинаково и практически не зависит от вида и интенсивности протекания природных геологических процессов (единственным исключением является природный ядерный реактор в Окло, Габон, Африка).
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл./кг.
Страны, крупнейшие потребители свинца в 2004 году, в тысячах тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Свинцовые грузила
Физиологическое действие
Свинец и его соединения токсичны. Особенно ядовиты водорастворимые, например, ацетат свинца II и летучие, например, тетраэтилсвинец, соединения. Токсичны и пары расплавленного свинца.
При остром отравлении наступают боли в животе, в суставах, судороги, обмороки. Свинец может накапливаться в костях, вызывая их постепенное разрушение, концентрируется в печени и почках.
Особенно опасно воздействие свинца на детей: при длительном воздействии он вызывает умственную отсталость и хронические заболевания мозга.
До принятия многими странами законодательных актов запрета применения тетраэтилсвинца в качестве антидетонационной присадки в моторные топлива, существенное загрязнение окружающей среды свинцом вызывалось выхлопами автомобильных двигателей, так как это металлоорганическое соединение свинца добавлялось в топливо с целью повышения октанового числа — так называемое этилирование бензина. В России этилированный бензин был запрещён с 15 ноября 2002 года.
ПДК соединений свинца в атмосферном воздухе — 0,003 мг/м³, в воде — 0,03 мг/л, почве — 20,0 мг/кг. Выброс свинца в Мировой океан — 430—650 тысяч тонн в год.
Глоссарий. Химия
Свинец
Свине́ц — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение названия
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в восточнославянских — украинском (свинець) и белорусском (свінец).
Латинское plumbum, употребляемое, помимо остальных, Петронием Арбитром дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0 °C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Свинец широко используют для защиты от гамма-излучения, как элемент с большим атомным номером (и следовательно большим количеством электронов на один атом), достаточно распространённый в природе, не радиоактивный.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C (621,32 °F; 600,55 K)
Температура кипения — 1740 °C (3164 °F; 2013,15 K)
Химические свойства
Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки PbO.
С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород.
Оксидам PbO и PbO2 соответствуют амфотерные гидроксиды Pb(ОН)2 и Pb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество PbH4. PbH4 — газообразное вещество без запаха, которое очень легко разлагается на свинец и водород. При большой температуре галогены образовывают со свинцом соединения вида PbX2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа PbX4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Pb(II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb(II). В ряду напряжений свинец стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки труднорастворимых хлорида PbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и HCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[PbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Pb(II). По растворимости в воде соли свинца делятся на нерастворимые (например, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (хлорид и фторид) и растворимые (к примеру, ацетат, нитрат и хлорат свинца). Соли Pb(IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Pb(II). Соли Pb(IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов [PbCl6]2-, гидроксоплюмбатов [Pb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют со свинцом с выделением водорода и гидроксоплюмбитов типа [Pb(ОН)4 X2].
Потенциал ионизации Еион=7,42 эВ.
Источник: Википедия
Другие заметки по химии
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Свине́ц / Plumbum (Pb), 82 |
||
| Атомная масса (молярная масса) |
207,2 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[Xe] 4f14 5d10 6s2 6p2 |
||
| Радиус атома |
175 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
147 пм |
||
| Радиус иона |
(+4e) 84 (+2e) 120 пм |
||
| Электроотрицательность |
1,8 (шкала Полинга) |
||
| Электродный потенциал |
Pb←Pb2+ −0,126 В |
||
| Степени окисления |
4, 2, 0 |
||
| Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
11,3415[1] г/см³ |
||
| Температура плавления |
600,65 K (327,5 °C) |
||
| Температура кипения |
2 013 К (1740 °C) |
||
| Теплота плавления |
4,77 кДж/моль |
||
| Теплота испарения |
177,8 кДж/моль |
||
| Молярная теплоёмкость |
26,65[1] Дж/(K·моль) |
||
| Молярный объём |
18,3 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
кубическая гранецентрированая |
||
| Параметры решётки |
4,950 Å |
||
| Температура Дебая |
88,00 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) 35,3 Вт/(м·К) |
Свине́ц — элемент 14-й группы (по устаревшей классификации — главной подгруппы IV группы), шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Содержание
- 1 Исторические сведения
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 7 Основные соединения свинца
- 7.1 Оксиды свинца
- 7.2 Галогениды свинца
- 7.3 Халькогениды свинца
- 7.4 Соли свинца
- 8 Изотопный состав
- 8.1 Распространённость изотопов свинца
- 9 Применение
- 9.1 В народном хозяйстве
- 9.2 В медицине
- 9.3 В геологии
- 9.4 Экономические показатели
- 10 Физиологическое действие
- 11 Ссылки
- 12 Литература
Исторические сведения
Происхождение названия
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском, дореформенном белорусском (тарашкевица)[2][3]) свинец называется словом, близким по звучанию к «олово» (волава, olovo, ołów и т.п.). Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в нескольких славянских — русском, украинском (свинець), официальном белорусском («наркомовка») (свінец) и словенском (svinec).
Латинское plumbum, дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива[4].
Нахождение в природе
Содержание в земной коре 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу. В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы.
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову[5]:
| Породы | Каменные метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Граниты и др. | Глины и др. | Земная кора |
|---|---|---|---|---|---|---|---|
| Содержание, вес.% | 0000002×10−5 | 0001×10−5 | 0008×10−4 | 0001,5×10−3 | 0002×10−3 | 0002×10−3 | 1,6×10−3 |
| Объекты | Живое вещество Земли | Литосфера | Почва0 | Растения (в золе) | Вода океанов (мг/л) |
|---|---|---|---|---|---|
| Содержание, вес.% | 000000005×10−5 | 000,0016 | 00,001 | 000000,001 | 0000000,00003 |
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов[6].
| Минерал | Свинец (общ) | Уран | Торий |
|---|---|---|---|
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
Получение
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс.тонн:
| ЕС | 2200 |
| США | 1498 |
| Китай | 1256 |
| Корея | 219 |
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К), при температуре 0 °C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Температура плавления: 327,4 °C
Температура кипения: 1740 °C
Химические свойства
Электронная формула: KLMN5s²5p65d106s²6p², энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ.
Основные соединения свинца
Основная статья: :Категория:Соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основной или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
- Сульфат свинца
- Нитрат свинца
- Ацетат свинца — свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом[7].
Изотопный состав
Весь свинец в основном является смесью изотопов 204Pb, 206Pb, 207Pb, 208Pb. Эти изотопы не радиоактивны, то есть стабильны, но изотопы 206Pb, 207Pb, 208Pb являются радиогенными и образуются в результате радиоактивного распада соответственно 238U, 235U и 232Th. Схемы радиоактивного распада имеют вид:
-
- 238U → 206Pb + 84He;
- 235U → 207Pb + 74He;
- 232Th → 208Pb + 64He.
Уравнения распада имеют вид соответственно:
где 238U, 235U, 232Th — современные концентрации изотопов; 


Кроме этих изотопов известны и нестабильные изотопы 194Pb — 203Pb, 205Pb, 209Pb — 214Pb. Из них наиболее долгоживущие — 202Pb и 205Pb (с периодами полураспада 52,5 тысяч и 15,3 млн лет). Короткоживущие изотопы свинца 210Pb (радий D), 211Pb (актиний B), 212Pb (торий B) и 214Pb (радий B) имеют периоды полураспада соответственно 22,2 года, 36,1 мин, 10,64 ч и 26,8 мин (в скобках приведены редко используемые исторические названия этих изотопов); эти четыре радиоактивных изотопа входят в состав радиоактивных рядов урана и тория и, следовательно, также встречаются в природе, хотя и в крайне малых количествах[9].
Количество ядер изотопа 204Pb (нерадиогенного и нерадиоактивного) является стабильным, в минералах свинца концентрация 204Pb во многом зависит от концентрации радиогенных изотопов, образованных как в процессе распада радиоактивных ядер, так и в процессах вторичного преобразования свинецсодержащих минералов. Поскольку число радиогенных ядер, образовавшихся в результате радиоактивного распада, зависит от времени, то и абсолютные, и относительные концентрации зависят от времени образования минерала. Этим свойством пользуются при определении возраста горных пород и минералов[10].
Распространённость изотопов свинца
| Изотоп | 204Pb | 206Pb | 207Pb | 208Pb |
|---|---|---|---|---|
| Содержание в природе (в %) [11] | 01,40 | 024,10 | 22,1 | 52,4 |
Свинец, состав которого приведён в таблице, отражает изотопный состав свинца преимущественно в галенитах, в которых урана и тория практически нет, и породах, преимущественно осадочных, в которых количество урана находится в кларковых пределах. В радиоактивных минералах этот состав существенно отличается и зависит от вида радиоактивного элемента, слагающего минерал. В урановых минералах, таких как уранинит UO2, настуран UO2 (урановая смолка), урановые черни, в которых существенно преобладает уран, радиогенный изотоп 206Pbрад существенно преобладает над другими изотопами свинца и его концентрации могут достигать 90 %. Например, в урановой смолке (Сан-Сильвер, Франция) концентрация 206Pb равна 92,9 %, в урановой смолке из Шинколобве (Киншаса) — 94,25 %[5]. В ториевых минералах, например, в торите ThSiO4, существенно преобладает радиогенный изотоп 208Pbрад, в монаците из Казахстана концентрация 208Pb равна 94,02 %, в монаците из пегматита Бекета (Зимбабве) — 88,8 %[5]. Имеется комплекс минералов, например, монацит CeSiO4, циркон ZrSiO4 и др., в которых в переменных соотношениях находятся уран и торий и соответственно в разных соотношениях присутствуют все или большинство изотопов свинца. Следует отметить, что в цирконах содержание нерадиогенного свинца крайне мало, что делает их удобным объектом для уран-торий-свинцового метода датирования (цирконометрия).
Применение
В народном хозяйстве
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ.
Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество).
Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях.
Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока.
Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников.
Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2·H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Сульфат свинца PbSO4, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
В медицине
В геологии
Измерение содержания изотопов свинца используется для определения возраста минералов и горных пород в абсолютной геохронологии. Обобщённая сводка геохронологических методов приведена в работе[10]. Уран-торий-свинцовый метод датирования основан на уравнениях (1) распада изотопов урана и тория (см. подраздел Изотопный состав). Достаточно широко применяется комбинация этих уравнений; так, для урана:
Следует отметить, что современное изотопное отношение 
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м³, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
Ссылки
| Свинец на Викискладе? |
- Свинец на Webelements
- Свинец в Популярной библиотеке химических элементов
- Химия на сайте РХТУ
- Свойства свинца
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
Литература
- ↑ 1 2 Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т.. — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 300. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8
- ↑ Свид—Свис // Падручны расійска-крыўскі (беларускі) слоўнік / Укладальнік: Вацлаў Ластоўскі. — Коўна: Міністэрства Беларускіх Спраў у Літве, 1924.
- ↑ Волава // Беларуска-расійскі слоўнік / Укладальнікі: М. Байкоў, С. Некрашэвіч. — Менск: Дзяржаўнае выдавецтва Беларусі, 1925. Факсімільнае выданьне: Менск: Народная асвета, 1993. ISBN 5-341-00918-5.
- ↑ Химия. Справочник Дидин, Аликберова
- ↑ 1 2 3 Войткевич Г. В., Мирошников А. Е., Поваренных А. С., Прохоров В. Г. Краткий справочник по геохимии. — М.: Недра, 1970.
- ↑ Макаров В. П. Некоторые методологические проблемы геохронологии. Мат-лы XI научного семинара «Система планета Земля». М.: РОО «Гармония строения Земли и планет». 2003, С.71- 95.
- ↑ Свинец [1]
- ↑ 1 2 Известия АН СССР, сер. Геологическая, 1978, № 11, с. 148.
- ↑ Титаева Н. А. Ядерная геохимия. М.: Изд-во МГУ, 2000.
- ↑ 1 2 Шуколюков Ю. А. и др. Графические методы изотопной геологии. М.: Наука, 1976.
- ↑ Atomic weights of the elements. Review 2000 (IUPAC Technical Report). Pure Appl. Chem. Vol. 75, No. 6, pp. 683-800, (2003).
Свинец — простое вещество, металл, элемент таблицы Менделеева. Обозначается Pb 
Скорее всего, свинец был первым металлом, который научились выплавлять люди. Это объясняется тем, что он широко распространен, легко плавится и обрабатывается, устойчив к коррозии. Долгое время свинец не отличали от олова и сурьмы, считая все эти вещества разновидностями одного металла. Первые известные изделия из свинца датируются шестым веком до нашей эры. Свинцовые белила применяли в качестве красок и лекарств уже в Древней Греции и Риме. В Древнем Риме свинец выплавлялся десятками тысяч тонн, он шел на изготовление водопроводов. Свинцовыми листами в древности покрывали днища кораблей, а выпаривая в свинцовых котлах виноградный сок, получали подсластитель для пищи.
Свинец широко распространен в земной коре, хотя в самородном виде практически не встречается. Является частью полиметаллических руд, входит в состав более чем 80 минералов. Промышленное значение имеют галенит, церуссит, англезит. Свинец часто сопутствует урановым, медно-никелиевым, цинковым рудам, соседствует с сурьмой и мышьяком, встречается в золоторудных месторождениях.
Свойства

Химически довольно инертен, чаще всего проявляет валентность +2 и +4. В сухом воздухе не вступает в реакцию с кислородом, во влажном — окисляется, образуя на поверхности пленку, препятствующую дальнейшему окислению.
Образует целый ряд оксидов.
С водой в обычных условиях не взаимодействует.
Проявляет амфотерные свойства, реагирует с кислотами и щелочами. Вступает в реакции с концентрированными соляной и серной, разбавленными азотной, уксусной, муравьиной, винной, лимонной кислотами, концентрированными щелочами. Устойчив к воздействию разбавленных щелочей, нашатырного спирта (водного раствора аммиака), фтористоводородной и большинства органических кислот.
Взаимодействует с галогенами, серой, селеном, теллуром.
Образует гидроксиды свинца (II) и (IV).
Это интересно
Одной из причин заката Великой Римской империи ученые называют свинцовые 
Исследователи, изучающие жизнь и творчество Бетховена, выдвинули гипотезу, что он умер от отравления свинцом, полученным из лекарств, которые ему прописывал врач.
Отравление свинцом, попавшим в пищу в результате неправильно запаянных консервных банок, считают одной из причин гибели английской полярной экспедиции Джона Франклина в 1847-м году.
Химики, историки и лингвисты до сих пор не могут определить происхождение русского названия «свинец».
В следующей статье мы расскажем об опасности свинца и о том, как он применяется.
Содержание
Свинец

Физические свойства
Атомные свойства
Атом свинца имеет 82 электрона, расположенных в электронной конфигурации [Xe] 4f145d106s26p2. Объединенная первая и вторая энергии ионизации – полная энергия, необходимая для удаления двух 6p электронов – близка к энергии олова, верхнего соседа свинца в углеродной группе. Это необычно; энергии ионизации обычно идут вниз по группе, так как внешние электроны элемента становятся более отдаленными от ядра и более экранированы меньшими орбиталями. Сходство энергий ионизации обусловлено сокращением лантанидов – уменьшением радиусов элементов из лантана (атомный номер 57) до лютеция (71) и относительно малыми радиусами элементов после гафния (72). Это связано с плохим экранированием ядра электронами лантанида. Объединенные первые четыре энергии ионизации свинца превышают объёмы олова 1), вопреки предсказаниям периодических тенденций. Релятивистские эффекты, которые становятся значительными в более тяжелых атомах, способствуют такому поведению. Одним из таких эффектов является эффект инертной пары: электроны 6s свинца неохотно участвуют в связывании, делая расстояние между ближайшими атомами в кристаллическом свинце необычайно длинными 2).
Более легкие углеродные группы свинца образуют стабильные или метастабильные аллотропы с тетраэдрически координированной и ковалентно связанной алмазной кубической структурой. Энергетические уровни их внешних s- и p-орбиталей достаточно близки, чтобы позволить смешивать их с четырьмя гибридными sp3-орбиталями. В свинце, эффект инертных пар увеличивает расстояние между его s- и p-орбиталями, и разрыв не может быть преодолен энергией, которая будет высвобождаться дополнительными связями после гибридизации. В отличие от алмазной кубической структуры, свинец образует металлические связи, в которых только p-электроны делокализуются и разделяются между ионами Pb2 +. Следовательно, свинец имеет гранецентрированную кубическую структуру, такую как двухвалентные металлы одинакового размера, кальций и стронций. 3)
Большие объемы
Чистый свинец имеет яркий серебристый цвет с оттенком синего. Он тускнеет при контакте с влажным воздухом, и его оттенок зависит от преобладающих условий. Характерные свойства свинца включают высокую плотность, пластичность и высокую устойчивость к коррозии (из-за пассивации). 4)
Плотная кубическая структура и высокий атомный вес свинца приводит к плотности 11,34 г / см3, что больше, чем у обычных металлов, таких как железо (7,87 г / см3), медь (8,93 г / см3) и цинк (7,14 г / см3).
Некоторые более редкие металлы имеют большую плотность: вольфрам и золото – 19,3 г / см3, а осмий – самый плотный металл – имеет плотность 22,59 г / см3, что почти в два раза больше, чем у свинца 5).
Свинец – очень мягкий металл с твердостью по Моосу 1,5; его можно поцарапать ногтем. Он довольно ковкий и в некотором смысле пластичный. Объемный модуль свинца – мера его легкости сжимаемости – составляет 45,8 ГПа. Для сравнения, объемный модуль алюминия составляет 75,2 ГПа; меди – 137,8 ГПа; а мягкой стали – 160-169 ГПа. Прочность на растяжение при 12-17 МПа низка (у алюминия в 6 раз выше, у меди – в 10 раз, а у мягкой стали – в 15 раз); её можно усилить добавлением небольшого количества меди или сурьмы.
Точка плавления свинца – 327,5 ° C (621,5 ° F) 6) – является низкой по сравнению с большинством металлов. Его температура кипения составляет 1749 °C (3180 °F) и является самой низкой среди элементов углеродной группы. Электросопротивление свинца при 20 °С составляет 192 нанометра, что почти на порядок выше, чем у других промышленных металлов (медь при 15,43 nΩ·m, золото 20,51 nΩ·m и алюминий при 24,15 nΩ·m). Свинец представляет собой сверхпроводник при температурах ниже 7,19 К, это самая высокая критическая температура всех сверхпроводников I типа. Свинец является третьим по величине элементным сверхпроводником.
Изотопы свинца
Естественный свинец состоит из четырех устойчивых изотопов с массовым числом 204, 206, 207 и 208, и следов пяти короткоживущих радиоизотопов 7). Большое количество изотопов согласуется с тем, что число атомов свинца является четным. Свинец имеет магическое число протонов (82), для которых модель ядерной оболочки точно предсказывает особенно стабильное ядро. Свинец-208 имеет 126 нейтронов, другое магическое число, которое может объяснить, почему свинец-208 необычайно устойчив. Учитывая его высокий атомный номер, свинец является самым тяжелым элементом, естественные изотопы которого считаются стабильными. Это звание ранее принадлежало висмуту, имеющему атомный номер 83, до тех пор, пока в 2003 году не было обнаружено, что его единственный изначальный изотоп, висмут-209, очень медленно распадается. Четыре стабильных изотопа свинца теоретически могли пройти альфа-распад на изотопы ртути с высвобождением энергии, но это нигде не наблюдалось, их предсказанные периоды полураспада варьируются от 1035 до 10189 лет. Три стабильных изотопа встречаются в трех из четырех основных цепей распада: свинец-206, свинец-207 и свинец-208 являются конечными продуктами распада урана-238, урана-235 и тория-232 соответственно; эти цепочки распада называются сериями урана, сериями актиния и сериями тория. Их изотопная концентрация в образце природной породы очень зависит от наличия этих трех родительских изотопов урана и тория. Например, относительное обилие свинца-208 может варьироваться от 52% в нормальных образцах до 90% в ториевых рудах, поэтому стандартная атомная масса свинца дается только в одном знаке после запятой 
Химия
Большой объем свинца, подвергнутый воздействию влажного воздуха, образует защитный слой различного состава. Сульфит или хлорид также могут присутствовать в городских или морских условиях. Этот слой делает большой объем свинца эффективно химически инертным в воздухе. Мелкопорошковый свинец, как и многие металлы, является пирофорным и горит голубовато-белым пламенем 9).
Фтор вступает в реакцию со свинцом при комнатной температуре, образуя фторид свинца (II). Реакция с хлором аналогична, но требует нагревания, так как полученный хлоридный слой уменьшает реакционную способность элементов. Расплавленный свинец реагирует с халькогенами с образованием халькогенидов свинца (II).
Металл свинца не подвергается воздействию разбавленной серной кислоты, а растворяется в концентрированной форме. Он медленно реагирует с соляной кислотой и энергично – с азотной кислотой с образованием оксидов азота и нитрата свинца (II) 10). Органические кислоты, такие как уксусная кислота, растворяют свинец в присутствии кислорода. Концентрированные щелочи растворяют свинец и формируют плюмбиты.
Неорганические соединения
Свинец имеет два основных состояния окисления: +4 и +2. Четырехвалентное состояние является общим для углеродной группы. Двухвалентное состояние редко встречается для углерода и кремния, незначительно для германия, важно (но не преобладающее) для олова, и более важно для свинца. 11) Это объясняется релятивистскими эффектами, в частности, эффектом инертных пар, который проявляется, когда наблюдается большая разница в электроотрицательности между свинцовыми и оксидными, галогенидными или нитридными анионами, что приводит к значительным частичным положительным зарядам свинца. В результате наблюдается более сильное сжатие 6s-орбитали свинца, чем 6p-орбитали, что делает свинец весьма инертным в ионных соединениях. Это менее применимо к соединениям, в которых свинец образует ковалентные связи с элементами аналогичной электроотрицательности, такими как углерод в органолептических соединениях. В таких соединениях, 6s и 6p-орбитали имеют одинаковый размер, и sp3-гибридизация все еще энергетически выгодна. Свинец, как и углерод, преимущественно четырехвалентный в таких соединениях.
Относительно большая разница в электроотрицательности свинца (II) при 1,87 и свинца (IV) составляет 2,33. Эта разница подчеркивает обратную тенденцию повышения устойчивости состояния окисления +4 с понижением концентрации углерода; олово, для сравнения, имеет значения 1,80 в состоянии окисления +2 и 1,96 в состоянии +4.
Свинец (II)
Соединения свинца (II) характерны для неорганической химии свинца. Даже сильные окислители, такие как фтор и хлор, реагируют со свинцом при комнатной температуре, образуя только PbF2 и PbCl2 12). Большинство из них менее ионны, чем соединения других металлов, и поэтому они в значительной степени нерастворимы. Ионы свинца (II) обычно бесцветны в растворе и частично гидролизуются с образованием Pb (OH)+ и, наконец, Pb4 (OH) 4 (в котором гидроксильные ионы действуют как мостиковые лиганды). В отличие от ионов олова (II), они не являются восстанавливающими агентами. Методы идентификации присутствия иона Pb2+ в воде обычно полагаются на осаждение хлорида свинца (II) с использованием разбавленной соляной кислоты. Поскольку хлоридная соль немного растворима в воде, затем предпринимается попытка осаждения сульфида свинца (II) путем барботирования сероводорода через раствор.
Моноксид свинца существует в двух полиморфах: красный α-PbO и желтый β-PbO, последний стабилен только при температуре выше 488 °C. Это наиболее часто используемое соединение свинца. Гидроокись свинца (II) может существовать только в растворе; известно, что она образует плюмбитные анионы. Свинец обычно реагирует с более тяжелыми халькогенами. Сульфид свинца представляет собой полупроводник, фотопроводник и чрезвычайно чувствительный детектор инфракрасного излучения. Другие два халькогенида, селенид свинца и теллурид свинца, также являются фотопроводниками. Они необычны тем, что их цвет становится тем светлее, чем ниже группа.
Дигалиды свинца хорошо описаны; они включают диастатид 13) и смешанные галогениды, такие как PbFCl. Относительная нерастворимость последних является полезной основой для гравиметрического определения фтора. Дифторид был первым твердым ионопроводящим соединением, которое было обнаружено (в 1834 году Майклом Фарадеем). Другие дигалогениды разлагаются при воздействии ультрафиолетового или видимого света, особенно дийодид. Известно много псевдогалогенидов свинца. Свинец (II) образует большое количество галогенидных координационных комплексов, таких как [PbCl4] 2-, [PbCl6] 4- и анион [Pb2Cl9] n5n-цепи.
Сульфат свинца (II) нерастворим в воде, как и сульфаты других тяжелых двухвалентных катионов. Нитрат свинца (II) и ацетат свинца (II) являются очень растворимыми, и это используется при синтезе других соединений свинца 14).
Свинец (IV)
Известно несколько неорганических соединений свинца (IV), и они обычно являются сильными окислителями или существуют только в сильнокислотных растворах 15). Оксид свинца (II) дает смешанный оксид при дальнейшем окислении, Pb3O4. Он описывается как оксид свинца (II, IV) или структурно 2PbO·PbO2 и является наиболее известным смешанным валентным соединением свинца. Двуокись свинца является сильным окислителем, способным окислять хлористоводородную кислоту до газообразного хлора. Это связано с тем, что ожидаемый PbCl4, который будет производиться, нестабилен и спонтанно разлагается до PbCl2 и Cl2. Аналогично монооксиду свинца, диоксид свинца способен образовывать вспененные анионы. Дисульфид свинца и диселенид свинца устойчивы при высоких давлениях. Тетрафторид свинца, желтый кристаллический порошок, стабилен, но в меньшей степени, чем дифторид. Тетрахлорид свинца (желтое масло) разлагается при комнатной температуре, тетрабромид свинца еще менее стабилен, а существование тетрайодида свинца оспаривается.
Другие состояния окисления
Некоторые соединения свинца существуют в формальных состояниях окисления, отличных от +4 или +2. Свинец (III) может быть получен в качестве промежуточного соединения между свинцом (II) и свинцом (IV) в более крупных органолептических комплексах; это состояние окисления нестабильно, так как и ион свинца (III), и более крупные комплексы, содержащие его, являются радикалами. 16) То же самое относится и к свинцу (I), который можно найти в таких видах. Известны многочисленные смешанные оксиды свинца (II, IV). Когда PbO2 нагревается на воздухе, он становится Pb12O19 при 293 °C, Pb12O17 при 351 °C, Pb3O4 при 374 °C и, наконец, PbO при 605 °C. Еще один полуторный оксид Pb2O3 может быть получен при высоком давлении наряду с несколькими нестехиометрическими фазами. Многие из них показывают дефектные структуры флюорита, в которых некоторые атомы кислорода заменяются пустотами: PbO можно рассматривать как имеющий такую структуру, причем каждый альтернативный слой атомов кислорода отсутствует. Отрицательные состояния окисления могут возникать как фазы Цинтля, как либо в случае Ba2Pb, причем свинец формально представляет собой свинец (-IV), или как в случае чувствительных к кислороду кольцеобразных или полиэдрических кластерных ионов, таких как тригональный бипирамидный ион Pb52-i, где два свинцовых атома – свинец (- I), а три – свинец (0). В таких анионах, каждый атом находится на полиэдральной вершине и вносит два электрона в каждую ковалентную связь по краю от их sp3-гибридных орбиталей, а остальные два являются внешней одиночной парой. Они могут быть сформированы в жидком аммиаке путем восстановления свинца натрием.
Свинецорганическое соединение
Свинец может образовывать многосвязные цепи, и это свойство он разделяет с более легким своим гомологом, углеродом. Его способность к этому намного меньше, потому что энергия связи Pb-Pb в три с половиной раза ниже, чем у C-C-связи. Сам с собой, свинец может строить металло-металлические связи до третьего порядка. 17) С углеродом, свинец формирует свинецорганические соединения, сходные с, но обычно менее стабильные, чем типичные органические соединения (из-за слабости связи Pb-C). Это делает металлоорганическую химию свинца гораздо менее широкой, чем у олова. Свинец преимущественно образует органические соединения (IV), даже если это образование начинается с неорганических реагентов свинца (II); известно очень мало соединений органолата (II). Наиболее хорошо охарактеризованными исключениями являются Pb [CH (SiMe3)2]2 и Pb (η5-C5H5)2. 18) Свинцовый аналог простейшего органического соединения, метан, является плюмбаном. Плюмбан может быть получен в реакции между металлическим свинцом и атомарным водородом. Два простых производных, тетраметиладин и тетраэтилэлид, являются наиболее известными свинецорганическими соединениями. Эти соединения являются относительно стабильными: тетраэтилэлид начинает разлагаться только при 100 °С или при воздействии солнечного света или ультрафиолетового излучения. (Тетрафенилсвинец еще более термически устойчив, разлагаясь при 270 °C). С натрием-металлом, свинец легко образует эквимолярный сплав, который реагирует с алкилгалогенидами с образованием металлоорганических соединений, таких как тетраэтилэлид. Окислительная природа многих органоорганических соединений также используется: тетраацетат свинца является важным лабораторным реагентом для окисления в органической химии, а тетраэтилэлид производился в больших количествах, чем любое другое металлоорганическое соединение 19). Другие органические соединения менее химически стабильны. Для многих органических соединений не существует свинцового аналога.
Происхождение и распространенность
В космосе
Распространенность свинца на частицу в Солнечной системе составляет 0,121 чнм (частей на миллиард). 20) Эта цифра в два с половиной раза выше, чем у платины, в восемь раз выше, чем у ртути, и в 17 раз выше, чем у золота. Количество свинца во Вселенной медленно увеличивается, поскольку самые тяжелые атомы (все из которых нестабильны) постепенно распадаются на свинец. Обилие свинца в Солнечной системе с момента её образования 4,5 миллиарда лет назад увеличилось примерно на 0,75%. Таблица численности изотопов солнечной системы показывает, что свинец, несмотря на его относительно высокий атомный номер, более распространен, чем большинство других элементов с атомными числами больше 40. Изначальный свинец, который содержит изотопы свинца-204, свинца-206, свинца-207 и свинца-208-, в основном, были созданы в результате повторяющихся процессов захвата нейтронов, происходящих в звездах. Двумя основными режимами захвата являются s- и r-процессы. В s-процессе (s означает «медленный»), захваты разделяются годами или десятилетиями, позволяя менее стабильным ядрам проходить бета-распад. Устойчивое ядро таллия-203 может захватить нейтрон и стать таллием-204; это вещество подвергается бета-распаду, давая стабильный свинец-204; при захвате другого нейтрона, он становится свинцом-205, период полураспада которого составляет около 15 миллионов лет. Дальнейшие захваты приводят к образованию свинца-206, свинца-207 и свинца-208. При захвате другого нейтрона, свинец-208 становится свинцом-209, который быстро распадается на висмут-209. При захвате другого нейтрона, висмут-209 становится висмутом-210, бета которого распадается на полоний-210, а альфа распадается на свинец-206. Цикл, следовательно, заканчивается у свинца-206, свинца-207, свинца-208 и висмута-209. 21)
В r-процессе (r означает «быстрый»), захваты бывают быстрее, чем ядра могут распадаться. Это происходит в средах с высокой плотностью нейтронов, таких как сверхновая или слияние двух нейтронных звезд. Поток нейтронов может быть порядка 1022 нейтронов на квадратный сантиметр в секунду. R-процесс не формирует столько же свинца, сколько s-процесс. Он имеет тенденцию останавливаться, как только нейтрон-богатые ядра достигают 126 нейтронов. В этот момент, нейтроны располагаются в полных оболочках в атомном ядре, и становится сложнее энергетически вместить большее их количество. Когда поток нейтронов спадает, их бета-ядра распадаются на стабильные изотопы осмия, иридия и платины.
На Земле
Свинец классифицируется как халькофил по классификации Гольдшмидта, что означает, что он обычно встречается в сочетании с серой. Он редко встречается в своей естественной металлической форме. 22) Многие минералы свинца относительно легки и, в течение истории Земли, остались в коре, а не погружались глубже в недра Земли. Это объясняет относительно высокий уровень содержания свинца в коре, 14 чнм; это 38-й наиболее распространенный элемент в коре. Основным свинцовым минералом является галенит (PbS), который, в основном, содержится в цинковых рудах. Большинство других минералов свинца в какой-то мере связаны с галенитом; буланжерит, Pb5Sb4S11, представляет собой смешанный сульфид, полученный из галенита; англезит, PbSO4, является продуктом окисления галенита; а серусит или белая свинцовая руда, PbCO3, является продуктом разложения галенита. Мышьяк, олово, сурьма, серебро, золото, медь и висмут являются распространенными примесями в свинцовых минералах.
Мировые ресурсы свинца превышают 2 миллиарда тонн. Значительные запасы свинца были обнаружены в Австралии, Китае, Ирландии, Мексике, Перу, Португалии, России и США. Глобальные резервы – ресурсы, которые экономически целесообразно добывать – в 2015 году составили 89 млн. тонн, 35 млн из которых находятся в Австралии, 15,8 млн – в Китае, и 9,2 млн. – в России. 23) Типичные фоновые концентрации свинца не превышают 0,1 мкг / м3 в атмосфере; 100 мг / кг в почве; и 5 мкг / л в пресной воде и морской воде.
Этимология
Современное английское слово «lead» (свинец) имеет германское происхождение; оно происходит из среднеанглийского и староанглийского языка (со знаком долготы над гласным «е», означающим, что гласный звук этой буквы длинный). Староанглийское слово происходит от гипотетического реконструированного протогерманского *lauda- («lead»). Согласно принятой лингвистической теории, это слово «родило» потомков на нескольких германских языках с точно таким же значением. Происхождение протогерманского *lauda не однозначно в лингвистическом сообществе. Согласно одной из гипотез, это слово является производным от протоиндоевропейского *lAudh- («свинец»). [98] Согласно другой гипотезе, это слово заимствовано из прото-кельтского * ɸloud-io- («свинец»). Это слово связано с латинским plumbum, который давал этому элементу химический символ Pb. Слово *ɸloud-io- также может быть источником протогерманского *bliwa- (что также означает «свинец»), из которого вытекает немецкое Blei. Название химического элемента не связано с глаголом такого же написания, полученного из протогерманского *layijan- («to lead»). 24)
История
Предыстория и ранняя история
Металлические свинцовые бусины, относящиеся к 7000-6500 г. до н.э., найденные в Малой Азии, могут представлять собой первый пример плавки металлов. В то время, у свинца было несколько применений (если вообще было) из-за его мягкости и блеклого внешнего вида. Основной причиной распространения производства свинца была его связь с серебром, которое может быть получено путем сжигания галенита (общего свинцового минерала). Древние египтяне первыми использовали свинец в косметике, что распространилось на Древнюю Грецию и за ее пределы. 25) Египтяне, возможно, использовали свинец в качестве грузила в рыболовных сетях, а также при изготовлении глазури, очков, эмали и украшений. Различные цивилизации Плодородного Полумесяца использовали свинец в качестве письменного материала, как валюту и в строительстве. Свинец использовался в древнекитайском королевском дворе в качестве стимулятора, в качестве валюты и в качестве противозачаточного средства. В цивилизации долины Инда и у мезоамериканцев, свинец использовался для изготовления амулетов; восточные и южноафриканские народы использовали свинец при волочении проволоки.
Классическая эпоха
Поскольку серебро широко использовалось в качестве декоративного материала и средства обмена, свинцовые отложения стали обрабатываться в Малой Азии с 3000 г. до н.э.; позже месторождения свинца были разработаны в Эгейском и Лорионском районах. Эти три региона, в совокупности, доминировали в производстве добытого свинца до приблизительно 1200 г. до н.э. С 2000 года до н.э., финикийцы работали на месторождениях на Иберийском полуострове; к 1600 г. до н.э. добыча свинца существовала на Кипре, в Греции и на Сицилии 26).
Территориальная экспансия Рима в Европе и Средиземноморье, а также развитие горной промышленности привели к тому, что эта область стала крупнейшим производителем свинца в классическую эпоху, при этом ежегодный объем производства достиг 80000 тонн. Как и их предшественники, римляне получали свинец, главным образом, как побочный продукт плавки серебра. Ведущими добытчиками были Центральная Европа, Британия, Балканы, Греция, Анатолия и Испания, на долю которых приходится 40% мирового производства свинца.
Свинец использовался для изготовления водопроводных труб в Римской империи; латинское слово, обозначающее этот металл, plumbum, является источником английского слова «plumbing» (сантехника). Легкость в обращении с данным металлом и его устойчивость к коррозии обеспечили его широкое применение в других областях, включая фармацевтические препараты, кровельные материалы, валюту и военное обеспечение. 27) Писатели того времени, такие как Катон-старший, Колумелла и Плиний Старший, рекомендовали свинцовые сосуды для приготовления подсластителей и консервантов, добавленных к вину и пище. Свинец давал приятный вкус из-за образования «сахара свинца» (ацетат свинца (II), тогда как медные или бронзовые сосуды могли придать пище горький вкус из-за образования вердигров.
Этот металл был, безусловно, наиболее распространенным материалом в классической древности, и уместно сослаться на (римскую) Свинцовую Эру. Свинец для римлян находился в столь же широком употреблении, как для нас пластик.
Римский автор Витрувий сообщил об опасностях, которые свинец может представлять для здоровья, и современные авторы предположили, что отравление свинцом сыграло важную роль в упадке Римской империи. [l] Другие исследователи критиковали такие утверждения, указывая, например, что не все боли в животе были вызваны отравлением свинцом. 28) Согласно археологическим исследованиям, римские свинцовые трубы увеличили уровни свинца в водопроводной воде, но такой эффект «вряд ли был бы действительно вредным». Жертв отравления свинцом стали называть «сатурнинами», в честь страшного отца богов Сатурна. По ассоциации с этим, свинец считался «отцом» всех металлов. Его статус в римском обществе был низким, поскольку он был легко доступенным и дешевым.
Путаница с оловом и сурьмой
В классическую эпоху (и даже до XVII века), олово часто не отличали от свинца: римляне называли свинец plumbum nigrum («черный свинец»), а олово – plumbum candidum («светлый свинец»). Связь свинца и олова можно проследить и в других языках: слово «olovo» на чешском языке означает «свинец», но на русском языке родственное олово означает «олово». Кроме этого, свинец имеет близкое отношение к сурьме: оба элемента обычно встречаются в виде сульфидов (галена и стибнит), часто вместе. Плиний неправильно написал, что стибнит дает при нагревании свинец вместо сурьмы.
В таких странах, как Турция и Индия, первоначально персидское название сурьмы относилось к сульфиду сурьмы или сульфиду свинца, а на некоторых языках, таких как русский, называлось сурьмой. 29)
Средние века и Ренессанс
Добыча свинца в Западной Европе сократилась после падения Западной Римской империи, причем Аравийская Иберия была единственным регионом, имеющим значительный выход свинца. Наибольшее производство свинца наблюдалось в Южной и Восточной Азии, особенно в Китае и Индии, где добыча свинца сильно увеличивалась.
В Европе, производство свинца начало возрождаться только в 11 и 12 веках, где свинец снова начал использоваться для кладки кровли и трубопроводов. Начиная с 13-го века, свинец использовался для создания витражей. В европейских и арабских традициях алхимии, свинец (символ Сатурна в европейской традиции) считался нечистым базовым металлом, который путем разделения, очистки и балансировки его составных частей мог быть преобразован в чистое золото. В течение этого периода, свинец все чаще использовался для загрязнения вина. Использование такого вина было запрещено в 1498 году приказом Папы, поскольку оно считалось непригодным для использования в священных обрядах, но его продолжали пить, что приводило к массовым отравлениям вплоть до конца 18-го века. Свинец был ключевым материалом в частях печатного станка, который был изобретен около 1440 года; печатные рабочие обычно вдыхали свинцовую пыль, что вызывало отравления свинцом. 30) Огнестрельное оружие было изобретено примерно в то же время, и свинец, несмотря на то, что был дороже железа, стал основным материалом для изготовления пуль. Он был менее опасен для железных орудийных стволов, имел более высокую плотность (что способствовало лучшему удержанию скорости), а его более низкая точка плавления упрощала производство пуль, поскольку они могли быть изготовлены с использованием древесного огня. Свинец, в виде венецианской керамики, широко использовался в косметических средствах среди западноевропейской аристократии, поскольку отбеленные лица считались признаком скромности [105]. Эта практика позже расширилась до белых париков и карандашей для глаз и исчезла только во время французской революции, в конце 18 века. Подобная мода появилась в Японии в XVIII веке с появлением гейш, практика, которая продолжалась в течение 20-го века. «Белые лица воплощали добродетель японских женщин», при этом в качестве отбеливателя обычно использовался свинец. 31)
За пределами Европы и Азии
В Новом Свете, свинец стал производиться вскоре после прибытия европейских поселенцев. Самое раннее зарегистрированное производство свинца датируется 1621 годом в английской колонии Вирджиния, спустя четырнадцать лет после её основания. В Австралии, первая шахта, открытая колонистами на континенте, была ведущей шахтой в 1841 году. 32) В Африке, добыча и плавка свинца были известны в Бенуэ-Тауре и нижнем бассейне Конго, где свинец использовался для торговли с европейцами и в качестве валюты к 17 веку, задолго до борьбы за Африку.
Промышленная революция
Во второй половине 18 века, в Британии, а затем и в континентальной Европе и Соединенных Штатах, произошла индустриальная революция. Это был первый случай, когда темпы производства свинца где-либо в мире превысили темпы производства свинца в Риме [101]. Британия была ведущим производителем свинца, однако, она потеряла этот статус к середине 19-го века с истощением своих шахт и с развитием добычи свинца в Германии, Испании и Соединенных Штатах. 33) К 1900 году, Соединенные Штаты были лидерами мирового производства свинца, а другие неевропейские страны – Канада, Мексика и Австралия – начали значительное производство свинца; производство за пределами Европы увеличилось. Значительная доля спроса на свинец приходилась на водопровод и краски – свинцовые краски тогда регулярно использовались. В это время больше людей (рабочий класс) контактировали с металлами и увеличивались случаи отравления свинцом. Это привело к исследованию влияния потребления свинца на организм. Свинец оказался более опасным в своей дымовой форме, чем твердый металл. Была обнаружена связь между отравлением свинцом и подагрой; британский врач Альфред Баринг Гаррод отметил, что треть его пациентов с подагрой были водопроводчиками и художниками. Последствия постоянного попадания свинца в организм, включая психические расстройства, также изучались в XIX веке. Первые законы, направленные на снижение случаев отравления свинцом на фабриках, были введены в действие в 1870-х и 1880-х годах в Соединенном Королевстве. 34)
Новое время
Дальнейшие свидетельства угрозы, которая связана со свинцом, были обнаружены в конце 19-го и начале 20-го веков. Механизмы вреда были лучше поняты, а также была задокументирована свинцовая слепота. Страны Европы и США приступили к усилиям по сокращению количества свинца, с которым люди вступали в контакт. В 1878 году Соединенное Королевство ввело обязательные обследования на фабриках и назначило первого медицинского инспектора заводов в 1898 году; в результате сообщалось о 25-кратном сокращении случаев отравления свинцом с 1900 по 1944 годы. Последним основным воздействием свинца на человека было добавление тетраэтилового эфира к бензину в качестве антидетонационного вещества, практика, которая появилась в Соединенных Штатах в 1921 году. Она была постепенно прекращена в Соединенных Штатах и Европейском союзе к 2000 году. Большинство европейских стран запретили свинцовую краску, обычно используемую из-за ее непрозрачности и водонепроницаемости 35) для украшения интерьеров к 1930 году. Воздействие было значительным: в последней четверти 20-го века процент людей с избыточным уровнем свинца в крови снизился с более чем трех четвертей населения Соединенных Штатов до немногим более двух процентов. Основным продуктом из свинца к концу 20-го века была свинцово-аккумуляторная батарея, которая не представляла непосредственной угрозы для человека. С 1960 по 1990 годы производство свинца в Западном блоке выросло на треть. Доля мирового производства свинца в Восточном блоке увеличилась втрое с 10% до 30% с 1950 по 1990 годы, когда Советский Союз был крупнейшим в мире производителем свинца в середине 1970-х и 1980-х годов, а Китай начал обширное производство свинца в конце 20-го века. 36) В отличие от европейских коммунистических стран, в середине 20-го века Китай был, в основном, неиндустриализированой страной; в 2004 году Китай превзошел Австралию как крупнейшего производителя свинца. Как и в случае европейской индустриализации, свинец негативно сказался на здоровье в Китае.
Производство
Производство свинца увеличивается во всем мире из-за его использования в свинцово-аккумуляторных батареях. Существуют две основные категории продукции: первичные, из руд; и вторичные, от лома. В 2014 году, из первичной продукции было произведено 4,58 млн. тонн свинца, а из вторичной – 5,64 млн. тонн. В этом году, тройку ведущих производителей добытого свинцового концентрата возглавили Китай, Австралия и Соединенные Штаты. Тройку производителей рафинированного свинца возглавили Китай, США и Южная Корея.
Согласно докладу Международной ассоциации экспертов по металлам, сделанном в 2010 году, общий объем использования свинца, накопленный, выброшенный или рассеянный в окружающую среду на глобальном уровне на душу населения, составляет 8 кг. Значительная часть из этого объема приходится на более развитые страны (20-150 кг на душу населения), а не на менее развитые страны (1-4 кг на душу населения). Производственные процессы для первичного и вторичного свинца аналогичны. Некоторые первичные производственные заводы в настоящее время дополняют свою деятельность листами свинца, и эта тенденция, вероятно, будет увеличиваться в будущем. При адекватных методах производства, вторичный свинец неотличим от первичного свинца. Отходы металлолома от строительной торговли обычно довольно чисты и повторно расплавляются без необходимости плавки, хотя иногда требуется перегонка. Таким образом, производство вторичного свинца является более дешевым с точки зрения энергетических потребностей, чем производство первичного свинца, часто на 50% и более. 37)
Основное
Большинство свинцовых руд содержат низкий процент свинца (богатые руды имеют типичное содержание свинца 3-8%), который должен быть сконцентрирован для извлечения. Во время первоначальной обработки, руды обычно подвергаются дроблению, отделению плотных сред, шлифованию, пенной флотации и сушке. Полученный концентрат с содержанием свинца 30-80% по массе (обычно 50-60%) затем превращается в (нечистый) свинцовый металл. Существует два основных способа сделать это: двухступенчатый процесс, включающий обжиг с последующим извлечением из доменной печи, осуществляемый в отдельных сосудах; или прямой процесс, в котором экстракция концентрата происходит в одном сосуде. Последний способ стал более распространенным, хотя первый по-прежнему значителен. 38)
Двухстадийный процесс
Во-первых, сульфидный концентрат обжаривается на воздухе для окисления сульфида свинца: 2 PbS + 3 O2 → 2 PbO + 2 SO2 ↑ Первоначальный концентрат не был чистым сульфидом свинца, и обжиг дает оксид свинца и смесь сульфатов и силикатов свинца и других металлов, содержащихся в руде. Этот неочищенный оксид свинца восстанавливается в коксовой печи до (опять же нечистого) металла: 39) 2 PbO + C → Pb + CO2 ↑. Примеси, в основном, представляют собой мышьяк, сурьму, висмут, цинк, медь, серебро и золото. Расплав обрабатывают в реверберационной печи воздухом, паром и серой, которая окисляет примеси, за исключением серебра, золота и висмута. Окисленные загрязняющие вещества плавают в верхней части расплава и снимаются. Металлическое серебро и золото удаляются и извлекаются экономически с помощью процесса Паркса, в который цинк добавляется к свинцу. Цинк растворяет серебро и золото, оба из которых, не смешиваясь в свинце, могут быть разделены и извлечены. Обессеребрянный свинец освобождается висмутом методом Беттертона-Кролла, обрабатывая его металлическим кальцием и магнием. Полученные висмутсодержащие шлаки могут быть сняты. Очень чистый свинец может быть получен путем электролитической обработки плавленого свинца с использованием процесса Беттса. Аноды нечистого свинца и катоды чистого свинца помещают в электролит фторосиликата свинца (PbSiF6). После применения электрического потенциала, нечистый свинец на аноде растворяется и накладываются на катод, оставляя подавляющее большинство примесей в растворе. 40)
Прямой процесс
В этом процессе, свинцовый слиток и шлак получают непосредственно из свинцовых концентратов. Сульфидный концентрат свинца расплавляется в печи и окисляется, образуя монооксид свинца. Углерод (кокс или угольный газ) добавляется к расплавленному заряду вместе с флюсами. Таким образом, монооксид свинца восстанавливается до металлического свинца в середине шлака, богатого монооксидом свинца. До 80% свинца в высококонцентрированных исходных концентратах можно получить в виде слитков; остальные 20% образуют шлак, богатый монооксидом свинца. Для низкосортного сырья, весь свинец может быть окислен до высокосортного шлака. 41) Металлический свинец далее получают из высокосортных (25-40%) шлаков с помощью сжигания или впрыскивания с подводным топливом, с помощью вспомогательной электропечи или комбинации обоих методов.
Альтернативы
Продолжаются исследования более чистого и менее энергоемкого процесса добычи свинца; основным его недостатком является то, что либо слишком много свинца теряется в качестве отходов, либо альтернативные методы приводят к высокому содержанию серы в полученном свинцовом металле. Гидрометаллургическая экстракция, в которой аноды нечистого свинца погружены в электролит, и чистый свинец осаждаются на катод, является методом, который может иметь потенциал.
Вторичный метод
Плавление, являющееся неотъемлемой частью первичной продукции, часто пропускается во время вторичного производства. Это происходит только тогда, когда металлический свинец подвергся значительному окислению. Этот процесс аналогичен процессу первичной добычи в доменной печи или роторной печи, причем существенным отличием является большая изменчивость выходов. Процесс выплавки свинца – это более современный метод, который может выступать в качестве продолжения первичной продукции; аккумуляторная паста из отработанных свинцово-аккумуляторных батарей удаляет серу, обрабатывая ее щелочью, и затем обрабатывается в печи с угольным топливом в присутствии кислорода, что приводит к образованию нечистого свинца, причем сурьма является наиболее распространенной примесью. 42) Переработка вторичного свинца аналогична переработке первичного свинца; Некоторые процессы очистки могут быть пропущены в зависимости от переработанного материала и его потенциального загрязнения, причем висмут и серебро чаще всего принимаются в качестве примесей. Из источников свинца для утилизации, свинцово-аккумуляторные батареи являются наиболее важными источниками; свинцовая труба, лист и оболочка кабеля также являются значительными.
Применения
Вопреки распространенному мнению, графит в деревянных карандашах никогда не делался из свинца. Когда карандаш был создан как инструмент для намотки графита, конкретный тип используемого графита был назван plumbago (в буквальном смысле – для свинца или свинцового макета). 43)
Элементарная форма
Металл свинца имеет несколько полезных механических свойств, включая высокую плотность, низкую температуру плавления, пластичность и относительную инертность. Многие металлы превосходят свинец в некоторых из этих аспектов, но, как правило, они менее распространены и их труднее извлекать из руд. Токсичность свинца привела к поэтапному отказу от некоторых видов его использования. Свинец использовался для изготовления пуль с момента их изобретения в средние века. Свинец недорог; его низкая температура плавления означает, что стрелковые боеприпасы могут быть отлиты с минимальным использованием технического оборудования; кроме того, свинец плотнее других обычных металлов, что позволяет лучше удерживать скорость. Были высказаны опасения, что свинцовые пули, используемые для охоты, могут нанести вред окружающей среде. Его высокая плотность и устойчивость к коррозии были использованы в ряде связанных применений. Свинец используется в качестве киля на кораблях. Его вес позволяет ему уравновешивать эффект взвода ветра на парусах; будучи настолько плотным, он занимает небольшой объем и минимизирует водостойкость. Свинец используется при подводных погружениях, чтобы противостоять способности дайвера держаться на поверхности. В 1993 году, базу Пизанской башни в Пизе стабилизировали с помощью 600 тонн свинца. Из-за своей коррозионной стойкости, свинец используется как защитная оболочка для подводных кабелей. Свинец используется в архитектуре. Листы свинца используются в качестве кровельных материалов, при облицовке, оплавлении, при изготовлении водосточных желобов и соединений водосточных труб, а также парапетов на крыше. Свинцовые молдинги используются в качестве декоративного материала для фиксации свинцовых листов. Свинец все еще используется при изготовлении статуй и скульптур. 44) В прошлом, свинец часто использовался для балансировки колес автомобилей; по экологическим причинам, это использование постепенно прекращается. Свинец добавляется к медным сплавам, таким как латунь и бронза, для улучшения их обрабатываемости и смазочных свойств. Будучи практически нерастворимым в меди, свинец образует твердые глобулы в несовершенствах по всему сплаву, такие как границы зерен. В низких концентрациях, а также в качестве смазки, глобулы препятствуют образованию стружки при работе сплава, тем самым улучшая обрабатываемость. В подшипниках используются медные сплавы с большей концентрацией свинца. Свинец обеспечивает смазку, а медь обеспечивает несущую опору. Благодаря своей высокой плотности, атомному номеру и формуемости, свинец используется в качестве барьера, поглощающего звук, вибрацию и излучение. Свинец не имеет естественных резонансных частот, в результате, лист свинца используется в качестве звукоизоляционного слоя в стенах, полах и потолках звуковых студий. 45) Органические трубы часто изготавливаются из свинцового сплава, смешанного с различными количествами олова, чтобы контролировать тон каждой трубы. Свинец – это защитный материал, используемый от излучения в ядерной науке и в рентгеновских камерах: гамма-лучи поглощаются электронами. Атомы свинца плотно упакованы и плотность их электронов велика; большой атомный номер означает, что на атом приходится много электронов. Расплавленный свинец использовался в качестве охлаждающей жидкости для быстрых реакторов со свинцовым охлаждением. Наибольшее использование свинца наблюдалось в начале XXI века в свинцово-аккумуляторных батареях. Реакции в батарее между свинцом, диоксидом свинца и серной кислотой обеспечивают надежный источник напряжения. Свинец в батареях не подвергается непосредственному контакту с людьми, поэтому связан с меньшей угрозой токсичности. Суперконденсаторы, содержащие свинцово-аккумуляторные батареи, были установлены в киловаттах и мегаваттах в Австралии, Японии и США в области частотного регулирования, сглаживания солнечной энергии и для других применений. 46) Эти батареи имеют более низкую плотность энергии и эффективность разряда заряда, чем литий-ионные батареи, но значительно дешевле. Свинец используется в высоковольтных силовых кабелях в качестве материала оболочки для предотвращения диффузии воды при теплоизоляции; такое использование уменьшается по мере постепенного прекращения использования свинца. В некоторых странах также сокращается использование свинца в припоях для электроники, чтобы уменьшить количество экологически опасных отходов. Свинец является одним из трех металлов, используемых в тесте Одди для музейных материалов, помогая обнаружить органические кислоты, альдегиды и кислые газы. 47)
Соединения
Соединения свинца используются в качестве или в составе красящих агентов, окислителей, пластика, свечей, стекла и полупроводников. Красители на основе свинца используются в керамической глазури и стекле, особенно для красных и желтых оттенков. В качестве окислителей в органической химии используют тетраацетат свинца и диоксид свинца. Свинец часто используется в поливинилхлоридных покрытиях электрических шнуров. Его можно использовать для обработки свечных фитилей, чтобы обеспечить более продолжительное, более равномерное сжигание. Из-за токсичности свинца, европейские и североамериканские производители используют такие альтернативы, как цинк. 48) Стекло свинца состоит из 12-28% оксида свинца. Он изменяет оптические характеристики стекла и уменьшает передачу ионизирующего излучения. Свинцовые полупроводники, такие как теллурид свинца, селенид свинца и антимонид свинца, используются в фотогальванических элементах и инфракрасных детекторах.
Биологические и экологические эффекты
Биологические эффекты
Свинец не имеет подтвержденной биологической роли. Его распространенность в организме человека, в среднем, составляет 120 мг у взрослого человека – его распространенность превосходит только цинк (2500 мг) и железо (4000 мг) среди тяжелых металлов. Соли свинца очень эффективно поглощаются телом. 49) Небольшое количество свинца (1%) будет храниться в костях; остальное будет выводиться с мочой и фекалиями в течение нескольких недель после воздействия. Ребенок будет способен выводить из организма только около трети свинца. Постоянное воздействие свинца может привести к биоаккумуляции свинца.
Токсичность
Свинец – чрезвычайно ядовитый металл (при вдыхании или проглатывании), затрагивающий почти каждый орган и систему в организме человека. При уровне в воздухе 100 мг / м3, он представляет собой немедленную опасность для жизни и здоровья. Свинец быстро всасывается в кровоток. Основной причиной его токсичности является его склонность вмешиваться в правильное функционирование ферментов. Он делает это путем связывания с сульфгидрильными группами, обнаруженными на многих ферментах, или имитирует и вытесняет другие металлы, которые действуют как кофакторы во многих ферментативных реакциях.
Среди основных металлов, с которыми взаимодействует свинец, находятся кальций, железо и цинк. 50) Высокие уровни кальция и железа, как правило, обеспечивают некоторую защиту от отравления свинцом; низкие уровни вызывают повышенную восприимчивость.
Эффекты
Свинец может нанести серьезный ущерб мозгу и почкам и, в конечном счете, привести к смерти. Как и кальций, свинец может пересекать гематоэнцефалический барьер. Он разрушает миелиновые оболочки нейронов, уменьшает их количество, препятствует пути нейротрансмиссии и уменьшает рост нейронов.
Симптомы отравления свинцом включают нефропатию, коликовые боли в животе и, возможно, слабость в пальцах, запястьях или лодыжках. Малое кровяное давление увеличивается, особенно у людей среднего и старшего возраста, что может вызывать анемию. У беременных женщин, высокий уровень воздействия свинца может вызывать выкидыш. Было показано, что хроническое воздействие высоких уровней свинца снижает фертильность у мужчин. В развивающемся мозге ребенка, свинец препятствует образованию синапсов в коре головного мозга, нейрохимическому развитию (в том числе нейротрансмиттеров) и организации ионных каналов. Раннее воздействие свинца на детей связано с повышенным риском нарушений сна и чрезмерной дневной сонливости в более позднем детском возрасте. Высокий уровень свинца в крови связан с задержкой полового созревания у девочек. 51) Увеличение и снижение воздействия переносимого по воздуху свинца от сжигания тетраэтилсвинца в бензине в течение 20-го века связано с историческим ростом и снижением уровня преступности, однако, эта гипотеза не является общепринятой.
Лечение
Лечение отравления свинцом обычно включает введение димеркапрола и сукцимера. Острые случаи могут потребовать использования динатрия кальция эдетата, хелата кальция динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТК). Свинец имеет большее сродство к свинцу, чем кальций, в результате чего хелат свинца образуется путем обмена и выводится с мочой, оставляя безвредный кальций.
Источники воздействия
Воздействие свинца является глобальной проблемой, поскольку добыча и плавка свинца распространены во многих странах мира. Отравление свинцом обычно происходит в результате приема пищи или воды, зараженной свинцом, и реже – в результате случайного попадания в организм загрязненной почвы, пыли или краски на основе свинца. Продукты морской воды могут содержать свинец, если вода подвергается воздействию промышленных вод. Плоды и овощи могут быть заражены высоким содержанием свинца в почвах, в которых они выращивались. Почва может быть загрязнена путем накопления твердых частиц из свинца в трубах, свинцовой краске и остаточных выбросов из этилированного бензина. 52)
Использование свинца в водопроводных трубах проблематично в районах с мягкой или кислой водой. Твердая вода образует нерастворимые слои в трубах, тогда как мягкая и кислая вода растворяет свинцовые трубы. Растворенный диоксид углерода в перевозимой воде может привести к образованию растворимого бикарбоната свинца; кислородсодержащая вода может аналогичным образом растворять свинец в виде гидроксида свинца (II). Питьевая вода со временем может вызывать проблемы со здоровьем из-за токсичности растворенного свинца. Чем тверже вода, тем больше она будет содержать бикарбоната и сульфата кальция, и тем больше внутренняя часть труб будет покрыта защитным слоем карбоната свинца или сульфата свинца.
Проглатывание свинцовой краски является основным источником воздействия свинца на детей. По мере того как краска разрушается, она отслаивается, измельчается в пыль, а затем поступает в организм через контакт с руками или загрязненную пищу, воду или спирт. Проглатывание некоторых народных средств может привести к воздействию свинца или его соединений. Вдыхание – это второй важный путь воздействия свинца, в том числе для курящих, и особенно для работников, занятых свинцом. Сигаретный дым содержит, среди других токсичных веществ, радиоактивный свинец-210. [239] Почти весь вдыхаемый свинец всасывается в тело; для приема внутрь, показатель составляет 20-70%, при этом дети поглощают больше свинца, чем взрослые. 53)
Кожное воздействие может быть значительным для узкой категории людей, работающих с органическими соединениями свинца. Скорость поглощения свинца в коже ниже для неорганического свинца.
Экология
Добыча, производство, использование и утилизация свинца и его продуктов вызвали значительное загрязнение почв и вод Земли. Атмосферные выбросы свинца находились на пике во время промышленной революции, а бензиновый период свинца был во второй половине двадцатого века. Повышенные концентрации свинца сохраняются в почвах и отложениях в постиндустриальных и городских районах; промышленные выбросы, в том числе, связанные со сжиганием угля, продолжаются во многих частях мира. 54)
Свинец может накапливаться в почвах, особенно с высоким содержанием органических веществ, где он сохраняется в течение от сотен до тысяч лет. Он может занять место других металлов в растениях и может накапливаться на их поверхностях, тем самым замедляя процесс фотосинтеза и предотвращая их рост или убивая их. Загрязнение почв и растений влияет на микроорганизмы и на животных. Пострадавшие животные имеют уменьшенную способность синтезировать эритроциты, что вызывает анемию. Аналитические методы определения свинца в окружающей среде включают спектрофотометрию, рентгеновскую флуоресценцию, атомную спектроскопию и электрохимические методы. Конкретный ион-селективный электрод был разработан на основе ионофора S, S'-метиленбиса (N, N-диизобутилдитиокарбамат).
Ограничение и восстановление
К середине 1980-х годов произошел значительный сдвиг в использовании свинца. В Соединенных Штатах, природоохранные правила сокращают или исключают использование свинца в не-аккумуляторных продуктах, включая бензин, краски, припои и системы водоснабжения. Устройства для контроля твердых частиц могут использоваться на угольных электростанциях для сбора выбросов свинца. Использование свинца еще более ограничено Директивой Европейского союза об ограничении использования опасных веществ. 55) Использование свинцовых пуль для охоты и спортивной стрельбы было запрещено в Нидерландах в 1993 году, что привело к значительному сокращению выбросов свинца с 230 тонн в 1990 году до 47,5 тонн в 1995 году. В Соединенных Штатах Америки, Администрация профессиональной безопасности и здоровья установила допустимый предел воздействия свинца на рабочем месте на уровне 0,05 мг / м3 в течение 8-часового рабочего дня; это относится к металлическому свинцу, неорганическим свинцовым соединениям и свинцовым мылам. Национальный институт безопасности и гигиены труда США рекомендует, чтобы концентрации свинца в крови находились ниже 0,06 мг на 100 г крови. Свинец может все еще встречаться во вредных количествах в керамике, виниле (используемом для прокладки труб и изоляции электрических шнуров) и китайской латуни. В старых домах, все еще может содержаться свинцовая краска. Белая свинцовая краска была выведена из продажи в промышленно развитых странах, но желтый хромат свинца все ещё остается в употреблении. Удаление старой краски путем шлифования дает пыль, которую человек может вдыхать. 56) Некоторые ведомства уполномочены осуществлять программы по борьбе со свинцовым загрязнением зданий, в которых живут маленькие дети. Отходы свинца, в зависимости от юрисдикции и характера отходов, могут рассматриваться как бытовые отходы (в целях содействия мероприятиям по борьбе со свинцовым загрязнением), или как потенциально опасные отходы, требующие специальной обработки или хранения. Были проведены исследования по удалению свинца из биосистем биологическими способами. Рыбные кости изучаются относительно их способности к биовосстановлению свинца в загрязненной почве. Гриб Aspergillus versicolor эффективен при удалении ионов свинца. 57) Было исследовано несколько бактерий относительно их способности удалять свинец из окружающей среды, включая сульфат-восстанавливающие бактерии Desulfovibrio и Desulfotomaculum, обе из которых являются высокоэффективными в водных растворах.
:Tags
Список использованной литературы:
1)
Lide 2004, p. 10-179.Lide, D. R., ed. (2004). CRC Handbook of Chemistry and Physics (84th ed.). CRC Press. ISBN 978-0-8493-0484-2.
2)
Pyykko, P. (1988). «Relativistic effects in structural chemistry». Chemical Reviews. 88 (3): 563–94. doi:10.1021/cr00085a006
3)
Christensen, N. E. (2002). «Relativistic Solid State Theory». In Schwerdtfeger, P. Relativistic Electronic Structure Theory — Fundamentals. Elsevier. pp. 867–68. ISBN 978-0-08-054046-7.
4)
Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth Heinemann. ISBN 0-7506-3365-4.
5)
Lide, D. R., ed. (2004). CRC Handbook of Chemistry and Physics (84th ed.). CRC Press. ISBN 978-0-8493-0484-2.
6)
Koshal, D. (2014). Manufacturing Engineer's Reference Book. Butterworth-Heinemann. ISBN 978-0-08-052395-8.
7)
«Shell Model of Nucleus». hyperphysics.phy-astr.gsu.edu. Georgia State University. Retrieved 12 April 2017.

Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth Heinemann. ISBN 0-7506-3365-4.
9)
Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. (2015). Hamilton and Hardy's Industrial Toxicology. John Wiley & Sons. ISBN 978-0-470-92973-5.
10)
Polyanskiy, N. G. (1986). Fillipova, N. A, ed. Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead] (in Russian). Nauka.
11)
Kaupp, M. (2014). «Chemical bonding of main-group elements». In Frenking, G.; Shaik, S. The Chemical Bond: Chemical Bonding Across the Periodic Table (PDF). John Wiley & Sons. doi:10.1002/9783527664658.ch1
12)
Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth Heinemann. ISBN 0-7506-3365-4.
13)
Zuckerman, J. J.; Hagen, A. P. (1989). Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. ISBN 978-0-471-18656-4.
14)
Polyanskiy, N. G. (1986). Fillipova, N. A, ed. Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead] (in Russian). Nauka.
15)
Macintyre, J. E. (1992). Dictionary of Inorganic Compounds. CRC Press. ISBN 978-0-412-30120-9.
16)
Konu, J.; Chivers, T. (2011). «Stable Radicals of the Heavy p-Block Elements». In Hicks, R. Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons. ISBN 978-1-119-95696-9.
17)
Stabenow, F.; Saak, W.; Weidenbruch, M. (2003). «Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds». Chemical Communications (18): 2342. doi:10.1039/B305217F
18)
Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
19)
Zýka, J. (1966). «Analytical study of the basic properties of lead tetraacetate as oxidizing agent». Pure and Applied Chemistry. 13 (4): 569–81. doi:10.1351/pac196613040569. Retrieved 2 March 2017.
20)
Lodders, K. (2003). «Solar System abundances and condensation temperatures of the elements». The Astrophysical Journal. 591 (2): 1220–47. Bibcode:2003ApJ…591.1220L. ISSN 0004-637X. doi:10.1086/375492
21)
Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. (1957). «Synthesis of the Elements in Stars» (PDF). Reviews of Modern Physics. 29 (4): 547–654. Bibcode:1957RvMP…29..547B. doi:10.1103/RevModPhys.29.547
22)
Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). «Lead». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a15_193.pub3
23)
United States Geological Survey (2016). Lead (PDF) (Report). Retrieved 20 February 2016.
24)
Kroonen, G. (2013). Etymological Dictionary of Proto-Germanic. Leiden Indo-European Etymological Dictionary Series. Brill. ISBN 978-90-04-18340-7.
25)
«A History of Cosmetics from Ancient Times». Cosmetics Info. Retrieved 18 July 2016.
26)
United States Geological Survey (2005). Lead (PDF) (Report). Retrieved 20 February 2016.
27)
Retief, F.; Cilliers, L. P. (2006). «Lead poisoning in ancient Rome». Acta Theologica. 26 (2): 147–64 (149–51). doi:10.4314/actat.v26i2.52570
28)
Waldron, H. A. (1985). «Lead and lead poisoning in antiquity». Medical History. 29 (1): 107–08. ISSN 0025-7273. PMC 1139494
29)
Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, O. N.; Larin, B. O., eds. Этимологический словарь русского языка [Russisches etymologisches Wörterbuch] (in Russian) (2nd ed.). Progress. Retrieved 4 March 2017.
30)
Sinha, S. P.; Shelly; Sharma, V.; et al. (1993). «Neurotoxic effects of lead exposure among printing press workers». Bulletin of Environmental Contamination and Toxicology. 51 (4). doi:10.1007/BF00192162
31)
Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. (1998). «Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period». Journal of Occupational Health. 40: 55–60. doi:10.1539/joh.40.55
32)
Gill, T.; Libraries Board of South Australia (1974). The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia.
33)
«Lead mining». The Northern Echo. Retrieved 16 February 2016.
34)
Riva, M. A.; Lafranconi, A.; d'Orso, M. I.; et al. (2012). «Lead poisoning: Historical aspects of a paradigmatic «occupational and environmental disease»». Safety and Health at Work. 3 (1): 11–16. PMC 3430923 Freely accessible. PMID 22953225. doi:10.5491/SHAW.2012.3.1.11
35)
«Why use lead in paint?». Chemistry World. Royal Society of Chemistry. Retrieved 22 February 2017.
36)
Rich, V. (1994). The International Lead Trade. Woodhead Publishing. ISBN 978-0-85709-994-5.
37)
Thornton, I.; Rautiu, R.; Brush, S. M. (2001). Lead: The Facts (PDF). International Lead Association. ISBN 978-0-9542496-0-1. Retrieved 5 February 2017.
38)
Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). «Lead». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a15_193.pub3
39)
«Primary Extraction of Lead Technical Notes». LDA International. Archived from the original on 22 March 2007. Retrieved 7 April 2007.
40)
Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). «Lead». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a15_193.pub3
41)
Street, A.; Alexander, W. (1998). Metals in the Service of Man. Penguin Books. ISBN 978-0-14-025776-2.
42)
Evans, J. W. (1908). «V.— The meanings and synonyms of plumbago». Transactions of the Philological Society. 26 (2): 133–79. doi:10.1111/j.1467-968X.1908.tb00513.x
43)
Baird, C.; Cann, N. (2012). Environmental Chemistry (5th ed.). W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
44)
Putnam, B. (2003). The Sculptor's Way: A Guide to Modelling and Sculpture. Dover Publications. ISBN 978-0-486-42313-5.
45)
Lansdown, R.; Yule, W., eds. (1986). The Lead debate : the environment, toxicology, and child health. Croom Helm. ISBN 978-0-7099-1653-6.
46)
«State & Federal Energy Storage Technology Advancement Partnership (ESTAP)» (PDF). Clean Energy States Alliance. Retrieved 28 February 2017.
47)
Szczepanowska, H. M. (2013). Conservation of Cultural Heritage: Key Principles and Approaches. Routledge. ISBN 978-1-136-17211-3.
48)
Nriagu, J. O. (1983). «Saturnine gout among Roman aristocrats». The New England Journal of Medicine. 308 (11): 660–63. ISSN 0028-4793. PMID 6338384. doi:10.1056/NEJM198303173081123
49)
Venugopal, B. (2013). Physiologic and Chemical Basis for Metal Toxicity. Springer. ISBN 978-1-4684-2952-7.
50)
Kosnett, M. J. (2006). «Lead». In Olson, K. R. Poisoning and Drug Overdose (5th ed.). McGraw-Hill Professional. p. 238. ISBN 978-0-07-144333-3.
51)
Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. (2008). «Endocrine disruptors and abnormalities of pubertal development». Basic & Clinical Pharmacology & Toxicology. 102 (2): 168–175. PMID 18226071. doi:10.1111/j.1742-7843.2007.00180.x
52)
«Information for the Community Lead Toxicity». Agency for Toxic Substances and Disease Registry (MP4 webcast, 82 MB). Retrieved 11 February 2017.
53)
Tarragó, A. (2012). «Case Studies in Environmental Medicine (CSEM) Lead Toxicity» (PDF). Agency for Toxic Substances and Disease Registry.
54)
United Nations Environment Programme (2010). Final review of scientific information on lead (PDF). Chemicals Branch, Division of Technology, Industry and Economics. Retrieved 31 January 2017.
55)
Smith, D. R.; Flegal, A. R. (1995). «Lead in the biosphere: Recent trends». AMBIO. 24: 21–23. JSTOR 4314280
56)
Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. (1990). «A case report of lead paint poisoning during renovation of a Victorian farmhouse». American Journal of Public Health. 80 (10): 1183–85. PMC 1404824 Freely accessible. PMID 2119148. doi:10.2105/AJPH.80.10.1183
57)
Acton, Q. A., ed. (2013). Issues in Global Environment—Pollution and Waste Management: 2012 Edition. ScholarlyEditions. p. 94. ISBN 978-1-4816-4665-9