|
|
|
|

|
|
| Names | |
|---|---|
| Other names
Magnesite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.106 |
| E number | E504(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
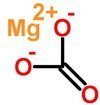
Chemical formula |
MgCO3 |
| Molar mass | 84.3139 g/mol (anhydrous) |
| Appearance | Colourless crystals or white solid Hygroscopic |
| Odor | Odorless |
| Density | 2.958 g/cm3 (anhydrous) 2.825 g/cm3 (dihydrate) 1.837 g/cm3 (trihydrate) 1.73 g/cm3 (pentahydrate) |
| Melting point | 350 °C (662 °F; 623 K) decomposes (anhydrous) 165 °C (329 °F; 438 K) (trihydrate) |
|
Solubility in water |
Anhydrous: 0.0139 g/100 ml (25 °C) 0.0063 g/100 ml (100 °C)[1] |
|
Solubility product (Ksp) |
10−7.8[2] |
| Solubility | Soluble in acid, aqueous CO2 Insoluble in acetone, ammonia |
|
Magnetic susceptibility (χ) |
−32.4·10−6 cm3/mol |
|
Refractive index (nD) |
1.717 (anhydrous) 1.458 (dihydrate) 1.412 (trihydrate) |
| Structure | |
|
Crystal structure |
Trigonal |
|
Space group |
R3c, No. 167[3] |
| Thermochemistry | |
|
Heat capacity (C) |
75.6 J/mol·K[1] |
|
Std molar |
65.7 J/mol·K[1][4] |
|
Std enthalpy of |
−1113 kJ/mol[4] |
|
Gibbs free energy (ΔfG⦵) |
−1029.3 kJ/mol[1] |
| Pharmacology | |
|
ATC code |
A02AA01 (WHO) A06AD01 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
|
| Safety data sheet (SDS) | ICSC 0969 |
| Related compounds | |
|
Other anions |
Magnesium bicarbonate |
|
Other cations |
Beryllium carbonate Calcium carbonate Strontium carbonate Barium carbonate Radium carbonate |
|
Related compounds |
Artinite Hydromagnesite Dypingite |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
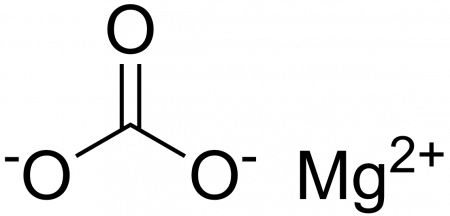
Magnesium carbonate, MgCO3 (archaic name magnesia alba), is an inorganic salt that is a colourless or white solid. Several hydrated and basic forms of magnesium carbonate also exist as minerals.
Forms[edit]
The most common magnesium carbonate forms are the anhydrous salt called magnesite (MgCO3), and the di, tri, and pentahydrates known as barringtonite (MgCO3·2H2O), nesquehonite (MgCO3·3H2O), and lansfordite (MgCO3·5H2O), respectively.[6] Some basic forms such as artinite (Mg2CO3(OH)2·3H2O), hydromagnesite (Mg5(CO3)4(OH)2·4H2O), and dypingite (Mg5(CO3)4(OH)2·5H2O) also occur as minerals. All of those minerals are colouress or white.
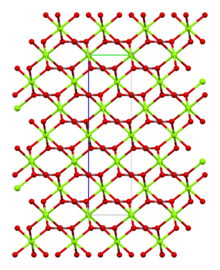
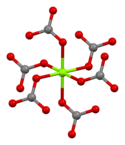
Magnesite consists of colourless or white trigonal crystals. The anhydrous salt is practically insoluble in water, acetone, and ammonia. All forms of magnesium carbonate react with acids. Magnesite crystallizes in the calcite structure wherein Mg2+ is surrounded by six oxygen atoms.[3]
| Carbonate coordination | Magnesium coordination | Unit cell |
|---|---|---|

|
|

|
The dihydrate has a triclinic structure, while the trihydrate has a monoclinic structure.
References to «light» and «heavy» magnesium carbonates actually refer to the magnesium hydroxy carbonates hydromagnesite and dypingite, respectively.[7]
Preparation[edit]
Magnesium carbonate is ordinarily obtained by mining the mineral magnesite. Seventy percent of the world’s supply is mined and prepared in China.[8]
Magnesium carbonate can be prepared in laboratory by reaction between any soluble magnesium salt and sodium bicarbonate:
- MgCl2(aq) + 2 NaHCO3(aq) → MgCO3(s) + 2 NaCl(aq) + H2O(l) + CO2(g)
If magnesium chloride (or sulfate) is treated with aqueous sodium carbonate, a precipitate of basic magnesium carbonate – a hydrated complex of magnesium carbonate and magnesium hydroxide – rather than magnesium carbonate itself is formed:
- 5 MgCl2(aq) + 5 Na2CO3(aq) + 5 H2O(l) → Mg4(CO3)3(OH)2·3H2O(s) + Mg(HCO3)2(aq) + 10 NaCl(aq)
High purity industrial routes include a path through magnesium bicarbonate, which can be formed by combining a slurry of magnesium hydroxide and carbon dioxide at high pressure and moderate temperature.[6] The bicarbonate is then vacuum dried, causing it to lose carbon dioxide and a molecule of water:
- Mg(OH)2 + 2 CO2 → Mg(HCO3)2
- Mg(HCO3)2 → MgCO3 + CO2 + H2O
Chemical properties[edit]
With acids[edit]
Like many common group 2 metal carbonates, magnesium carbonate reacts with aqueous acids to release carbon dioxide and water:
- MgCO3 + 2 HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
Decomposition[edit]
At high temperatures MgCO3 decomposes to magnesium oxide and carbon dioxide. This process is important in the production of magnesium oxide.[6] This process is called calcining:
- MgCO3 → MgO + CO2 (ΔH = +118 kJ/mol)
The decomposition temperature is given as 350 °C (662 °F).[9][10]
However, calcination to the oxide is generally not considered complete below 900 °C due to interfering readsorption of liberated carbon dioxide.
The hydrates of the salts lose water at different temperatures during decomposition.[11] For example, in the trihydrate MgCO3·3H2O, which molecular formula may be written as Mg(HCO3)(OH)·2H2O, the dehydration steps occur at 157 °C and 179 °C as follows:[11]
- Mg(HCO3)(OH)·2(H2O) → Mg(HCO3)(OH)·(H2O) + H2O at 157 °C
- Mg(HCO3)(OH)·(H2O) → Mg(HCO3)(OH) + H2O at 179 °C
Uses[edit]
The primary use of magnesium carbonate is the production of magnesium oxide by calcining. Magnesite and dolomite minerals are used to produce refractory bricks.[6] MgCO3 is also used in flooring, fireproofing, fire extinguishing compositions, cosmetics, dusting powder, and toothpaste. Other applications are as filler material, smoke suppressant in plastics, a reinforcing agent in neoprene rubber, a drying agent, and colour retention in foods.
Climber Jan Hojer blows surplus chalk from his hand. Boulder World Cup 2015
Because of its low solubility in water and hygroscopic properties, MgCO3 was first added to salt in 1911 to make it flow more freely. The Morton Salt company adopted the slogan «When it rains it pours», meaning that its salt containing MgCO3 would not stick together in humid weather.[12] Magnesium carbonate, most often referred to as «chalk», is also used as a drying agent on athletes’ hands in rock climbing, gymnastics, weightlifting and other sports in which a firm grip is necessary.[8]
As a food additive, magnesium carbonate is known as E504. Its only known side effect is that it may work as a laxative in high concentrations.[13]
Magnesium carbonate is used in taxidermy for whitening skulls. It can be mixed with hydrogen peroxide to create a paste, which is spread on the skull to give it a white finish.
Magnesium carbonate is used as a matte white coating for projection screens.[14]
Medical use[edit]
It is a laxative to loosen the bowels.
In addition, high purity magnesium carbonate is used as an antacid and as an additive in table salt to keep it free flowing. Magnesium carbonate can do this because it does not dissolve in water, only in acid, where it will effervesce (bubble).[15]
Safety[edit]
Magnesium carbonate is non-toxic and non-flammable.
Compendial status[edit]
- British Pharmacopoeia[16]
- Japanese Pharmacopoeia[17]
See also[edit]
- Calcium acetate/magnesium carbonate
- Upsalite, a reported amorphous form of magnesium carbonate
Notes and references[edit]
- ^ a b c d «Magnesium carbonate».
- ^ Bénézeth, Pascale; Saldi, Giuseppe D.; Dandurand, Jean-Louis; Schott, Jacques (2011). «Experimental determination of the solubility product of magnesite at 50 to 200 °C». Chemical Geology. 286 (1–2): 21–31. Bibcode:2011ChGeo.286…21B. doi:10.1016/j.chemgeo.2011.04.016.
- ^ a b Ross, Nancy L. (1997). «The equation of state and high-pressure behavior of magnesite». Am. Mineral. 82 (7–8): 682–688. doi:10.2138/am-1997-7-805.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0373». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. «Magnesium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_595.pub2.
- ^ Botha, A.; Strydom, C.A. (2001). «Preparation of a magnesium hydroxy carbonate from magnesium hydroxide». Hydrometallurgy. 62 (3): 175. doi:10.1016/S0304-386X(01)00197-9.
- ^ a b Allf, Bradley (21 May 2018). «The Hidden Environmental Cost of Climbing Chalk». Climbing Magazine. Cruz Bay Publishing. Retrieved 22 May 2018.
In fact, China produces 70 percent of the world’s magnesite. Most of that production—both mining and processing—is concentrated in a small corner of Liaoning, a hilly industrial province in northeast China between Beijing and North Korea.
- ^ «IAState MSDS».
- ^ Weast, Robert C.; et al. (1978). CRC Handbook of Chemistry and Physics (59th ed.). West Palm Beach, FL: CRC Press. p. B-133. ISBN 0-8493-0549-8.
- ^ a b «Conventional and Controlled Rate Thermal analysis of nesquehonite Mg(HCO3)(OH)·2(H2O)» (PDF).
- ^ «Her Debut — Morton Salt». Retrieved 27 December 2017.
- ^ «Food-Info.net : E-numbers : E504: Magnesium carbonates». 080419 food-info.net
- ^ Noronha, Shonan (2015). Certified Technology Specialist-Installation. McGraw Hill Education. p. 256. ISBN 978-0071835657.
- ^ «What Is Magnesium Carbonate?». Sciencing. Retrieved 15 April 2018.
- ^ British Pharmacopoeia Commission Secretariat (2009). «Index, BP 2009» (PDF). Archived from the original (PDF) on 11 April 2009. Retrieved 31 January 2010.
- ^ «Japanese Pharmacopoeia, Fifteenth Edition» (PDF). 2006. Archived from the original (PDF) on 22 July 2011. Retrieved 31 January 2010.
External links[edit]
- International Chemical Safety Card 0969
- NIST Standard Reference Database

|
|

|
|

|
|
| Names | |
|---|---|
| Other names
Magnesite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.106 |
| E number | E504(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgCO3 |
| Molar mass | 84.3139 g/mol (anhydrous) |
| Appearance | Colourless crystals or white solid Hygroscopic |
| Odor | Odorless |
| Density | 2.958 g/cm3 (anhydrous) 2.825 g/cm3 (dihydrate) 1.837 g/cm3 (trihydrate) 1.73 g/cm3 (pentahydrate) |
| Melting point | 350 °C (662 °F; 623 K) decomposes (anhydrous) 165 °C (329 °F; 438 K) (trihydrate) |
|
Solubility in water |
Anhydrous: 0.0139 g/100 ml (25 °C) 0.0063 g/100 ml (100 °C)[1] |
|
Solubility product (Ksp) |
10−7.8[2] |
| Solubility | Soluble in acid, aqueous CO2 Insoluble in acetone, ammonia |
|
Magnetic susceptibility (χ) |
−32.4·10−6 cm3/mol |
|
Refractive index (nD) |
1.717 (anhydrous) 1.458 (dihydrate) 1.412 (trihydrate) |
| Structure | |
|
Crystal structure |
Trigonal |
|
Space group |
R3c, No. 167[3] |
| Thermochemistry | |
|
Heat capacity (C) |
75.6 J/mol·K[1] |
|
Std molar |
65.7 J/mol·K[1][4] |
|
Std enthalpy of |
−1113 kJ/mol[4] |
|
Gibbs free energy (ΔfG⦵) |
−1029.3 kJ/mol[1] |
| Pharmacology | |
|
ATC code |
A02AA01 (WHO) A06AD01 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
|
| Safety data sheet (SDS) | ICSC 0969 |
| Related compounds | |
|
Other anions |
Magnesium bicarbonate |
|
Other cations |
Beryllium carbonate Calcium carbonate Strontium carbonate Barium carbonate Radium carbonate |
|
Related compounds |
Artinite Hydromagnesite Dypingite |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium carbonate, MgCO3 (archaic name magnesia alba), is an inorganic salt that is a colourless or white solid. Several hydrated and basic forms of magnesium carbonate also exist as minerals.
Forms[edit]
The most common magnesium carbonate forms are the anhydrous salt called magnesite (MgCO3), and the di, tri, and pentahydrates known as barringtonite (MgCO3·2H2O), nesquehonite (MgCO3·3H2O), and lansfordite (MgCO3·5H2O), respectively.[6] Some basic forms such as artinite (Mg2CO3(OH)2·3H2O), hydromagnesite (Mg5(CO3)4(OH)2·4H2O), and dypingite (Mg5(CO3)4(OH)2·5H2O) also occur as minerals. All of those minerals are colouress or white.
Magnesite consists of colourless or white trigonal crystals. The anhydrous salt is practically insoluble in water, acetone, and ammonia. All forms of magnesium carbonate react with acids. Magnesite crystallizes in the calcite structure wherein Mg2+ is surrounded by six oxygen atoms.[3]
| Carbonate coordination | Magnesium coordination | Unit cell |
|---|---|---|

|

|

|
The dihydrate has a triclinic structure, while the trihydrate has a monoclinic structure.
References to «light» and «heavy» magnesium carbonates actually refer to the magnesium hydroxy carbonates hydromagnesite and dypingite, respectively.[7]
Preparation[edit]
Magnesium carbonate is ordinarily obtained by mining the mineral magnesite. Seventy percent of the world’s supply is mined and prepared in China.[8]
Magnesium carbonate can be prepared in laboratory by reaction between any soluble magnesium salt and sodium bicarbonate:
- MgCl2(aq) + 2 NaHCO3(aq) → MgCO3(s) + 2 NaCl(aq) + H2O(l) + CO2(g)
If magnesium chloride (or sulfate) is treated with aqueous sodium carbonate, a precipitate of basic magnesium carbonate – a hydrated complex of magnesium carbonate and magnesium hydroxide – rather than magnesium carbonate itself is formed:
- 5 MgCl2(aq) + 5 Na2CO3(aq) + 5 H2O(l) → Mg4(CO3)3(OH)2·3H2O(s) + Mg(HCO3)2(aq) + 10 NaCl(aq)
High purity industrial routes include a path through magnesium bicarbonate, which can be formed by combining a slurry of magnesium hydroxide and carbon dioxide at high pressure and moderate temperature.[6] The bicarbonate is then vacuum dried, causing it to lose carbon dioxide and a molecule of water:
- Mg(OH)2 + 2 CO2 → Mg(HCO3)2
- Mg(HCO3)2 → MgCO3 + CO2 + H2O
Chemical properties[edit]
With acids[edit]
Like many common group 2 metal carbonates, magnesium carbonate reacts with aqueous acids to release carbon dioxide and water:
- MgCO3 + 2 HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
Decomposition[edit]
At high temperatures MgCO3 decomposes to magnesium oxide and carbon dioxide. This process is important in the production of magnesium oxide.[6] This process is called calcining:
- MgCO3 → MgO + CO2 (ΔH = +118 kJ/mol)
The decomposition temperature is given as 350 °C (662 °F).[9][10]
However, calcination to the oxide is generally not considered complete below 900 °C due to interfering readsorption of liberated carbon dioxide.
The hydrates of the salts lose water at different temperatures during decomposition.[11] For example, in the trihydrate MgCO3·3H2O, which molecular formula may be written as Mg(HCO3)(OH)·2H2O, the dehydration steps occur at 157 °C and 179 °C as follows:[11]
- Mg(HCO3)(OH)·2(H2O) → Mg(HCO3)(OH)·(H2O) + H2O at 157 °C
- Mg(HCO3)(OH)·(H2O) → Mg(HCO3)(OH) + H2O at 179 °C
Uses[edit]
The primary use of magnesium carbonate is the production of magnesium oxide by calcining. Magnesite and dolomite minerals are used to produce refractory bricks.[6] MgCO3 is also used in flooring, fireproofing, fire extinguishing compositions, cosmetics, dusting powder, and toothpaste. Other applications are as filler material, smoke suppressant in plastics, a reinforcing agent in neoprene rubber, a drying agent, and colour retention in foods.
Climber Jan Hojer blows surplus chalk from his hand. Boulder World Cup 2015
Because of its low solubility in water and hygroscopic properties, MgCO3 was first added to salt in 1911 to make it flow more freely. The Morton Salt company adopted the slogan «When it rains it pours», meaning that its salt containing MgCO3 would not stick together in humid weather.[12] Magnesium carbonate, most often referred to as «chalk», is also used as a drying agent on athletes’ hands in rock climbing, gymnastics, weightlifting and other sports in which a firm grip is necessary.[8]
As a food additive, magnesium carbonate is known as E504. Its only known side effect is that it may work as a laxative in high concentrations.[13]
Magnesium carbonate is used in taxidermy for whitening skulls. It can be mixed with hydrogen peroxide to create a paste, which is spread on the skull to give it a white finish.
Magnesium carbonate is used as a matte white coating for projection screens.[14]
Medical use[edit]
It is a laxative to loosen the bowels.
In addition, high purity magnesium carbonate is used as an antacid and as an additive in table salt to keep it free flowing. Magnesium carbonate can do this because it does not dissolve in water, only in acid, where it will effervesce (bubble).[15]
Safety[edit]
Magnesium carbonate is non-toxic and non-flammable.
Compendial status[edit]
- British Pharmacopoeia[16]
- Japanese Pharmacopoeia[17]
See also[edit]
- Calcium acetate/magnesium carbonate
- Upsalite, a reported amorphous form of magnesium carbonate
Notes and references[edit]
- ^ a b c d «Magnesium carbonate».
- ^ Bénézeth, Pascale; Saldi, Giuseppe D.; Dandurand, Jean-Louis; Schott, Jacques (2011). «Experimental determination of the solubility product of magnesite at 50 to 200 °C». Chemical Geology. 286 (1–2): 21–31. Bibcode:2011ChGeo.286…21B. doi:10.1016/j.chemgeo.2011.04.016.
- ^ a b Ross, Nancy L. (1997). «The equation of state and high-pressure behavior of magnesite». Am. Mineral. 82 (7–8): 682–688. doi:10.2138/am-1997-7-805.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0373». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. «Magnesium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_595.pub2.
- ^ Botha, A.; Strydom, C.A. (2001). «Preparation of a magnesium hydroxy carbonate from magnesium hydroxide». Hydrometallurgy. 62 (3): 175. doi:10.1016/S0304-386X(01)00197-9.
- ^ a b Allf, Bradley (21 May 2018). «The Hidden Environmental Cost of Climbing Chalk». Climbing Magazine. Cruz Bay Publishing. Retrieved 22 May 2018.
In fact, China produces 70 percent of the world’s magnesite. Most of that production—both mining and processing—is concentrated in a small corner of Liaoning, a hilly industrial province in northeast China between Beijing and North Korea.
- ^ «IAState MSDS».
- ^ Weast, Robert C.; et al. (1978). CRC Handbook of Chemistry and Physics (59th ed.). West Palm Beach, FL: CRC Press. p. B-133. ISBN 0-8493-0549-8.
- ^ a b «Conventional and Controlled Rate Thermal analysis of nesquehonite Mg(HCO3)(OH)·2(H2O)» (PDF).
- ^ «Her Debut — Morton Salt». Retrieved 27 December 2017.
- ^ «Food-Info.net : E-numbers : E504: Magnesium carbonates». 080419 food-info.net
- ^ Noronha, Shonan (2015). Certified Technology Specialist-Installation. McGraw Hill Education. p. 256. ISBN 978-0071835657.
- ^ «What Is Magnesium Carbonate?». Sciencing. Retrieved 15 April 2018.
- ^ British Pharmacopoeia Commission Secretariat (2009). «Index, BP 2009» (PDF). Archived from the original (PDF) on 11 April 2009. Retrieved 31 January 2010.
- ^ «Japanese Pharmacopoeia, Fifteenth Edition» (PDF). 2006. Archived from the original (PDF) on 22 July 2011. Retrieved 31 January 2010.
External links[edit]
- International Chemical Safety Card 0969
- NIST Standard Reference Database
| Карбонат магния | |
 |
|
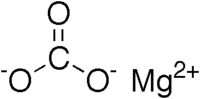 |
|
| Общие | |
|---|---|
| Химическая формула | MgCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | белое гигроскопическое вещество |
| Молярная масса | 84.3139 г/моль |
| Плотность | (ангидрид) 2.958 г/см³
(дигидрат) 2.825 г/см³ (тригидрат) 1.837 г/см³ (пентагидрат) 1.73 г/см³ |
| Термические свойства | |
| Температура плавления | (с разл.) 540 °C |
| Энтальпия образования (ст. усл.) | −1111.69 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (25 °C, ангидрид) 0.0012 г/100 мл
(20 °C, пентагидрат) 0.375 г/100 мл |
| Оптические свойства | |
| Показатель преломления | (ангидрид) 1.717
(дигидрат) 1.458 (тригидрат) 1.412 |
| Структура | |
| Кристаллическая структура | тригональная |
| Классификация | |
| Рег. номер CAS | 546-93-0 (ангидрид)
13717-00-5 (моногидрат) 5145-48-2 (дигидрат) 14457-83-1 (тригидрат) 61042-72-6 (пентагидрат) |
| RTECS | OM2470000 |
Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты.
Свойства
Бесцветные кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3.
Распространённость в природе
Карбонат магния широко распространён в природе в виде минерала магнезита.
Применение
Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов.
В медицине и в качестве пищевой добавки E504 используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O
Спортивная магнезия 4MgCO3·Mg(OH)2·4H2O используется для подсушивания рук и, как следствие, увеличения надежности хвата.
Карбонат магния необходим в производстве стекла, цемента, кирпича.
См. также
- Сульфат магния (лекарство)
- Цитрат магния
Физические свойства
Карбонат магния MgCO3 — соль магния и угольной кислоты. Белый, при умеренном нагревании разлагается. Мало растворяется в холодной воде. Разлагается в горячей воде.
Относительная молекулярная масса Mr = 84,31; относительная плотность для тв. и ж. состояния d= 3,037;
Способ получения
1. Карбонат магния можно получить путем взаимодействия сульфата магния и гидрокарбоната калия, образуется карбонат магния, сульфат калия, вода и углекислый газ:
MgSO4 + 2KHCO3 = MgCO3↓ + K2SO4 + H2O + CO2↑
Качественная реакция
Качественная реакция на карбонат магния — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат магния образует хлорид магния, углекислый газ и воду:
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
Химические свойства
1. Карбонат магния разлагается при температуре выше 350 — 650º С, с образованием оксида магния и углекислого газа:
MgCO3 = MgO + CO2
2. Карбонат магния вступает в реакцию со многими сложными веществами:
2.1. Карбонат магния реагирует с горячей водой, образуя гидроксокарбонат магния и углекислый газ:
2MgCO3 + H2O = Mg2CO3(OH)2↓ + CO2↑
2.2. Карбонат магния реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат магния образует хлорид магния, углекислый газ и воду:
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
2.2.2. Карбонат магния реагирует с концентрированной и горячей плавиковой кислотой. Взаимодействие карбоната магния с плавиковой кислотой приводит к образованию фторида магния, воды и углекислого газа:
MgCO3 + 2HF = MgF2↓ + CO2↑ + H2O
2.3. Карбонат магния может взаимодействовать с солями:
2.3.1. Карбонат магния взаимодействует при кипении с концентрированным раствором сульфата аммония. При этом образуется сульфат магния, аммиак, углекислый газ и вода:
MgCO3 + (NH4)2SO4 = MgSO4 + 2NH3↑ + CO2↑ + H2O
Химические свойства
Молекулярная масса магниевой соли угольной кислоты = 84,3 грамма на моль. Температура разложения – порядка 540 градусов Цельсия.
В природе вещество распространено в виде минерала магнезита. Белую магнезию используют для изготовления теплоизоляционных материалов, как пищевую добавку E504, в спорте для удаления лишней влаги с рук, при производстве цемента, стекла и прочих строительных материалов.
В медицине средство используется в качестве антацида, обладающего противоязвенным действием.
Вещество синтезируют в виде белого гигроскопичного порошка, не имеющего запаха или вкуса. Соединение нерастворимо в воде, хорошо растворяется в растворах минеральных кислот (во время реакции происходит интенсивное выделение газа).
В готовых лекарствах чаще всего находится в виде солей (гидроксид карбоната магния). Существует легкий магния гидроксокарбонат (Magnesii subcarbonas levis) в виде тетрагидрата и тяжелый пентагидрат (Magnesii subcarbonas ponderosus).
Фармакологическое действие
Противоязвенное, антацидное, стимулирующее перистальтику кишечника.
Фармакодинамика и фармакокинетика
Карбонат Магния приводит к нейтрализации соляной кислоты желудочного сока, повышает осмотическое давление в просвете кишечника, увеличивает объем, усиливает перистальтику и ускоряет эвакуацию каловых масс.
Также данное вещество способно активизировать обменные процессы, участвует в синтезе нуклеиновых кислот и белка, нормализует ионный баланс в мышцах, в том числе и в сердечной мышце. Магния Карбонат обладает антиаритмическим, антиагрегатным и спазмолитическим действием.
При приеме таблеток, соединение практически не попадает в системный кровоток.
Показания к применению
Лекарство назначают:
- при гастроэзофагеальном рефлюксе, дуодените, панкреатите;
- пациентам с гиперацидностью желудочного сока, эзофагитом, гастритом;
- при язвах и эрозиях в верхних отделах желудочно-кишечного тракта;
- для лечения дефицита магния, который сопровождается спазмами мышц, повышенной утомляемостью, нарушениями сна, миалгией;
- при интенсивных физических нагрузках;
- детям в период быстрого роста;
- для профилактики оксалатного нефроулитиаза.
Противопоказания
Вещество нельзя принимать лицам с фенилкетонурией или аллергией на Магния Карбонат.
Побочные действия
Побочные реакции проявляются редко. Могут развиться: повышенное газообразование, несварение желудка, понос, отрыжка.
Магния Карбонат, инструкция по применению (Способ и дозировка)
Режим дозирования зависит от возраста и заболевания.
Внутрь взрослым назначают по одному – три грамма вещества в сутки. Разовая доза – 0,5 грамма.
Для детей от 6 до 12 лет рекомендуемая дозировка = 1 или 2 грамма, распределенных на 2-3 приема
Детям от 2 до 5 лет дают по одному-полтора грамма вещества в сутки.
В возрасте до 2 лет не рекомендуется превышать суточную дозировку = 500 мг.
Продолжительность лечения определяется врачом.
Передозировка
Нет данных о передозировке лекарственным средством.
Взаимодействие
Вещество хорошо сочетается с антацидами алюминия.
Средство снижает эффективность (снижает скорость всасывания из ЖКТ) следующих веществ: барбитураты, глюкокортикостероиды, м-холиноблокаторы, тетрациклин, пероральные антикоагулянты, аминазин, бутадиол, препараты железа, сульфаниламиды, циметидин.
Лекарство рекомендуется принимать:
- чтобы снизить ульцерогенность нестероидных противовоспалительных средств и риск развития гастропатии;
- в сочетании с ферментами поджелудочной железы.
Препарат хуже усваивается, если его принимать совместно с фосфатами, кальцием и жирами.
Условия продажи
Без рецепта.
Условия хранения
Хранить таблетки рекомендуется в герметичной упаковке, в сухом месте, при комнатной температуре.
Срок годности
От 2 до 3 лет, в зависимости от фирмы-производителя.
Особые указания
Карбонат Магния можно использовать наружно, как вяжущее средство.
Препараты, в которых содержится (Аналоги)
Данное соединение в качестве главного действующего компонента содержится в препаратах: Магния Карбонат Основной, Аддитива Магний.
Также вещество сходит в состав: Ренни, Викаир, Викалин, Осварен, Магний Плюс.
Отзывы о Магния Карбонате
Отзывов о препарате мало, но из тех, что имеются, отрицательных нет. Многие отмечают относительно низкую стоимость препарата и его высокую эффективность, и простоту действия. Наиболее частые побочные реакции – метеоризм или отрыжка.
Цена Магния Карбоната, где купить
Купить Карбонат Магния можно в составе препарата Ренни примерно за 120 рублей, 12 жевательных таблеток. На данный момент указать актуальную стоимость препаратов Аддитива Магний или Магния Карбонат Основной невозможно.
Карбонат магния
Поиск химических веществ по названиям или формулам.
Категории веществ
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы). Введите часть названия или формулу для поиска: Языки: По умолчанию | Все возможные | Из списка | Карбонат магния
Брутто-формула: Категории: PubChem CID: 11029 Названия Русский:
English:
German:
Español:
Ελληνικά:
French:
Italiano:
日本語:
中文:
Варианты формулы:
|
| Карбонат магния | |
|---|---|
|
|
|
| Хим. формула | MgCO3 |
| Состояние | белое гигроскопическое вещество |
| Молярная масса | 84.3139 г/моль |
| Плотность |
(ангидрид) 2.958 г/см³ (дигидрат) 2.825 г/см³ (тригидрат) 1.837 г/см³ (пентагидрат) 1.73 г/см³ |
| Температура | |
| • плавления | (с разл.) 540 °C |
| Энтальпия | |
| • образования | −1111.69 кДж/моль |
| Растворимость | |
| • в воде | (25 °C, ангидрид) 0.0012 г/100 мл (20 °C, пентагидрат) 0.375 г/100 мл |
| Показатель преломления |
(ангидрид) 1.717 (дигидрат) 1.458 (тригидрат) 1.412 |
| Кристаллическая структура | тригональная |
| Рег. номер CAS |
546-93-0 (ангидрид) 13717-00-5 (моногидрат) 5145-48-2 (дигидрат) 14457-83-1 (тригидрат) 61042-72-6 (пентагидрат) |
| PubChem | 11029 |
| Рег. номер EINECS | 208-915-9 |
| SMILES |
C(=O)([O-])[O-].[Mg+2] |
| InChI |
1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 ZLNQQNXFFQJAID-UHFFFAOYSA-L |
| Кодекс Алиментариус | E504(i) |
| RTECS | OM2470000 |
| ChEBI | 31793 |
| ChemSpider | 10563 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты.
Свойства
Белые кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Mg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3.
Распространённость в природе
Карбонат магния широко распространён в природе в виде минерала магнезита. Кроме того, присутствует в стереоме иглокожих.
Применение
Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов.
В медицине и в качестве пищевой добавки E504 используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O
Спортивная магнезия 4MgCO3·Mg(OH)2·4H2O используется для подсушивания рук и, как следствие, увеличения надежности хвата.
Карбонат магния необходим в производстве стекла, цемента, кирпича.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Магния карбонат
- Брутто формула
- Фармакологическая группа вещества Магния карбонат
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Магния карбонат
- Противопоказания
- Побочные действия вещества Магния карбонат
- Взаимодействие
- Способ применения и дозы
- Торговые названия с действующим веществом Магния карбонат
Структурная формула
Русское название
Магния карбонат
Английское название
Magnesium carbonate
Латинское название вещества Магния карбонат
Magnesii carbonas (род. Magnesii carbonatis)
Фармакологическая группа вещества Магния карбонат
Фармакологическое действие
—
антацидное, противоязвенное, стимулирующее перистальтику кишечника.
Характеристика
Белый легкий порошок без запаха и вкуса. Практически нерастворим в воде, растворим в разведенных минеральных кислотах.
Фармакология
Нейтрализует соляную кислоту желудочного сока. Ионы магния повышают осмотическое давление в просвете кишечника, увеличивают объем и ускоряют пассаж кишечного содержимого. При приеме внутрь практически не всасывается.
Применение вещества Магния карбонат
Гиперацидность желудочного сока, желудочно-пищеводный рефлюкс, эзофагит, гастрит, дуоденит, панкреатит, эрозивно-язвенные поражения верхних отделов ЖКТ, запор.
Противопоказания
Фенилкетонурия.
Побочные действия вещества Магния карбонат
Диспепсия, диарея.
Взаимодействие
Замедляет всасывание аминазина, барбитуратов, бутадиона, глюкокортикоидов, препаратов железа (образует нерастворимые соли), м-холиноблокаторов, сульфаниламидов, тетрациклинов, циметидина. Создает оптимальные условия для действия ферментов (и их препаратов) поджелудочной железы; уменьшает ульцерогенность НПВС и вероятность гастропатии. Фосфаты, большие дозы кальция и избыток липидов снижают усвоение магния.
Способ применения и дозы
Внутрь: взрослым по 1–3 г, детям до 2 лет — по 0,5 г, 2–5 лет — по 1–1,5 г, 6–12 лет — по 1–2 г 2–3 раза в день.
Торговые названия с действующим веществом Магния карбонат
Оптовые поставки карбоната магния
Наш завод приглашает покупателей для выгодной покупки химических соединений и реактивов по низким ценам.
Гарантируем полное соответствие нормам, установленным для химических веществ, оперативную бережную доставку в любое место на карте страны.
Все реактивы и химикаты продаются оптом и крупным оптом.
Предлагаем для быстрого вывоза пищевую добавку – магния карбонат, упакованный в тару разного номинала. Продаем две разновидности соединения: легкий и тяжелый карбонаты магния.
Свойства карбоната магния
Белый порошок, в воде не растворяется. При контакте с кислотами вступает в реакцию с выделением газа.
Является источником уникального вещества, необходимого человеческому организму. Если его не хватает, появляется повышенная раздражительность, ломкие волосы, суставные боли. Могут также возникать симптомы переутомления и проблемы с пищеварением.
В естественных условиях входит в состав минерала магнезита.
| Хим. формула | MgCO3 |
|---|---|
| Состояние | белое гигроскопическое вещество |
| Молярная масса | 84.3139 г/моль |
| Плотность |
(ангидрид) 2.958 г/см³ (дигидрат) 2.825 г/см³ (тригидрат) 1.837 г/см³ (пентагидрат) 1.73 г/см³ |
| Температура плавления | (с разл.) 540 °C |
| Энтальпия образования | −1111.69 кДж/моль |
| Растворимость в воде | (25 °C, ангидрид) 0.0012 г/100 мл (20 °C, пентагидрат) 0.375 г/100 мл |
| Показатель преломления |
(ангидрид) 1.717 (дигидрат) 1.458 (тригидрат) 1.412 |
| Кристаллическая структура | тригональная |
| Рег. номер CAS |
546-93-0 (ангидрид) 13717-00-5 (моногидрат) 5145-48-2 (дигидрат) 14457-83-1 (тригидрат) 61042-72-6 (пентагидрат) |
| PubChem | 11029 |
| Рег. номер EINECS | 208-915-9 |
| SMILES |
C(=O)([O-])[O-].[Mg+2] |
| InChI |
1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 ZLNQQNXFFQJAID-UHFFFAOYSA-L |
| Кодекс Алиментариус | E504(i) |
| RTECS | OM2470000 |
| ChEBI | 31793 |
| ChemSpider | 10563 |
| Показатели качества | |
| Наименование показателя | Требования ТУ |
| Внешний вид | Белая рыхлая и ломкая масса или объемистый белый порошок, без характерного запаха |
| Массовая доля карбоната магния, в пересчете на Mg | не менее 24,0 % и не более 26,4 % |
Наш завод предоставляет два года гарантии на соответствие требованиям предъявляемым при хранении вещества в рекомендуемых условиях, при правильной транспортировке и хранении.
Так как Железо (III) оксид для катализаторов требует к себе особого внимания при транспортировке, то нужно отнестись к его упаковке с особой тщательностью. Наша компания может организовать его упаковку по ГОСТ. Поэтому на нашем химическом заводе готовое вещество упаковывается в прочные полиэтиленовые мешки, соответствующие стандартам. На выбор покупателя, так же возможна упаковка этого вещества в бумажные пяти-шести-слойные мешки.
Магния карбонат Е 504 получают путем осаждения кальцинированной соды или раствора магния сульфата.
Научно популярное видео о получении карбоната магния.
Применяется в производстве продуктов питания, но не ограничивается пищевой промышленностью.
Пищевая промышленность
Производителями пищевой продукции эмульгатор применяется для регулирования консистенции продуктов питания. Плюс соединение работает как связующий агент, создавая композиции веществ, которые естественным путем не соединяются и не растворяются друг в друге, например, жиры и вода.
- Используется при консервировании плодоовощной продукции. Соединение уплотняет структуру фруктов и овощей, за счет чего достигается свежий и красивый внешний вид. Предохраняет витамины и микроэлементы от разрушения при термической обработке, делая консервы полезными и насыщенными полезными веществами.
- Стабилизатор добавляют в сыпучие продукты для предупреждения образования комков и уплотнения продукта. Стабилизирует сахар, соль, какао и порошковые продукты из него, сухое молоко, сухие напитки (горячий шоколад и другие).
- Используют в производстве сыров для регулировки уровня кислотности.
- Добавляют для сохранения яркого цвета продукта — как антиокислитель и в качестве усилителя красителей.
- Сохраняет сохранность и свежий вид сырной нарезки – она не сливается и не заветривается.
Эмульгатор напрямую влияет на длительность срока хранения продуктов, в том числе на готовые к употреблению блюда. Собственным запахом или вкусом вещество не обладает.
Медицина
- Соединение применяется в соответствии со своими антацидными свойствами – при повышенной кислотности, язвенных заболеваниях желудка и тонкого кишечника.
- Активизирует перистальтику кишечника – поэтому применяется в качестве слабительного.
- Кроме способности к нейтрализации избытка кислот, вещество отличается свойством активизировать обменные процессы. Ионы соединения приводят мускулатуру кишечных стенок в тонус.
- Применяется для нормализации состояния при панкреатите.
- Воздействие на состояние мышц также используется для снятия спазмов.
- Вещество способствует сохранению энергии, ее правильному распределению в мышечных тканях.
- Форсирует процесс синтеза белка.
- Поддерживает равновесие ионов в крови.
- Хорошо влияет на работу сердца, так как предупреждает аритмию.
- Поддерживает нормальное состояние крови, работая как антиагрегант. Предупреждает слипание тромбоцитов.
- Вещество обладает способностью снижать уровень зависимости от табака, алкоголя и наркотических веществ.
- Вещество принимает участие в нескольких сотнях биохимических реакций организма, поддерживаем оптимальный баланс калия и натрия.
- Стабилизирует состояние нервной системы.
- Укрепляет кости.
- Повышает иммунитет сопротивляемость организма при наличии неблагоприятных факторов.
Применение в производстве оптической керамики
Мелкодисперсный карбонат магния применяется в производстве стекла со свойствами, превосходящими обычное неорганическое стекло.
Получаемая оптическая керамика обладает высокой прозрачностью и прочностью. Магниевое стекло используют для производства:
- экранов для рассеивания света
- светофильтров
- различных комплексов и проборов.
Стекло, устойчивое к воздействию кислот, высоких и низких температур и механическим повреждениям, используется также в области IT-технологий и термоядерной физике.
Введение соединения в различные составы стекол и других технологических масс повышает их прочность.
Другие области применения
- У порошка карбоната магния выраженные свойства сорбента, что позволяет использовать его как присыпку для рук при занятиях спортом, скалолазании.
- Также хорошо он впитывает пот и кожное сало, оказывая вяжущее действие в отношении жиров на коже. Это позволяет использовать вещество в составе масок и кремов, снимающих жирный блеск кожи и подсушивающих ее.
- Входит в состав зубных паст, пудры, некоторых красок для волос (как белый пигмент).
- Используется для уменьшения количества дыма в составах для тушения огня.
- Применяется в производстве пластика.
- Входит в технологическую цепочку производства материалов для теплоизоляции.
Дефицит магния в организме вызывает повышенную утомляемость, спазмы мышц, нарушения сна. Соединение жизненно необходимо в период активного роста в детском и подростковом возрасте, а также взрослым – при тяжелой физической работе или интенсивных занятиях спортом.
При приеме препаратов с карбонатом магния следует соблюдать дозировку, указанную врачом, а также соблюдать правила совместимости соединения с другими медикаментами. Передозировка может вызвать раздражение слизистых оболочек ЖКТ, угнетенное состояние, аритмию.
Меры предосторожности при обращении с веществом
Поступление соединения в организм с продуктами безопасно, так как карбонат магния не обладает токсичностью. Случаи индивидуальной непереносимости редки.
Вещество не горюче, но при попадании в огонь могут образоваться окись углерода (СО) или диоксид углерода (CO2).
При работе с ним избегать пылеобразования, т.к. при попадание в верхние дыхательные пути, может вызвать раздражение.
Производитель карбоната магния (E504i)
Как Вы знаете, наш завод МЗХР работает еще со времен СССР, вот уже более 70 лет, и за это время мы сохранили главное — высокие стандарты качества химической продукции, заданные еще с тех времен. И сегодня мы продолжаем делать нашу работу на «отлично». Именно поэтому заказав любую продукцию у нас, будьте уверены, что она будет обязательно высокого качества. А что касается сроков доставки — Вы получите продукт в сжатые сроки, на столько быстро, на сколько это позволяет сделать логистика перемещения грузов по РФ. Благодаря собственному ж/д тупику вблизи производства, отгрузка товара происходит очень быстро, от звонка до отправки нужного продукта, может пройти всего несколько часов.
Сегодня мы с уверенностью можем заявить — производство карбоната магния любых партий, любых объемов, любых химических реагентов или веществ для нас уже не вызов, а обычный заказ, которые мы выполняем каждый день.
Приглашаем к сотрудничеству
Мы может полностью обеспечить потребность вашего производства в карбонате магния (E504i), а также любых других веществах, реактивах и соединениях. Мы создаем покупателям все условия для получения необходимого химиката. При необходимости разрабатываем персональное ТУ под особенности предприятия и технологий.
Дешево и быстро доставляем любые партии товаров собственным автотранспортом или по железной дороге. Всегда успеваем в срок.
Позвоните, чтобы выяснить наши цены. Вы убедитесь, что у нас одни из самых низких цен на химические реактивы в России, а стоимость доставки вас приятно удивит, благодаря тому что на нашем производстве имеется собственная железнодорожная ветка, по которой наша продукция идет напрямую к покупателю.
Крупные партии товаров рассчитываются по особому прайсу.
Заключение договора о постоянном сотрудничестве сделает ваши закупки еще более экономичными и выгодными.