
|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Calcium acetylide |
|
| Systematic IUPAC name
Calcium ethynediide |
|
| Other names
Calcium percarbide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.772 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CaC2 |
| Molar mass | 64.099 g/mol |
| Appearance | White powder to grey/black crystals |
| Density | 2.22 g/cm3 |
| Melting point | 2,160 °C (3,920 °F; 2,430 K) |
| Boiling point | 2,300 °C (4,170 °F; 2,570 K) |
|
Solubility in water |
Rapid hydrolysis |
| Structure[1] | |
|
Crystal structure |
Tetragonal (I phase) Monoclinic (II phase) Monoclinic (III phase) |
|
Space group |
I4/mmm (I phase) C2/c (II phase) C2/m (III phase) |
|
Coordination geometry |
6 |
| Thermochemistry | |
|
Std molar |
70 J·mol−1·K−1 |
|
Std enthalpy of |
−63 kJ·mol−1 |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Reacts with water to release acetylene gas[2] |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H260 |
| NFPA 704 (fire diamond) |
1 4 2
|
|
Autoignition |
305 °C (581 °F; 578 K) (acetylene) |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium carbide, also known as calcium acetylide, is a chemical compound with the chemical formula of CaC2. Its main use industrially is in the production of acetylene and calcium cyanamide.[3]
The pure material is colorless, while pieces of technical-grade calcium carbide are grey or brown and consist of about 80–85% of CaC2 (the rest is CaO (calcium oxide), Ca3P2 (calcium phosphide), CaS (calcium sulfide), Ca3N2 (calcium nitride), SiC (silicon carbide), etc.). In the presence of trace moisture, technical-grade calcium carbide emits an unpleasant odor reminiscent of garlic.[4]
Applications of calcium carbide include manufacture of acetylene gas, generation of acetylene in carbide lamps, manufacture of chemicals for fertilizer, and steelmaking.
Production[edit]
Calcium carbide is produced industrially in an electric arc furnace from a mixture of lime and coke at approximately 2,200 °C (3,990 °F).[5] This is an endothermic reaction requiring 110 kilocalories (460 kJ) per mole[6] and high temperatures to drive off the carbon monoxide. This method has not changed since its invention in 1892:
- CaO + 3 C → CaC2 + CO
The high temperature required for this reaction is not practically achievable by traditional combustion, so the reaction is performed in an electric arc furnace with graphite electrodes. The carbide product produced generally contains around 80% calcium carbide by weight. The carbide is crushed to produce small lumps that can range from a few mm up to 50 mm. The impurities are concentrated in the finer fractions. The CaC2 content of the product is assayed by measuring the amount of acetylene produced on hydrolysis. As an example, the British and German standards for the content of the coarser fractions are 295 L/kg and 300 L/kg respectively (at 101 kPa pressure and 20 °C (68 °F) temperature). Impurities present in the carbide include phosphide (fosgen), which produces phosphine when hydrolysed.[7]
This reaction was an important part of the industrial revolution in chemistry, and was made possible in the United States as a result of massive amounts of inexpensive hydroelectric power produced at Niagara Falls before the turn of the 20th century.[8]
The electric arc furnace method was discovered in 1892 by T. L. Willson, and independently in the same year by H. Moissan.[9][10][11] In Jajce, Bosnia and Herzegovina, the Austrian industrialist Dr. Josef Kranz and his «Bosnische-Elektrizitäts AG» company, whose successor later became «Elektro-Bosna», opened the largest chemical factory for the production of calcium carbide at the time in Europe in 1899. A hydroelectric power station on the Pliva river with an installed capacity of 8 MW was constructed to supply electricity for the factory, the first power station of its kind in Southeast Europe, and became operational on 24 March 1899.[12]
Crystal structure[edit]
Pure calcium carbide is a colourless solid. The common crystalline form at room temperature is a distorted rock-salt structure with the C22− units lying parallel.[13] There are three different polymorphs which appear at room temperature: the tetragonal structure and two different monoclinic structures.[1]
Applications[edit]
Production of acetylene[edit]
The reaction of calcium carbide with water, producing acetylene and calcium hydroxide,[5] was discovered by Friedrich Wöhler in 1862.
- CaC2(s) + 2H2O(aq) → C2H2(g) + Ca(OH)2(aq)
This reaction was the basis of the industrial manufacture of acetylene, and is the major industrial use of calcium carbide.
Today acetylene is mainly manufactured by the partial combustion of methane or appears as a side product in the ethylene stream from cracking of hydrocarbons. Approximately 400,000 tonnes are produced this way annually (see Acetylene Preparation).
In China, acetylene derived from calcium carbide remains a raw material for the chemical industry, in particular for the production of polyvinyl chloride. Locally produced acetylene is more economical than using imported oil.[14] Production of calcium carbide in China has been increasing. In 2005 output was 8.94 million tons, with the capacity to produce 17 million tons.[15]
In the United States, Europe, and Japan, consumption of calcium carbide is generally declining.[16] Production levels in the US during the 1990s were 236,000 tons per year.[13]
Production of calcium cyanamide[edit]
Calcium carbide reacts with nitrogen at high temperature to form calcium cyanamide:[5]
- CaC2 + N2 → CaCN2 + C
Commonly known as nitrolime, calcium cyanamide is used as fertilizer. It is hydrolysed to cyanamide, H2NCN.[5]
Steelmaking[edit]
Calcium carbide is used:
- in the desulfurization of iron (pig iron, cast iron and steel)[7]
- as a fuel in steelmaking to extend the scrap ratio to liquid iron, depending on economics.
- as a powerful deoxidizer at ladle treatment facilities.
Carbide lamps[edit]
Calcium carbide is used in carbide lamps. Water dripping on carbide produces acetylene gas, which burns and produces light. While these lamps gave steadier and brighter light than candles, they were dangerous in coal mines, where flammable methane gas made them a serious hazard. The presence of flammable gases in coal mines led to miner safety lamps such as the Davy lamp, in which a wire gauze reduces the risk of methane ignition. Carbide lamps were still used extensively in slate, copper, and tin mines where methane is not a serious hazard. Most miners’ lamps have now been replaced by electric lamps.
Carbide lamps are still used for mining in some less wealthy countries, for example in the silver mines near Potosí, Bolivia. Carbide lamps are also still used by some cavers exploring caves and other underground areas,[17] although they are increasingly being replaced in this use by LED lights.
Carbide lamps were also used extensively as headlights in early automobiles, motorcycles and bicycles, but have been replaced entirely by electric lamps.[18]
Other uses[edit]
Calcium carbide is sometimes used as source of acetylene, which like ethylene gas, is a ripening agent.[19] However, this is illegal in some countries as, in the production of acetylene from calcium carbide, contamination often leads to trace production of phosphine and arsine.[20][21] These impurities can be removed by passing the acetylene gas through acidified copper sulfate solution, but, in developing countries, this precaution is often neglected.
Calcium carbide is used in toy cannons such as the Big-Bang Cannon, as well as in bamboo cannons. In the Netherlands calcium carbide is used around new-year to shoot with milk churns.[22]
Calcium carbide, together with calcium phosphide, is used in floating, self-igniting naval signal flares, such as those produced by the Holmes’ Marine Life Protection Association.
Calcium carbide is used to determine the moisture content of soil. When soil and calcium carbide are mixed in a closed pressure cylinder, the water content in soil reacts with calcium carbide to release acetylene whose pressure can be measured to determine the moisture content.[23][24]
Calcium carbide is sold commercially as a mole repellent.[25] When it comes into contact with water, the gas produced drives moles away.[26]
References[edit]
- ^ a b Konar, Sumit; Nylén, Johanna; Svensson, Gunnar; Bernin, Diana; Edén, Mattias; Ruschewitz, Uwe; Häussermann, Ulrich (2016). «The many phases of CaC2». Journal of Solid State Chemistry. Elsevier BV. 239: 204–213. Bibcode:2016JSSCh.239..204K. doi:10.1016/j.jssc.2016.04.030. ISSN 0022-4596.
- ^ NFPA Hazard Rating Information for Common Chemicals. Northeastern University
- ^ Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. ISBN 0-07-049439-8.
- ^ Vincoli, Jeffrey Wayne (25 November 1996). Risk Management for Hazardous Chemicals. CRC Press. p. 429. ISBN 978-1-56670-200-3.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 298. ISBN 978-0-08-037941-8.
- ^ Calculated from data in the CRC Handbook of Chemistry and Physics.
- ^ a b Calcium Carbide[permanent dead link], Bernhard Langhammer, Ullmann’s Encyclopedia of Industrial Chemistry, Wiley Interscience. (Subscription required)
- ^ Freeman, Horace (1919). «Manufacture of Cyanamide». The Chemical News and the Journal of Physical Science. 117: 232.
- ^ Morehead, J. T. and de Chalmot, G. (1896). «The Manufacture of Calcium Carbide». Journal of the American Chemical Society. 18 (4): 311–331. doi:10.1021/ja02090a001.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Moissan, H. (1892). «Chimie Minérale – Description d’un nouveau four électrique». Comptes rendus hebdomadaires des séances de l’Académie des sciences. 115: 1031.
- ^ Renouf, Edward (1899). «The use of Acetylene». Popular Science Monthly: 335–347.
- ^ «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika». old.kons.gov.ba (in Serbo-Croatian). KONS. Retrieved 15 March 2019.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Dun, Ya (2006-01-23). «Troubles in the PVC industry». Hong Kong Trade Development Council. Archived from the original on 2007-12-28.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ «Government takes measures to curb development of calcium carbide sector». China Daily via BusyTrade.com. 2007-05-16. Archived from the original on 2007-02-11.
{{cite news}}: CS1 maint: bot: original URL status unknown (link) - ^ Lacson, Jamie; Schlag, Stefan; Toki, Goro (December 2004). «Calcium Carbide». SRI Consulting.
- ^ «Caving equipment and culture (from Te Ara Encyclopedia of New Zealand)».
- ^ Clemmer, Gregg (1987). American Miners’ Carbide Lamps: A Collectors Guide to American Carbide Mine Lighting. Westernlore Publications.
- ^ Abeles, F. B. and Gahagan, H. E. III (1968). «Abscission: The Role of Ethylene, Ethylene Analogues, Carbon Dioxide, and Oxygen». Plant Physiol. 43 (8): 1255–1258. doi:10.1104/pp.43.8.1255. PMC 1087003. PMID 16656908.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «Bet on it. Your mango is ripened using carbide». dna. 2013-05-18. Retrieved 2018-08-25.
- ^ «Eating Artificially Ripened Fruits is Harmful».
- ^ «Carbidschieten wordt feest» (in Dutch). Algemeen Dagblad. 2016-12-24.
- ^ Singh, Randhir (17 December 2008). «Determining Water Content In Soil – Calcium Carbide Method». Civil Engineering Portal. Retrieved 7 September 2020.
- ^ ASTM International. «ASTM D4944-18, Standard Test Method for Field Determination of Water (Moisture) Content of Soil by the Calcium Carbide Gas Pressure Tester». ASTM International. Retrieved 7 September 2020.
- ^ du Bois, T.M.E. (20 February 2014). «Molehill Mayhem». p. 21. hdl:1874/290102.
- ^ «How to Get Rid of Yard Moles With Carbide». mysunnylawn.com.
External links[edit]
- Calcium Carbide & Acetylene at The Periodic Table of Videos (University of Nottingham)
- Calcium Carbide Manufacturing
- 2008 Material Safety Data Sheet

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Calcium acetylide |
|
| Systematic IUPAC name
Calcium ethynediide |
|
| Other names
Calcium percarbide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.772 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CaC2 |
| Molar mass | 64.099 g/mol |
| Appearance | White powder to grey/black crystals |
| Density | 2.22 g/cm3 |
| Melting point | 2,160 °C (3,920 °F; 2,430 K) |
| Boiling point | 2,300 °C (4,170 °F; 2,570 K) |
|
Solubility in water |
Rapid hydrolysis |
| Structure[1] | |
|
Crystal structure |
Tetragonal (I phase) Monoclinic (II phase) Monoclinic (III phase) |
|
Space group |
I4/mmm (I phase) C2/c (II phase) C2/m (III phase) |
|
Coordination geometry |
6 |
| Thermochemistry | |
|
Std molar |
70 J·mol−1·K−1 |
|
Std enthalpy of |
−63 kJ·mol−1 |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Reacts with water to release acetylene gas[2] |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H260 |
| NFPA 704 (fire diamond) |
1 4 2
|
|
Autoignition |
305 °C (581 °F; 578 K) (acetylene) |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium carbide, also known as calcium acetylide, is a chemical compound with the chemical formula of CaC2. Its main use industrially is in the production of acetylene and calcium cyanamide.[3]
The pure material is colorless, while pieces of technical-grade calcium carbide are grey or brown and consist of about 80–85% of CaC2 (the rest is CaO (calcium oxide), Ca3P2 (calcium phosphide), CaS (calcium sulfide), Ca3N2 (calcium nitride), SiC (silicon carbide), etc.). In the presence of trace moisture, technical-grade calcium carbide emits an unpleasant odor reminiscent of garlic.[4]
Applications of calcium carbide include manufacture of acetylene gas, generation of acetylene in carbide lamps, manufacture of chemicals for fertilizer, and steelmaking.
Production[edit]
Calcium carbide is produced industrially in an electric arc furnace from a mixture of lime and coke at approximately 2,200 °C (3,990 °F).[5] This is an endothermic reaction requiring 110 kilocalories (460 kJ) per mole[6] and high temperatures to drive off the carbon monoxide. This method has not changed since its invention in 1892:
- CaO + 3 C → CaC2 + CO
The high temperature required for this reaction is not practically achievable by traditional combustion, so the reaction is performed in an electric arc furnace with graphite electrodes. The carbide product produced generally contains around 80% calcium carbide by weight. The carbide is crushed to produce small lumps that can range from a few mm up to 50 mm. The impurities are concentrated in the finer fractions. The CaC2 content of the product is assayed by measuring the amount of acetylene produced on hydrolysis. As an example, the British and German standards for the content of the coarser fractions are 295 L/kg and 300 L/kg respectively (at 101 kPa pressure and 20 °C (68 °F) temperature). Impurities present in the carbide include phosphide (fosgen), which produces phosphine when hydrolysed.[7]
This reaction was an important part of the industrial revolution in chemistry, and was made possible in the United States as a result of massive amounts of inexpensive hydroelectric power produced at Niagara Falls before the turn of the 20th century.[8]
The electric arc furnace method was discovered in 1892 by T. L. Willson, and independently in the same year by H. Moissan.[9][10][11] In Jajce, Bosnia and Herzegovina, the Austrian industrialist Dr. Josef Kranz and his «Bosnische-Elektrizitäts AG» company, whose successor later became «Elektro-Bosna», opened the largest chemical factory for the production of calcium carbide at the time in Europe in 1899. A hydroelectric power station on the Pliva river with an installed capacity of 8 MW was constructed to supply electricity for the factory, the first power station of its kind in Southeast Europe, and became operational on 24 March 1899.[12]
Crystal structure[edit]
Pure calcium carbide is a colourless solid. The common crystalline form at room temperature is a distorted rock-salt structure with the C22− units lying parallel.[13] There are three different polymorphs which appear at room temperature: the tetragonal structure and two different monoclinic structures.[1]
Applications[edit]
Production of acetylene[edit]
The reaction of calcium carbide with water, producing acetylene and calcium hydroxide,[5] was discovered by Friedrich Wöhler in 1862.
- CaC2(s) + 2H2O(aq) → C2H2(g) + Ca(OH)2(aq)
This reaction was the basis of the industrial manufacture of acetylene, and is the major industrial use of calcium carbide.
Today acetylene is mainly manufactured by the partial combustion of methane or appears as a side product in the ethylene stream from cracking of hydrocarbons. Approximately 400,000 tonnes are produced this way annually (see Acetylene Preparation).
In China, acetylene derived from calcium carbide remains a raw material for the chemical industry, in particular for the production of polyvinyl chloride. Locally produced acetylene is more economical than using imported oil.[14] Production of calcium carbide in China has been increasing. In 2005 output was 8.94 million tons, with the capacity to produce 17 million tons.[15]
In the United States, Europe, and Japan, consumption of calcium carbide is generally declining.[16] Production levels in the US during the 1990s were 236,000 tons per year.[13]
Production of calcium cyanamide[edit]
Calcium carbide reacts with nitrogen at high temperature to form calcium cyanamide:[5]
- CaC2 + N2 → CaCN2 + C
Commonly known as nitrolime, calcium cyanamide is used as fertilizer. It is hydrolysed to cyanamide, H2NCN.[5]
Steelmaking[edit]
Calcium carbide is used:
- in the desulfurization of iron (pig iron, cast iron and steel)[7]
- as a fuel in steelmaking to extend the scrap ratio to liquid iron, depending on economics.
- as a powerful deoxidizer at ladle treatment facilities.
Carbide lamps[edit]
Calcium carbide is used in carbide lamps. Water dripping on carbide produces acetylene gas, which burns and produces light. While these lamps gave steadier and brighter light than candles, they were dangerous in coal mines, where flammable methane gas made them a serious hazard. The presence of flammable gases in coal mines led to miner safety lamps such as the Davy lamp, in which a wire gauze reduces the risk of methane ignition. Carbide lamps were still used extensively in slate, copper, and tin mines where methane is not a serious hazard. Most miners’ lamps have now been replaced by electric lamps.
Carbide lamps are still used for mining in some less wealthy countries, for example in the silver mines near Potosí, Bolivia. Carbide lamps are also still used by some cavers exploring caves and other underground areas,[17] although they are increasingly being replaced in this use by LED lights.
Carbide lamps were also used extensively as headlights in early automobiles, motorcycles and bicycles, but have been replaced entirely by electric lamps.[18]
Other uses[edit]
Calcium carbide is sometimes used as source of acetylene, which like ethylene gas, is a ripening agent.[19] However, this is illegal in some countries as, in the production of acetylene from calcium carbide, contamination often leads to trace production of phosphine and arsine.[20][21] These impurities can be removed by passing the acetylene gas through acidified copper sulfate solution, but, in developing countries, this precaution is often neglected.
Calcium carbide is used in toy cannons such as the Big-Bang Cannon, as well as in bamboo cannons. In the Netherlands calcium carbide is used around new-year to shoot with milk churns.[22]
Calcium carbide, together with calcium phosphide, is used in floating, self-igniting naval signal flares, such as those produced by the Holmes’ Marine Life Protection Association.
Calcium carbide is used to determine the moisture content of soil. When soil and calcium carbide are mixed in a closed pressure cylinder, the water content in soil reacts with calcium carbide to release acetylene whose pressure can be measured to determine the moisture content.[23][24]
Calcium carbide is sold commercially as a mole repellent.[25] When it comes into contact with water, the gas produced drives moles away.[26]
References[edit]
- ^ a b Konar, Sumit; Nylén, Johanna; Svensson, Gunnar; Bernin, Diana; Edén, Mattias; Ruschewitz, Uwe; Häussermann, Ulrich (2016). «The many phases of CaC2». Journal of Solid State Chemistry. Elsevier BV. 239: 204–213. Bibcode:2016JSSCh.239..204K. doi:10.1016/j.jssc.2016.04.030. ISSN 0022-4596.
- ^ NFPA Hazard Rating Information for Common Chemicals. Northeastern University
- ^ Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. ISBN 0-07-049439-8.
- ^ Vincoli, Jeffrey Wayne (25 November 1996). Risk Management for Hazardous Chemicals. CRC Press. p. 429. ISBN 978-1-56670-200-3.
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 298. ISBN 978-0-08-037941-8.
- ^ Calculated from data in the CRC Handbook of Chemistry and Physics.
- ^ a b Calcium Carbide[permanent dead link], Bernhard Langhammer, Ullmann’s Encyclopedia of Industrial Chemistry, Wiley Interscience. (Subscription required)
- ^ Freeman, Horace (1919). «Manufacture of Cyanamide». The Chemical News and the Journal of Physical Science. 117: 232.
- ^ Morehead, J. T. and de Chalmot, G. (1896). «The Manufacture of Calcium Carbide». Journal of the American Chemical Society. 18 (4): 311–331. doi:10.1021/ja02090a001.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Moissan, H. (1892). «Chimie Minérale – Description d’un nouveau four électrique». Comptes rendus hebdomadaires des séances de l’Académie des sciences. 115: 1031.
- ^ Renouf, Edward (1899). «The use of Acetylene». Popular Science Monthly: 335–347.
- ^ «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika». old.kons.gov.ba (in Serbo-Croatian). KONS. Retrieved 15 March 2019.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Dun, Ya (2006-01-23). «Troubles in the PVC industry». Hong Kong Trade Development Council. Archived from the original on 2007-12-28.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ «Government takes measures to curb development of calcium carbide sector». China Daily via BusyTrade.com. 2007-05-16. Archived from the original on 2007-02-11.
{{cite news}}: CS1 maint: bot: original URL status unknown (link) - ^ Lacson, Jamie; Schlag, Stefan; Toki, Goro (December 2004). «Calcium Carbide». SRI Consulting.
- ^ «Caving equipment and culture (from Te Ara Encyclopedia of New Zealand)».
- ^ Clemmer, Gregg (1987). American Miners’ Carbide Lamps: A Collectors Guide to American Carbide Mine Lighting. Westernlore Publications.
- ^ Abeles, F. B. and Gahagan, H. E. III (1968). «Abscission: The Role of Ethylene, Ethylene Analogues, Carbon Dioxide, and Oxygen». Plant Physiol. 43 (8): 1255–1258. doi:10.1104/pp.43.8.1255. PMC 1087003. PMID 16656908.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «Bet on it. Your mango is ripened using carbide». dna. 2013-05-18. Retrieved 2018-08-25.
- ^ «Eating Artificially Ripened Fruits is Harmful».
- ^ «Carbidschieten wordt feest» (in Dutch). Algemeen Dagblad. 2016-12-24.
- ^ Singh, Randhir (17 December 2008). «Determining Water Content In Soil – Calcium Carbide Method». Civil Engineering Portal. Retrieved 7 September 2020.
- ^ ASTM International. «ASTM D4944-18, Standard Test Method for Field Determination of Water (Moisture) Content of Soil by the Calcium Carbide Gas Pressure Tester». ASTM International. Retrieved 7 September 2020.
- ^ du Bois, T.M.E. (20 February 2014). «Molehill Mayhem». p. 21. hdl:1874/290102.
- ^ «How to Get Rid of Yard Moles With Carbide». mysunnylawn.com.
External links[edit]
- Calcium Carbide & Acetylene at The Periodic Table of Videos (University of Nottingham)
- Calcium Carbide Manufacturing
- 2008 Material Safety Data Sheet
| Карбид кальция | |
 |
|
 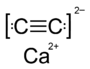 |
|
| Общие | |
|---|---|
| Систематическое наименование | Кальция карбид |
| Химическая формула | CaC2 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 64.099 г/моль |
| Плотность | 2.22 г/см³ |
| Термические свойства | |
| Температура плавления | 2160 °C |
| Температура кипения | 2300 °C |
| Структура | |
| Координационная геометрия | 6 |
| Кристаллическая структура | Тетрагональная |
| Классификация | |
| Рег. номер CAS | 75-20-7 |
Карби́д ка́льция (углеро́дистый ка́льций, ацетилени́д кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Соединение кальция с углеродом.
История получения
Впервые получен в 1862 г. Ф. Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
Полученный таким образом технический продукт имеет грязную окраску вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Свойства
При соединении с водой разлагается, образуя ацетилен и гидроксид кальция (гашеную известь).
- CaC2 + 2H2O → C2H2 + Ca(OH)2
Применение
Карбид кальция широко применяют в технике для производства ацетилена, цианамида кальция (при нагревании с азотом), а также для восстановления щелочных металлов.
См. также
- Карбидная лампа
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
|
Соединения кальция |
|---|
|
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3)2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH4)2) • Титанат кальция (CaTiO3) • Триметафосфат кальция (Ca3(P3O9)2) • Флюорит (CaF2) • Формиат кальция (Ca(HCOO)2) • Фосфид кальция (Ca3P2) • Фторид кальция (CaF2) • Хлорат кальция (Ca(ClO3)2) • Хлорид кальция (CaCl2) • Хлорная известь (Ca(Cl)OCl) • Хромат кальция (CaCrO4) • Цианамид кальция (CaCN2) • Цианид кальция (Ca(CN)2) • Цитрат кальция (Ca3(C6H5O7)2) • |
| Карбид кальция | |
|---|---|
  |
|
| Систематическое наименование |
Кальция карбид |
| Традиционные названия | Ацетиленид кальция; углеродистый кальций |
| Хим. формула | CaC2 |
| Рац. формула | CaC2 |
| Состояние | твёрдое |
| Молярная масса | 64,0994 (±0,004) г/моль |
| Плотность | 2,22 г/см³ |
| Т. плав. | 2160 °C |
| Т. кип. | 2300 °C |
| Координационная геометрия | 6 |
| Кристаллическая структура | Тетрагональная |
| ГОСТ | ГОСТ 1460-81 ГОСТ 1460-2013 |
| Рег. номер CAS | 75-20-7 |
| PubChem | 6352 |
| Рег. номер EINECS | 200-848-3 |
| SMILES |
[C-]#[C-].[Ca+2] |
| InChI |
1S/C2.Ca/c1-2;/q-2;+2 UIXRSLJINYRGFQ-UHFFFAOYSA-N |
| RTECS | EV9400000 |
| ChemSpider | 6112 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Карбид кальция (углеродистый кальций, ацетиленид кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Содержание
- 1 История получения
- 2 Получение
- 3 Физические свойства
- 4 Химические свойства
- 5 Внешний вид и характеристики технического карбида кальция
- 6 Область применения карбида кальция
- 7 Физиологическое действие

История получения
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
-
- CaO + 3C → CaC2 + CO
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
-
- CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Представленная выше реакция является экзотермической.
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Область применения карбида кальция
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Карбид кальция имеет резкий чесночный запах и сильно поглощает воду. Его плотность повышается с увеличением количества примесей и изменяется в пределах 2,22-2,8 г/см3. Молекулярная масса — 64,102. Технический карбид кальция выпускают по ГОСТ 1460.
Содержание
- История получения
- Получение
- Гидролиз
- Количество воды необходимое для реакции
- Параметры влияющие на скорость реакции
- Карбид кальция плюс азот
- Карбид кальция плюс водород
- Хранение
- Карбид кальция
- химическое соединение кальция с углеродом, в чистом виде представляющее собой белое кристаллическое вещество. Химическая формула — СаС2

- Технический карбид кальция
- твердый кускообразный материал, цвет излома которого меняется в зависимости от содержания карбида кальция. При содержании 60-75% СаС2 — имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC2. Высокопроцентный (80% СаС2 и выше) — имеет окраску от светло-коричневого до голубовато-черного.
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
|---|---|---|---|---|---|
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
|---|---|---|---|---|---|---|
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2.45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
|---|---|
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Гидролиз или карбид кальция плюс вода
При взаимодействии карбида кальция и воды происходит реакция, которая называется гидролиз. Когда-то гидролиз карбида кальция был основным промышленным способом для получения ацетилена — горючего газа, применяемого при газовой сварке и газовой резке. Еще об одном способе получения можно узнать из статьи о получении ацетилена.
При взаимодействии карбида кальция (CaC2) с водой (H2O) получается газ — ацетилен (C2H2) и гашеная известь (Ca(OH)2), являющаяся отходом. Химическая активность карбида кальция по отношению к воде столь велика, что он разлагается даже кристаллизационной водой, содержащейся в солях.
Экзотермическая реакция (т.е. с выделением тепла) взаимодействия карбида кальция с водой протекает бурно по уравнению:
CaC2+2H2O=C2H2+Ca(OH)2 +30,4 ккал/моль
Тепловой эффект реакции слагается из тепла, выделяемого при взаимодействии с водой карбида кальция и негашеной извести. Взаимодействие извести с водой протекает по уравнению:
СаО+H2O = Ca(OH)2 +15,2 ккал/моль
- Выход ацетилена
- объем ацетилена в литрах, выделяемый при разложении 1 кг карбида, приведенный к 20° и 760 мм рт. ст.
Для разложения 1 кг химически чистого карбида кальция теоретически необходимо 0,562 кг воды, при этом получается 0,406 кг ацетилена (285 л) и 1,156 кг гашеной извести.
Значительный тепловой эффект реакции карбида кальция и опасность перегрева ацетилена заставляют вести процесс с большим избытком воды для охлаждения. Это делает процесс более безопасным. Температура выходящего из генератора ацетилена при этом превышает температуру окружающей среды всего на 10-15°С.
Количество воды необходимое для реакции с карбидом кальция
Минимальное количество воды, необходимое для охлаждения при реакции 1 кг карбида кальция, может быть рассчитано следующим образом.
При разложении 1 кг 70%-го карбида кальция образуется 0,284 кг ацетилена и 1,127 кг гидрата окиси кальция т.е. гашеной извести (принимая содержание окиси кальция в карбиде кальция равным 24%).
Принимаем, что начальная температура воды равна 15° С, а температура в генераторе во время работы равна 60° С. Уравнение теплового баланса для 1 кг карбида кальция выражается следующим образом:
q=q1+q2+q3+q4+q5
где q — количество тепла, выделяющееся при разложении 1 кг 70%-го карбида кальция, равное 397 ккал/кг
q1 — количество тепла, затрачиваемое на нагревание получаемой гашеной извести с 15 до 60°С:
q1= 1,127?(60-15)-0,23= 11,7 ккал
0,23 — средняя теплоемкость гидрата окиси кальция в ккал/кг
q2 — количество тепла, затрачиваемое на нагревание получаемого ацетилена с 15 до 60° С:
q2=0,284?(60-15)-0,336 = 4,3 ккал
0,336 — средняя теплоемкость 1 кг ацетилена в ккал в указанном интервале температур
q3 — тепло, затрачиваемое на испарение воды в количестве 0,034 кг (при 60° С содержание водяных паров, насыщающих ацетилен, полученный из 1 кг карбида кальция, равно 34 г) скрытая теплота парообразования воды — 539 ккал/кг
q3 = 0,034?539+0,034?1?(60-15) -19,9 ккал
q4 — потеря тепла в окружающую среду и на нагревание стенок генератора, она составляет примерно 7% от общего количества выделяющегося тепла:
q4=397?7/100=27,8 ккал
q5 — количество тепла, расходуемое на нагревание воды до температуры 60° С:
q5=q?(q1+q2+q3+q4)=397?(11,7+4,3+19,9+27,8) = 336,3 ккал
Искомый минимальный безопасный объем воды равен:
V=q5/(60-15)?1=336,3/45?7,5 л
Так как 1 м3 ацетилена при абсолютном давлении 1 кгс/мм2 и 20°С весит 1,09 кг, следовательно, из 1 кг химически чистого карбида кальция теоретически можно получить 0,406/1,09 = 0,3725 м3, или 372,5 л ацетилена.
Как уже говорилось выше, технический карбид кальция обычно содержит не более 70-80% CaC2. Поэтому из 1 кг технического карбида кальция можно получить от 230 до 280 л ацетилена.
Если учесть потери ацетилена на растворение в воде и продувку ацетиленового генератора, то для получения 1 м3 (1000 дм3) ацетилена практически приходится расходовать 4,3-4,5 кг карбида кальция. Более точные данные о фактическом выходе ацетилена в зависимости от количества примесей (сорта) и размеров «кусков» (грануляции) указаны в ГОСТ 1460.
Параметры влияющие на скорость реакции с водой
Чем меньше размеры кусков, тем быстрее происходит реакция карбида кальция с водой.
Карбид кальция размером 50?80 мм разлагается полностью в течение 13 мин, а размером 8?15 мм — в течение 6,5 мин.
При величине кусков менее 2 мм карбид кальция считается отходом и называется карбидной пылью. Карбидная пыль разлагается практически мгновенно. При взаимодействии с водой реакция карбидной пыли происходит на поверхности воды и выделяемое тепло не может быть быстро отведено. Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Чем выше температура воды, тем быстрее идет реакция карбида кальция. Если вода сильно загрязнена гашеной известью, образующейся при реакции карбида кальция, то реакция замедляется.
При разложении неподвижного карбида кальция в недостаточном количестве воды куски его могут покрываться коркой гашеной извести и сильно перегреваться, при этом может иметь место реакция:
СаС2+Ca(ОН)2 = C2H2+2СаО
В этом случае реакция карбида кальция происходит за счет отнятия влаги, содержащейся в гашеной извести. В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
Если производить разложение одинаковых количеств карбида кальция различными постепенно уменьшающимися количествами воды, то температура получаемой смеси ацетилен — водяной пар будет соответственно повышаться. При температуре около 90°С почти все тепло (за исключением тепла, затрачиваемого на нагревание ацетилена и карбидного ила) расходуется на образование водяного пара. Эти условия реакции соответствуют процессу, при котором получается сухой гидрат окиси кальция, поскольку вся вводимая в реакцию вода расходуется на разложение карбида и образование водяного пара.
При погружении карбида кальция в воду процесс разложения протекает также весьма неравномерно: вначале реакция идет очень активно с бурным выделением ацетилена, а затем скорость реакции уменьшается. Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
При перемешивании воды с находящимся в ней карбидом кальция реакция происходит быстрее и равномернее.
Скорость реакции карбида кальция в воде зависит от чистоты карбида кальция и поверхности соприкосновения кусков карбида кальция с водой.
Скорость реакции карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Для практических целей пользуются понятием продолжительности разложения.
Продолжительностью разложения считают время, в течение которого выделяется 98% от всего количества ацетилена, который может быть выделенным из карбида кальция, так как остаток разлагается очень медленно и не характеризует процесс разложения применительно к условиям работы ацетиленовых генераторов.
В таблице ниже приведены экспериментальные данные о продолжительности разложения карбида кальция в зависимости от размеров его кусков.
| Размеры кусков, мм | Пыль | 2/4 | 5/8 | 8/15 | 15/25 | 25/50 | 50/80 |
|---|---|---|---|---|---|---|---|
| Продолжительность разложения, мин. | Несколько секунд | 1,17 | 1,65 | 1,82 | 4,23 | 13,5 | 16,6 |
Следует, оговорить, что данные таблицы характеризуют лишь те образцы карбида кальция, с которыми были проведены опыты. Практически могут иметь место значительные отклонения, главным образом в сторону уменьшения скорости реакции.
Скорость разложения в значительной степени зависит от выхода ацетилена из карбида кальция. Чем ниже выход, тем меньше скорость реакции.
На диаграмме ниже показаны изменения в скорости разложения карбида кальция двух сортов с одинаковыми размерами кусков (25/50).
При разложении 1 кг карбида кальция с выходом ацетилена 263 л/кг за первые 3 минуты выделяется 220 л ацетилена, а соответственно при выходе 226 л/кг — только 150 л.
Карбид кальция плюс азот
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция. Уравнение реакции имеет следующий вид:
CaC2+N2=CaCN2+C
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
Карбид кальция плюс водород
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Хранение карбида кальция
После того как был получен карбид кальция хранение его допускается в специальных герметичных барабанах и специально оборудованных помещениях, но все это уже рассмотрено в статье о том, где и как хранить карбид кальция.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
[▼]
|
Применить к найденному
Карбид кальция
Брутто-формула:
C2Ca
CAS# 75-20-7
Категории:
Бинарные соединения
PubChem CID: 6352
Названия
Русский:
- Кальция карбид
- Карбид кальция [Wiki]
Варианты формулы:
CaC2
C`^-_(x1,N3)C^-_(x#-1;-2,y-1,N0)Ca^2+
C_(x1.2,N3)C_q3Ca_q3
Химический состав
Реакции, в которых участвует Карбид кальция
-
CaC2 + N2 «1000^oC»—> Ca(CN)2
-
CaO + 3C «1900^oC»—> CaC2 + CO
-
CaC2 + 2H2O → HC%CH + Ca(OH)2
-
CaCO3 + 4C «1500^oC»—> CaC2 + 3CO»|^»
КАРБИД КАЛЬЦИЯ, СаС2, твердое кристаллическое вещество удельного веса от 2,2 до 2,28; температура плавления точно не установлена и указывается в пределах 1850—2300°. Излом технического карбида кальция, в зависимости от условий получения, меняется от землистого до ярко выраженного кристаллического; различен бывает и цвет его, изменяющийся от серого до блестяще-черного, часто опалесцирующего; химически чистый продукт бесцветен.
Химические свойства. Строение молекулы карбида кальция выражается формулой
в отсутствии влаги при обыкновенных температурах металлы и кислород воздуха на него не действуют; при этих же условиях слабо действуют на него и крепкие кислоты. При высоких температурах химическая активность карбида кальция повышается, и при температуре около 1000° он вступает в химическое взаимодействие даже с азотом по уравнению:
CaC2 + N2 = CaСN2 + С
При взаимодействии с водой карбид кальция даже на холоде разлагается с бурным выделением ацетилена, С2Н2; реакция сопровождается выделением большого количества тепла и выражается уравнением:
СаС2 + 2Н2О = C2H2 + Са(ОН)2 +414,6 Cal.
Указанная реакция идет даже под влиянием атмосферной влаги, причем куски карбида кальция покрываются слоем гашеной извести, которая сообщает им светло-серый цвет; в виду этого карбид кальция должен храниться только в герметичной упаковке. 1кг химически чистого карбида кальция дает 406,25 грамм ацетилена, который при 0° и 760 мм Hg занимает объем в 348,7 литров.
Впервые карбид кальция был получен Геру в 1840 г. при опытах с электрической печью; Вёлер, получивший более значительное количество карбида кальция в 1862 г. при сплавлении кальция с углем, имел возможность изучить его свойства. В 1890 г. Муассан получил карбид кальция при плавлении в электрической печи негашеной извести, которая давала упомянутый продукт, вступая во взаимодействие с углем электродов печи. В 1894 г. сотрудником Муассана, Бюлье, был заявлен во Франции первый патент на промышленный способ получения карбида кальция, который в основе и до сих пор остается тем же. В том же году была построена первая электрическая карбидная печь, и тем положено начало производству карбида кальция, которое в настоящее время выражается в млн. тонн.
Современное промышленное производство карбида кальция основано на восстановлении окиси кальция при высоких температурах углеродом и взаимодействии восстановленного кальция с углем. Этот процесс отвечает следующему уравнению:
2СаО + ЗС2 = 2СаС2 + 2СО –210700 Cal.
Реакция эта сильно эндотермична, а потому может идти только в присутствии интенсивного источника тепла, каким является вольтова дуга электрической печи. Реакция представляет собою обратимый процесс. Система моновариантна: каждой при равновесии соответствует определенная упругость СО. Какова минимальная температура, при которой начинается образование карбида кальция с точностью не установлено; большинство исследователей считают, что она лежит между 1800 и 1900°. При температуре около 2500° плавится известь; в расплавленном состоянии последняя служит растворителем для карбида, что значительно облегчает дальнейший ход реакции. Сам карбид кальция в условиях его образования в печи имеет тестообразную консистенцию и только при дальнейшем повышении температуры становится жидким. При очень сильном перегреве образовавшийся карбид кальция разлагается по уравнению:
CaC2 = Сa + 2С.
Особенностью производства карбида кальция является отсутствие побочных продуктов, т. к. примеси, содержащиеся в исходных материалах (если количество их не превосходит известной границы), растворяются в образовавшемся карбиде, не вредя его техническим качествам и лишь несколько понижая процентное содержание СаС2, а вследствие этого и выход ацетилена.
Теоретически для получения карбида кальция может служить и углекислый кальций, но на практике он не применяется из-за излишнего расхода электродов и энергии, вызываемого следующими эндотермическими реакциями:
СаСО3 = СаО + СО2 и СО2 + С = 2СО.
Для производства карбида кальция служит исключительно негашеная известь, которая в большинстве случаев получается тут же на карбидных заводах, разрабатывающих близлежащие залежи известняков. Известняк, идущий в обжиг, д. б. относительно чистым и содержать, во всяком случае, не меньше 97 % СаСО3 с тем, чтобы в полученной из него жженой извести заключалось не более 4—5% примесей в виде SiО2, Аl2О3 и Fe2О3. Наиболее неприятной является примесь MgO, присутствие которой в количестве 3—4% может заметно уменьшить производительность печей и даже вызвать их остановку, т. к. магнезия не образует карбида с углеродистыми материалами и затрудняет растворение карбида кальция в извести; содержание MgO в известняке не должно превышать 0,5%. Фосфаты и сульфаты могут содержаться только в виде следов; максимально допустимым считается: 0,01% для фосфатов и 0,3% для сульфатов. Эти примеси известняка целиком переходят в карбид в виде фосфористого и сернистого кальция — примесей, чрезвычайно нежелательных при использовании карбида кальция. Обожженная известь, идущая в производство, д. б. в виде достаточно плотных, не легко выветривающихся кусков; лучше всего употреблять ее в дело сейчас же по выходе из печи, раздробив на куски размером 50—60 мм с возможно меньшим содержанием пыли.
Углеродистый материал для карбидного производства должен быть также очень чистым, что способствует правильному ходу печи и повышению КПД. Применяют или малозольный антрацит или газовый кокс с минимальным содержанием золы. До войны 1914—18 гг. максимальной нормой содержания золы считалось 9%; в настоящее время допускают некоторое превышение этой нормы, но по возможности оно д. б. минимальным.
Кокс, прибывающий с газовых заводов очень сырым, предварительно тщательно просушивают до содержания влаги в нем ниже 1%; на крупных заводах просушивание кокса производят во вращающихся сушилках. Газовый кокс очень электропроводен и порист, что позволяет ему легко реагировать с известью. Древесный уголь, особенно твердых пород, также является превосходным сырьем для карбидного производства, т. к. он порист, содержит мало золы и вредных примесей; он увеличивает КПД карбидной печи и дает продукт высокого качества, но по экономическим причинам применение его ограничено. Антрацит очень плотен, трудно реагирует и пригоден только при работе на мощных печах. При небольшом содержании золы (иногда около 5%) он имеет преимущество перед коксом.
Фосфор и сера в углеродистом материале менее вредны, чем в извести, т. к. значительная часть их при процессе улетучивается; поэтому в углеродистом материале допустимо содержание фосфора до 0,01—0,02%, а серы — до 1,25%. Чем чище известь, тем больше примесей можно допустить в углеродистом материале.
Карбидные печи. Во избежание явлений электролиза в карбидных печах применяют переменный ток. В зависимости от рода установки питают печи либо однофазным, либо трехфазным током. По принципу работы карбидные печи делятся на: а) печи периодического действия, из которых карбид кальция извлекают в твердом состоянии, после остывания, б) печи непрерывного действия, из которых продукт выпускают в расплавленном виде через особое выпускное отверстие. Периодически работа с образованием в печи застывшего блока карбида кальция характерна для первоначального периода карбидной промышленности и в настоящее время почти не применяется. Первые карбидные печи строились мощностью в 100—300 kW и имели вид небольших четырехугольных железных тиглей, установленных на вагонетках. Довольно часто применявшийся тип печи представлен на фиг. 1.
Дно печи имеет угольную футеровку А и является одним из электродов, второй электрод Б входит сверху; В — канал для отвода СО. Способ работы в таких печах основан на электропроводности нагретого карбида. Несколько печей включаются в цепь последовательно, причем на каждую приходится напряжение в 35—40 V. При опускании верхнего электрода между ним и подом печи образуется вольтова дуга, и тогда производят засыпание приготовленной шихты: после расплавления значительной части шихты снова засыпают дугу. Для поддержания постоянной силы тока верхний электрод делается подвижным. Работа в периодических печах продолжается до тех пор, пока карбид не заполнит тигля на всю высоту. В виду того что теплоемкость и скрытая теплота плавления карбида незначительны, он довольно быстро застывает, после чего печь выключают, увозят и заменяют новой. Карбид легко отделяется от пода печи; блок вынимают при помощи крана и оставляют на 12—24 часа для полного остывания, после чего уже приступают к отделению непрореагировавшей шихты и дроблению карбида.
Значительным прогрессом явилось введение печей большей мощности, до 450—500 kW, без нижнего контакта, но с двумя отдельными подвесными электродами с самостоятельной регулировкой каждого. Устройство такой печи представлено на фиг. 2; в ней образуются две последовательно включенные дуги.
Преимуществом такого устройства печи является высокое напряжение в сети и низкое напряжение на поду печи; карбид здесь по мере своего образования выходит из сферы действия тока, который проходит только через верхний слой. В начале работы образуются два отдельных блока, которые затем сливаются в один большой, до 1 тонны весом. Эти печи работают значительно экономичнее малых и по своей конструкции представляют собою переход к современным большим многоподовым печам.
Способ периодической работы несовершенен с технической стороны и неэкономичен. Здесь неминуемы значительные потери шихты, т. к. в готовом блоке годного карбида кальция иногда содержится только около 50% по весу; кроме того, периодическая работа связана с неэкономичным использованием энергии и электродов, а обслуживание печи, ее чистка, дробление и сортировка блоков требуют значительного количества рабочих рук. Устранение этих неудобств было связано с разрешением проблемы непрерывного процесса, с периодическим выпуском готового продукта из печи в расплавленном виде.
Главным затруднением на этом пути являлось быстрое застывание карбида кальция в печи: высокая электропроводность расплавленного карбида заставляет поднимать верхний электрод, т. е. удалять вольтову дугу от пода, вследствие чего нижняя часть блока затвердевает; открытие выпускного отверстия (очка) становится крайне затруднительным, а при застывшем слое в 15—20 см — и совершенно невозможным. Поэтому, во избежание закупорки очка, карбиду не дают застывать в канале, для чего утолщенным концом лома проталкивают загустевший карбид внутрь печи, так что сам канал остается свободным. Кроме того, при печах большой мощности (600 kW и выше) прибегают к периодическому проплавлению корки при помощи вольтовой дуги, для чего соединенный с верхним электродом железный лом (иногда угольный стержень) вводится в выпускное отверстие и дает вольтову дугу, которая и расплавляет застывший карбид. Окончательно задача получения карбида кальция непрерывным процессом была разрешена в 1904—07 гг. постройкой печей очень большой мощности, измеряемой тысячами kW. Конструкции таких печей чрезвычайно разнообразны: иногда нижняя часть печи служит одним из электродов; другой же электрод подвешивают подвижно в верхней части печи
(фиг. 3, где А — верхний электрод, В — огнеупорная футеровка); иногда оба электрода А располагают горизонтально (фиг. 4, шведская трехфазная печь).
В последнее время получили широкое распространение трехфазные печи, имеющие три электрода, расположенных в верхней части; ток проходит от одного электрода к другому через раскаленную смесь, которая образует сопротивление. На фиг. 5 показана такая трехфазная печь с тремя вертикальными электродами А и гибкими голыми медными шинами С.
Современные печи для карбида кальция работают почти всегда сопротивлением, т. е. рассчитаны т. о., что во время работы печи смесь исходных материалов образует источник сопротивления; карбид кальция в расплавленном виде стекает на под печи, а вновь засыпаемая шихта замещает прореагировавшую и постепенно поступает в реакционную зону. Конец электрода погружают в смесь на десятки сантиметров; вся работа обслуживающего персонала, помимо засыпки шихты, заключается в том, чтобы не давать белому огню вольтовой дуги прорываться наружу, что достигается путем скучивания шихты вокруг верхнего электрода и путем пробивания образующихся сводов из спекшейся шихты. Это пробивание предупреждает образование корок, которые могут в процессе охлаждения печи образоваться по всему периметру печной шахты и уменьшить КПД вследствие возникновения частичных коротких замыканий тока.
Печи с открытой вольтовой дугой в течение последних 15—20 лет для производства карбида кальция не применяются, т. к. их работа сопровождается образованием местных перегревов, ведущих к диссоциации образуемого карбида, что в свою очередь вызывает излишнюю потерю энергии и материалов, нерегулярную работу, усиленное выделение пыли и горячих газов, которые затрудняют работу обслуживающего персонала, и значительный расход электродов при уменьшенной отдаче печи.
Мощность печей, при начале развития карбидного производства не превышавшая 350—500 kW, в настоящее время доходит до 1500, 3000, 6000 и даже 12000 kW (последнее исключительно для трехфазных печей). Круглые печи на 1000 kW имеют диаметр 2,25—2,5 м, квадратные печи той же мощности имеют сечение от 2,25×2,25 до 2,75×2,75 м. Современная трехфазная печь на 4000—4500 kW имеет следующие примерные размеры: длина 9 м, ширина 3 м и высота 2,5 м. При агрегатах большей мощности работа, вследствие высокой температуры и испарений из печи, в высшей степени затруднительна. На каждую тонну получаемого карбида кальция выделяется из печи около 0,44 тонны окиси углерода, СО, которая в печах с открытой шахтой по выходе из слоя шихты сгорает в углекислый газ, СО2.
Для улучшения условий работы и использования СО, что может возвратить около 30% энергии, полезно затрачиваемой на выработку карбида, современная техническая мысль работает над конструкцией закрытой печи. Примером такой печи может служить изображенная на фиг. 6 печь, предложенная А. Гельфенштейном.
Практическое осуществление закрытых печей встречает большие затруднения вследствие того, что СО с воздухом образует взрывчатую смесь. Так как весьма трудно при высоких температурах, господствующих в печи, достигнуть полной герметичности и избежать подсоса воздуха, работа с такими печами становится опасной и как следствие часто случаются взрывы. В виду этого ни одна из существующих конструкций закрытых карбидных печей не получила широкого распространения в технике, и разработка таких печей носит пока экспериментальный характер.
Для получения в печи температуры около 3000°, требующейся для хода непрерывного процесса, необходимо установить надлежащую плотность тока на электродах. Низшей границей плотности тока считается 2 А/см2, верхний предел зависит от свойств материала электродов; при нагрузке 8—9 А/см2 угольные электроды накаляются докрасна по всей длине до зажимов. Для смешанного нагревания (вольтовой дугой и сопротивлением), применяемого в современных печах Гельфенштейна, установлено следующее правило: чем выше рабочее напряжение, тем больше д. б. взята плотность тока. При наиболее распространенных в настоящее время рабочих напряжениях в 50—90 V плотность тока, должна находиться в пределах 3—6 А/см2 в зависимости от характера электродов. В карбидных печах применяются гл. обр. твердые обожженные электроды, изготовляемые из смеси малозольного антрацита, ретортного угля и нефтяного кокса с каменноугольной смолой и пеком. Хорошие электроды должны обладать однородной структурой, высокой механической прочностью и высокой электропроводностью. В практике применяются электроды в форме цилиндров или брусков прямоугольного сечения. Наибольшие размеры электродов в американской промышленности достигают 5 метров длины при квадратном сечении до 95 х 95 см; в Западной Европе электроды готовят длиной до 3 метров при сечении до 60 х 60 см. Однако, чаще применяются электроды меньших размеров (25 x 25 x 200 см; 40 х 40 x 250 см; и т. п.). При больших амперных нагрузках современных печей такие электроды собирают в пакеты. Весьма важную роль в конструкции печи играют зажимы для электродов, соединяющие медный проводник, подводящий ток к печи с электродом. В зависимости от размера печи, формы электродов и от того, применяется или не применяется водяное охлаждение, типы зажимов бывают крайне разнообразны. Во всякого рода зажимах части, служащие для подвода тока, изготовляют из меди или бронзы; те же части, которые непосредственно прилегают к поверхности электродов, готовят из железа, стали или литой стали. Плотность тока для зажимов с водяным охлаждением допускается в 7—8 А на см2 поверхности контакта; при отсутствии охлаждения она не должна превышать 3—4 А на см2 контактной поверхности. В последнее время в карбидной промышленности начали получать широкое распространение т. н. «непрерывные мягкие электроды» Зедерберга; они достигают нескольких метров высоты, благодаря чему верхняя часть электрода находится на значительном расстоянии от раскаленной части печи в специально устроенной кабине А (фиг. 7).
Электрод имеет рубашку из тонкого котельного железа с отверстиями на боковой поверхности для выхода газов; внутри рубашки располагается несколько железных ребер, придающих ей некоторую жесткость. Внутренняя полость рубашки заполняется специальной сильно спекающейся угольной массой. Работа по набивке и утрамбовке массы производится в упомянутой кабине, что дает возможность наращивать электрод сверху, не прерывая работы печи. Электроды Зедерберга значительно дешевле твердых угольных электродов, хотя, с другой стороны, расход их на 1 тонну карбида кальция примерно в два раза больше, чем обычных твердых, и они должны иметь большие размеры, так как амперная нагрузка их не должна превышать 3—4 А/см2.
Наиболее дорогостоящей частью печей большой мощности являются медные шины, связывающие электроды с трансформаторами. Эти шины на некотором протяжении д. б. обязательно гибкими, чтобы по мере израсходования электродов последние можно было опускать; вместе с тем шины должны допускать и передвижение электродов в стороны. Б. ч. они состоят из серии медных кабелей малого диаметра, примыкающих к жесткой части держателей электродов, состоящих из медных пластин. Нормальная плотность тока в шинах — до 1,5 А/мм2.
Амперная нагрузка печи регулируется перемещением подвижных электродов при помощи лебедок. На малых печах такие лебедки имеют ручной привод, а на больших печах с электродными пакетами они работают от моторов. В новейших установках часто пользуются автоматическими регуляторами Тьюри (Thury), изготовляемыми фирмой Гено (Н. Guenod) близ Женевы, или регуляторами фирмы Сименс-Шуккерт.
Ход производства. Для получения 1 тонны карбида кальция, согласно теоретическим подсчетам, требуется 900 кг негашеной извести, СаО, и 560 кг углерода. Практический же расход материалов, в зависимости от конструкции печи, ее мощности и условий работы, показан в табл. 1.
Дозировка исходных материалов производится путем взвешивания каждого из продуктов, причем количество извести м. б. незначительно изменено в зависимости от того, какого качества желательно получить продукт. Некоторый избыток извести благоприятствует реакции. Выгорание углерода шихты в открытых печах, происходящее от соприкосновения с воздухом, компенсируется углеродом электродов.
3аводы, эксплуатирующие одновременно несколько печей, устанавливают их обычно в одну линию в просторных помещениях с хорошей вентиляцией. Углеродистый материал и известь, предварительно раздробленные и смешанные в аппаратах, снабженных автоматическими весами, подвозят к верхней части печи транспортером, снабжённым специальными ковшами для засыпки. На крупных заводах материалы подвозят в железнодорожных вагонах прямо в заводские склады с сильно покатым полом, по которому они самотеком направляются к дробилкам типа Блека. После дробления эти материалы механическими элеваторами поднимают в специальные закромы, откуда они стекают в двое автоматических весов. С весов материалы одновременно передают на транспортеры, которые сбрасывают их в один общий сток. Таким образом, приготовленная смесь подается при помощи вагонеток к электрическим печам в загрузочные ковши. При такой механизации один человек в течение 8 часов может подготовить 20 тонн смеси.
В печах, работающих по принципу непрерывного процесса, можно получить до 3 выпусков в час. От глубины погружения верхнего электрода в смесь существенно зависят как количество загружаемой шихты, так и потери извести от испарения при перегреве. При правильной работе печи шихта, постепенно подогреваясь, опускается вдоль электрода к реакционной зоне. Зона плавления, измеряемая расстоянием от центра электрода до внешней границы жидкого карбида, зависит от количества теплоты, излучаемой единицею поверхности электрода. Для осуществления вполне правильной работы печи надо точно установить выгоднейшую плотность тока, соответствующую плавлению данной шихты и образованию жидкого карбида; при недостаточной плотности тока не достигается полное восстановление извести, а при слишком повышенной — диссоциирует и частично испаряется получаемый карбид.
Современные карбидные печи дают около 6 кг карбида кальция на kW-сутки; исследования показывают, что больший КПД м. б. получен только в печах мощностью не менее 3000 kW. На некоторых иностранных заводах установлены трехфазные карбидные печи в 4000, 8000 и даже 15000 kW, которые работают вполне удовлетворительно. С другой стороны, делаются попытки использовать для предварительного нагрева шихты энергию окиси углерода, образующейся при реакции получения карбида. Практическое значение утилизации СО видно из следующего приближенного подсчета: 1кг СаО и 0,7 кг С дают 0,8 кг чистого СаС2 или 1 кг коммерческого карбида кальция. Считая температуру реакции в 3000° и принимая теплоемкость СаО равной 0,2, а теплоемкость углеродистого материала 0,45, получаем количество тепла q, необходимое для нагрева первичных материалов до 3000°:
q = (0,2· 1·3000) + (0,45·0,7·3000) = 1545 Cal.
По Форкранду, количество тепла, необходимое для образования 0,8 кг СаС2 из СаО и С, q’ = 1316 Cal; следовательно, количество тепла Q, необходимое для получения 1 кг коммерческого карбида кальция (0,8 кг чистого СаС2):
Q = q+q’ = 1545 + 1316 = 2861 Cal;
1 kW-сутки = 20650 Cal, следовательно, отдача печи теоретически д. б. 20650:2861 = 7,21 кг карбида на kW-сутки. Если использовать в этом процессе теплоту сгорания окиси углерода, то при одном и том же расходе энергии КПД печи значительно возрастет. Действительно, при получении 0,8 кг СаС2 (1 кг коммерческого карбида кальция) выделяется 350 грамм СО, дающей при сгорании 850 Cal. Следовательно, количество тепла, необходимое для образования 1 кг коммерческого карбида кальция, будет 2861—850=2011 Cal, и теоретическая производительность печи возрастет до 20650:2011 = 10,5 кг карбида кальция на kW-сутки. Как указано выше, практический выход в современных печах выражается 6 кг на kW-сутки, следовательно, КПД достигает 85% без использования калорической мощности СО; если же рассматривать это использование как возможное, то КПД современной печи выражается только 57% теоретически исчисленной отдачи. Из этого подсчета видно, что тепловые потери при неиспользовании окиси углерода очень велики, и удачное разрешение вопроса хотя бы частичной ликвидации этих потерь имеет большое практическое значение.
Из печей, работающих по принципу непрерывного процесса, карбид кальция от 1 до 3 раз в час выпускается в огненно-жидком состоянии в чугунные изложницы соответствующей емкости, в которых он довольно быстро переходит в твердое состояние. Затвердевший карбид еще в горячем состоянии в виде слитков, достигающих веса 250 кг, перевозят при помощи механических транспортерных приспособлений в специальные сухие помещения для остывания. По прошествии 10—12 часов остывший карбид подвергают дроблению на механических дробилках типа Блека. Раздробленный карбид кальция, в зависимости от требований рынка, поступает в упаковку либо в кусках без отсортировки (разномерный), либо рассортированный на куски определенных размеров. Карбид-разномерка имеет размеры кусков от 15 до 100 мм при среднем размере 125—40 мм; в таком продукте допускаются куски и менее 15 мм в количестве до 5% от общего веса. Сортированный карбид кальция делится на 3 или 4 сорта со следующими размерами кусков в мм:
Кроме того, на рынок выпускается карбид кальция в более мелких кусках, размерами 1—2 мм, 2—4 мм, 4—8 мм и 8—15 мм. Такой карбид в продаже часто обозначается как «гранулированный». Сортировка дробленого карбида кальция по размерам кусков производится во вращающихся сетчатых стальных барабанах или же на сотрясательных плоских ситах. Среднее соотношение между весом и объемом продажного карбида кальция, в зависимости от размера кусков, видно из табл. 2.
В виду того что от соприкосновения с влагой карбид кальция разлагается, для хранения его требуется прочная герметичная тара, для чего служат цилиндрические барабаны из кровельного 4—4,5-кг железа. Для большей герметичности продольные швы делают в двойной фальц или проваривают автогенным способом или электросваркой, а для придания жесткости боковую поверхность крупных барабанов гофрируют. Загрузочные отверстия барабанов закрывают жестяной крышкой, припаиваемой к донышку оловом, или же края крышки герметически закатывают на отогнутые края отверстия донышка. Во время транспортирования и хранения карбида кальция необходимо тщательно следить за герметичностью тары. Следует иметь в виду, что проникание внутрь барабана влаги даже через незначительные отверстия приводит, в конце концов, к нарушению целости барабана, т. к. образующаяся от разложения известь занимает больший объем, чем карбид, из которого она получилась. При исправной таре карбид кальция может храниться без изменения неопределенно долгое время, а потому вскрывают только такое количество барабанов, какое требуется для работы в течение дня. Вскрывание барабанов следует производить осторожно, пользуясь для этого клещами и стараясь отделить крышку загрузочного отверстия по линии спайки; необходимо избегать применения ударных инструментов типа зубил, молотков и т. п., т. к. при ударе могут получиться искры и, при наличии внутри барабана взрывчатой смеси ацетилена с воздухом, привести к взрыву. По той же причине при вскрытии барабанов не следует применять паяльных горелок и ламп. Выпускается карбид кальция обычно в барабанах весом по 100, 50, 30, 20, 10, 5 и 1 кг.
При отправке по железным дорогам и на пароходах, согласно правилам НКПС, железные барабаны с карбидом кальция должны быть упакованы в деревянные футляры для предохранения от пробивания; исключение делается только для крупных повагонных отправок. Указания относительно устройства складов и порядка хранения карбида кальция имеются в обязательном постановлении Наркомтруда СССР от 14 января 1926 г. (опубликованном в «Известиях НКТруда» от 8 февраля 1926 г., № 4—5).
Технический анализ карбида кальция. В виду того, что ценность карбида кальция определяется главным образом выходом ацетилена из его весовой единицы, технический контроль карбидного производства и определение качества продукта при приемках ограничиваются обычно определением выхода сырого (неочищенного) ацетилена из 1 кг карбида. Объем выделившегося ацетилена приводится к температуре 15° и давлению 760 мм Hg. Так как технический карбид кальция является неоднородным веществом, то отбор средних проб должен производиться особо тщательно. Для отбора пробы обычно существуют точные правила, излагаемые в описании стандартных норм, принятых в том или в ином государстве. Общепринятым прибором для технического анализа карбида кальция является прибор О. С. А. Устройство его показано на фиг. 8.
Он состоит из подвижного железного колокола со шкалой, железного бака и генератора ацетилена с принадлежностями. Генератор соединен с колоколом резиновой трубкой. Бак аппарата наполняется насыщенной ацетиленом водой. Колокол снабжен уравнивающим противовесом, который играет большую роль во всех операциях анализа.
Как указано выше, 1 кг химически чистого СаС2 дает 348,7 литров ацетилена (при 0° и 760 мм Hg). Технический карбид кальция считается доброкачественным, если 1 кг его дает от 280 до 300 литров С2Н2. Карбид кальция с выходом ацетилена более 300 литров на кг обычно готовят только по специальным заказам; объясняется это тем, что по мере приближения качества карбида к теоретическому он делается менее плавким, вследствие чего непропорционально увеличивается расход электроэнергии. Практически, количество и качество посторонних примесей в карбиде кальция имеет гораздо большее значение, чем высокий выход ацетилена из него. Постоянными примесями карбида кальция являются непрореагировавшие известь и уголь. Кроме того, в техническом продукте всегда присутствует ферросилиций, получающийся гл. обр. из зольных элементов углеродистого материала; количество ферросилиция в отдельных партиях доходит иногда до 3% от веса карбида.
В карбиде кальция всегда присутствуют также сернистый и фосфористый кальций. Уменьшения количества трех последних примесей можно добиться только улучшением качества исходных материалов.
Применение. Карбид кальция служит гл. обр. для получения ацетилена; кроме того, значительные количества карбида кальция расходуются в производстве цианамида кальция по способу Франка и Каро.
Источник: Мартенс. Техническая энциклопедия. Том 9 — 1929 г.
При щелочной реакции углерода с металлами могут получится различные карбиды. За счет соединения определенных химических элементов получаются соединения, которые характеризуются высокой прочностью. Довольно большое распространение получил вариант исполнения, который получил название карбид кальция. Его стали применять в самых различных областях промышленности.
Карбид кальция
Внешний вид и характеристики технического карбида кальция
Впервые рассматриваемый состав был получен в 1862 году. Проводимая процедура касалась отделения кальция от извести, в результате чего получился бледно-серый состав без признаков, свойственных металлам. В результате опыта был получен карбид, который в последствии стал активно использоваться при выпуске различной продукции.
В начале 20 века карбид кальция стали использовать для производства ацетилена в больших объемах. Именно поэтому стали вести активные исследования для выявления более производительной технологии.
Технические характеристики материала определяют его широкое распространение. Внешний вид вещества характеризуется светло-серым цветом, выпускаются карбиды в виде камня или порошка.
Физические свойства
При выборе практически любого материала следует уделять больше всего внимания физическим свойствам. У рассматриваемого они следующие:
- Соединение имеет кристаллическую структуру.
- Показатель температуры плавления составляет 2300 °С. Стоит учитывать, что подобная цифра свойственна только чистому составу. Добавление в состав различных примесей приводит к тому, что температура плавления существенно падает.
Чистый карбид кальция
Стоит учитывать, что карбид кальция в большинстве случаев находится в твердом состоянии. Кроме этого, цвет может варьироваться от серого до коричневого цвета. Физические свойства карбида кальция определяют его широкое применение в самых различных отраслях промышленности.
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала. К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.
Карбонат кальция
Считается, что наиболее важным химическим качеством является податливость к разложению при воздействии воды.
Получение
Как ранее было отмечено, карбид кальция активно применяется при получении самых различных материалов. Именно поэтому процесс получения карбида кальция постоянно совершенствовался. К особенностям применяемых технологий можно отнести нижеприведенные моменты:
- В качестве сырья применяется негашеная известь. В большинстве случаев вещество получается из извести, но в домашних условиях провести подобную процедуру сложно.
- Известь смешивается с измельченном коксом для получения однородной массы.
- В промышленности карбид кальция получают по схеме, которая предусматривает нагрев вещества до высокой температуры. Для этого применяются электронные печи. Рекомендуемая температура плавления составляет 1900 ⁰С.
- После нагрева вещества до столь высокой температуры оно переходит в жидкое состояние. Для работы подготавливаются специальные формы.
При рассмотрении того, как из углерода получить карбид кальция отметим, что по установленным стандартам в состав должно входить не менее 80% основного вещества. На долю примесей должно приходится не более 25%, в число которых также входит углерод. Производство оксида кальция также приводит к выделению тепловой энергии, что стоит учитывать.
Транспортировка и хранение
Порошок карбида кальция при воздействии влаги практически моментально разлагается. При этом образуется ацетилен, который при большой концентрации горюч и взрывоопасный. Именно поэтому нужно уделять довольно много внимания хранению карбида кальция, для чего часто применяют бидоны и специальные барабаны. К другим особенностям хранения отнесем следующие моменты:
- Выделяющийся ацетилен легче воздуха, поэтому скапливается вверху. Стоит учитывать, что он обладает наркотическими действиями, может самовоспламеняться.
- При производстве большого объема вещества особое внимание уделяется технике безопасности. Для фасовки применяются специальные упаковки.
- Для открытия упаковки следует использовать инструменты, которые не становятся причиной образования искр.
- Если вещество попадает на кожу или слизистую оболочку, то его нужно сразу удалить. При этом пострадавшая поверхность обрабатывается специальным кремом или другим защитно-заживляющим веществом.
- По установленным правилам, транспортировка может проводится исключительно при применении крытого транспортного средства. При этом проводить доставку по воздуху запрещается.
Контейнер для транспортировки
Установленные правила также запрещают хранить карбид кальция вместе с другими химическими веществами и источниками тепла. Это связано с тем, что образующиеся газы могут вступать в химическую реакцию с другими химическими веществами и возгораться.
Применение карбида кальция
Как ранее было отмечено, карбид кальция встречается в самых различных областях промышленности, зачастую поставляют для проведения промышленного синтеза. Свойства карбида кальция и реакция, протекающая при его соединении с различными веществами, определяют использование вещества в нижеприведенных случаях:
- Многие синтетически компоненты, входящих в состав современных материалов, производят на основе рассматриваемого компонента.
- Применяется для получения цианамида кальция. Подобный компонент используется для получения различных химических удобрений. Именно поэтому сырье применяется для регулирования скорости роста растений.
- Цианамид кальция также получают при соединении вещества с азотом.
- В некоторых случаях проводится восстановление металлов щелочной группы.
- Можно использовать рассматриваемое соединение в процессе газовой сварки.
При рассмотрении карбида кальция и области применения стоит учитывать, что подобное вещество чаще всего применяют для получения ацетилена. Подобный синтез карбида кальция разработал немецкий ученый. Среди особенностей подобного способа применения отметим следующие моменты:
- Ацетилен из карбида получают при оказании воздействия водой на используемое сырье.
- В результате прохождения химической реакции образуется требующийся газ, гашеная известь выпадает в осадок.
- Стоит учитывать, что при смешивании компонентов выделяется большое количество тепла. Поэтому работа должна проводится с учетом техники безопасности.
- В зависимости от вида применяемой технологии переработки сырья с 1 килограмма выходит около 290 литров газа.
- Скорость протекания процедуры зависит от чистоты применяемого сырья, температуры и количества воды.
Получение ацетилена из карбида кальция
Как показывает практика, при использовании чистого карбида на протекание химической реакции отводится около 20 литров волы на 1 килограмм сырья. Подобное количество воды требуется для того чтобы снизить температуру реакции, за счет чего обеспечиваются оптимальные условия для работы.
Техника безопасности
При проведении различных химических реакций для производства материалов должна соблюдаться техника безопасности. Как ранее было отмечено, выделяемые вещества могут быть взрывоопасными. Техника безопасности при взаимодействии с различными химическими веществами заключается в следующем:
- Для хранения и обработки требуется герметичное место. В обычном гараже проводить работы не рекомендуется.
- Нельзя допускать огонь к самому сырью, а также образующимся газам.
- Даже мелкие частицы могут привести к поражению кожных покровов. Именно поэтому работа должна проводится в респираторе и защитной одежде.
- Генераторы ацетилена размещают исключительно в хорошо изолированных помещениях.
- Если сырье применялось при проведении сварочных работ, то следует образующийся шлак утилизировать в специальных местах.
- При перемещении металлических и иных емкостей они должны быть надежно закреплены, столкновение и падение не допускается. Это может привести к появлению искр, которые станут причиной взрыва вещества.
Горение карбида кальция
Вышеприведенная информация определяет то, что работы с рассматриваемым сырьем не рекомендуется проводить в гараже или домашней мастерской. Несоблюдении технологии, отсутствии требующего оснащения и многие другие причины могут привести к возникновению искры и воспламенению веществ.
Карбид кальция реакция с водой
Рассматриваемое сырье чаще всего применяется для соединения с водой, в результате чего получается ацетилен. Взаимодействие карбида кальция с водой становится причиной появления газа с неприятным запахом и достаточно большим количеством различных примесей. В чистом виде получить подобное вещество можно только при его многоэтапной очистке.
Реакция карбида кальция с водой может быть проведена опытным путем. К особенностям подобной процедуры отнесем следующие моменты:
- В качестве емкости применяется 1,5-литровая бутылка.
- После ее заполнения водой добавляется несколько кусочков кристаллического материала.
- Протекание реакции приводит к появлению избыточного давления.
- После того как карбид кальция больше не вступает в реакцию, на бутылку помещается горящая бумага. В результате взаимодействия между карбидом кальция и водой образуется газ, который взрывается. При рассматриваемом опыте образуется огненное облако.
Подобный опыт довольно опасен и должен быть проведен с соблюдением техники безопасности.
В заключение отметим, что рассматриваемый компонент в последнее время часто применяется для проведения самых различных опытов. Соединение обладает большим количеством свойств, которые должны учитываться. Выделение тепла и газов становится причиной, по которой проводить опыты рекомендуется только в промышленности.




























