|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | dull gray, silver; with a pale yellow tint[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ca) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calcium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1115 K (842 °C, 1548 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1757 K (1484 °C, 2703 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 1.55 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 1.378 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 8.54 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporisation | 154.7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.929 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapour pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | +1,[3] +2 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionisation energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 176±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 231 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of calcium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centred cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 3810 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 22.3 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 201 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 33.6 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +40.0×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 20 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 7.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 170–416 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of calcium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Calcium is a chemical element with the symbol Ca and atomic number 20. As an alkaline earth metal, calcium is a reactive metal that forms a dark oxide-nitride layer when exposed to air. Its physical and chemical properties are most similar to its heavier homologues strontium and barium. It is the fifth most abundant element in Earth’s crust, and the third most abundant metal, after iron and aluminium. The most common calcium compound on Earth is calcium carbonate, found in limestone and the fossilised remnants of early sea life; gypsum, anhydrite, fluorite, and apatite are also sources of calcium. The name derives from Latin calx «lime», which was obtained from heating limestone.
Some calcium compounds were known to the ancients, though their chemistry was unknown until the seventeenth century. Pure calcium was isolated in 1808 via electrolysis of its oxide by Humphry Davy, who named the element. Calcium compounds are widely used in many industries: in foods and pharmaceuticals for calcium supplementation, in the paper industry as bleaches, as components in cement and electrical insulators, and in the manufacture of soaps. On the other hand, the metal in pure form has few applications due to its high reactivity; still, in small quantities it is often used as an alloying component in steelmaking, and sometimes, as a calcium–lead alloy, in making automotive batteries.
Calcium is the most abundant metal and the fifth-most abundant element in the human body.[5] As electrolytes, calcium ions (Ca2+) play a vital role in the physiological and biochemical processes of organisms and cells: in signal transduction pathways where they act as a second messenger; in neurotransmitter release from neurons; in contraction of all muscle cell types; as cofactors in many enzymes; and in fertilization.[5] Calcium ions outside cells are important for maintaining the potential difference across excitable cell membranes, protein synthesis, and bone formation.[5][6]
Characteristics
Classification
Calcium is a very ductile silvery metal (sometimes described as pale yellow) whose properties are very similar to the heavier elements in its group, strontium, barium, and radium. A calcium atom has twenty electrons, arranged in the electron configuration [Ar]4s2. Like the other elements placed in group 2 of the periodic table, calcium has two valence electrons in the outermost s-orbital, which are very easily lost in chemical reactions to form a dipositive ion with the stable electron configuration of a noble gas, in this case argon.[7]
Hence, calcium is almost always divalent in its compounds, which are usually ionic. Hypothetical univalent salts of calcium would be stable with respect to their elements, but not to disproportionation to the divalent salts and calcium metal, because the enthalpy of formation of MX2 is much higher than those of the hypothetical MX. This occurs because of the much greater lattice energy afforded by the more highly charged Ca2+ cation compared to the hypothetical Ca+ cation.[7]
Calcium, strontium, barium, and radium are always considered to be alkaline earth metals; the lighter beryllium and magnesium, also in group 2 of the periodic table, are often included as well. Nevertheless, beryllium and magnesium differ significantly from the other members of the group in their physical and chemical behaviour: they behave more like aluminium and zinc respectively and have some of the weaker metallic character of the post-transition metals, which is why the traditional definition of the term «alkaline earth metal» excludes them.[8]
Physical properties
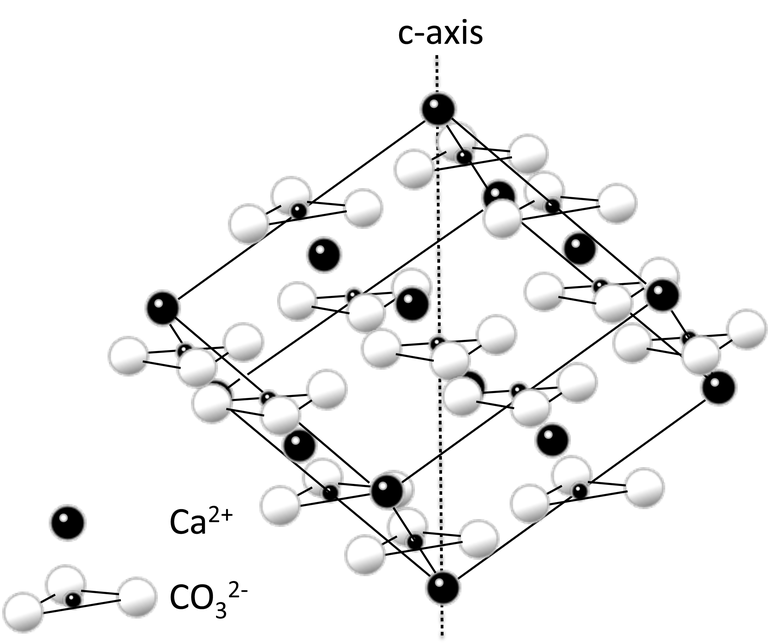
Calcium metal melts at 842 °C and boils at 1494 °C; these values are higher than those for magnesium and strontium, the neighbouring group 2 metals. It crystallises in the face-centered cubic arrangement like strontium; above 450 °C, it changes to an anisotropic hexagonal close-packed arrangement like magnesium. Its density of 1.55 g/cm3 is the lowest in its group.[7]
Calcium is harder than lead but can be cut with a knife with effort. While calcium is a poorer conductor of electricity than copper or aluminium by volume, it is a better conductor by mass than both due to its very low density.[9] While calcium is infeasible as a conductor for most terrestrial applications as it reacts quickly with atmospheric oxygen, its use as such in space has been considered.[10]
Chemical properties
Structure of the polymeric [Ca(H2O)6]2+ center in hydrated calcium chloride, illustrating the high coordination number typical for calcium complexes.
The chemistry of calcium is that of a typical heavy alkaline earth metal. For example, calcium spontaneously reacts with water more quickly than magnesium and less quickly than strontium to produce calcium hydroxide and hydrogen gas. It also reacts with the oxygen and nitrogen in the air to form a mixture of calcium oxide and calcium nitride.[11] When finely divided, it spontaneously burns in air to produce the nitride. In bulk, calcium is less reactive: it quickly forms a hydration coating in moist air, but below 30% relative humidity it may be stored indefinitely at room temperature.[12]
Besides the simple oxide CaO, the peroxide CaO2 can be made by direct oxidation of calcium metal under a high pressure of oxygen, and there is some evidence for a yellow superoxide Ca(O2)2.[13] Calcium hydroxide, Ca(OH)2, is a strong base, though it is not as strong as the hydroxides of strontium, barium or the alkali metals.[14] All four dihalides of calcium are known.[15] Calcium carbonate (CaCO3) and calcium sulfate (CaSO4) are particularly abundant minerals.[16] Like strontium and barium, as well as the alkali metals and the divalent lanthanides europium and ytterbium, calcium metal dissolves directly in liquid ammonia to give a dark blue solution.[7]
Due to the large size of the calcium ion (Ca2+), high coordination numbers are common, up to 24 in some intermetallic compounds such as CaZn13.[17] Calcium is readily complexed by oxygen chelates such as EDTA and polyphosphates, which are useful in analytic chemistry and removing calcium ions from hard water. In the absence of steric hindrance, smaller group 2 cations tend to form stronger complexes, but when large polydentate macrocycles are involved the trend is reversed.[16]
Although calcium is in the same group as magnesium and organomagnesium compounds are very commonly used throughout chemistry, organocalcium compounds are not similarly widespread because they are more difficult to make and more reactive, although they have recently been investigated as possible catalysts.[18][19][20][21][22] Organocalcium compounds tend to be more similar to organoytterbium compounds due to the similar ionic radii of Yb2+ (102 pm) and Ca2+ (100 pm).[23]
Most of these compounds can only be prepared at low temperatures; bulky ligands tend to favor stability. For example, calcium dicyclopentadienyl, Ca(C5H5)2, must be made by directly reacting calcium metal with mercurocene or cyclopentadiene itself; replacing the C5H5 ligand with the bulkier C5(CH3)5 ligand on the other hand increases the compound’s solubility, volatility, and kinetic stability.[23]
Isotopes
Natural calcium is a mixture of five stable isotopes (40Ca, 42Ca, 43Ca, 44Ca, and 46Ca) and one isotope with a half-life so long that it can be considered stable for all practical purposes (48Ca, with a half-life of about 4.3 × 1019 years). Calcium is the first (lightest) element to have six naturally occurring isotopes.[11]
By far the most common isotope of calcium in nature is 40Ca, which makes up 96.941% of all natural calcium. It is produced in the silicon-burning process from fusion of alpha particles and is the heaviest stable nuclide with equal proton and neutron numbers; its occurrence is also supplemented slowly by the decay of primordial 40K. Adding another alpha particle leads to unstable 44Ti, which quickly decays via two successive electron captures to stable 44Ca; this makes up 2.806% of all natural calcium and is the second-most common isotope.[24][25]
The other four natural isotopes, 42Ca, 43Ca, 46Ca, and 48Ca, are significantly rarer, each comprising less than 1% of all natural calcium. The four lighter isotopes are mainly products of the oxygen-burning and silicon-burning processes, leaving the two heavier ones to be produced via neutron capture processes. 46Ca is mostly produced in a «hot» s-process, as its formation requires a rather high neutron flux to allow short-lived 45Ca to capture a neutron. 48Ca is produced by electron capture in the r-process in type Ia supernovae, where high neutron excess and low enough entropy ensures its survival.[24][25]
46Ca and 48Ca are the first «classically stable» nuclides with a six-neutron or eight-neutron excess respectively. Although extremely neutron-rich for such a light element, 48Ca is very stable because it is a doubly magic nucleus, having 20 protons and 28 neutrons arranged in closed shells. Its beta decay to 48Sc is very hindered because of the gross mismatch of nuclear spin: 48Ca has zero nuclear spin, being even–even, while 48Sc has spin 6+, so the decay is forbidden by the conservation of angular momentum. While two excited states of 48Sc are available for decay as well, they are also forbidden due to their high spins. As a result, when 48Ca does decay, it does so by double beta decay to 48Ti instead, being the lightest nuclide known to undergo double beta decay.[26][27]
The heavy isotope 46Ca can also theoretically undergo double beta decay to 46Ti as well, but this has never been observed. The lightest and most common isotope 40Ca is also doubly magic and could undergo double electron capture to 40Ar, but this has likewise never been observed. Calcium is the only element to have two primordial doubly magic isotopes. The experimental lower limits for the half-lives of 40Ca and 46Ca are 5.9 × 1021 years and 2.8 × 1015 years respectively.[26]
Apart from the practically stable 48Ca, the longest lived radioisotope of calcium is 41Ca. It decays by electron capture to stable 41K with a half-life of about a hundred thousand years. Its existence in the early Solar System as an extinct radionuclide has been inferred from excesses of 41K: traces of 41Ca also still exist today, as it is a cosmogenic nuclide, continuously reformed through neutron activation of natural 40Ca.[25]
Many other calcium radioisotopes are known, ranging from 35Ca to 60Ca. They are all much shorter-lived than 41Ca, the most stable among them being 45Ca (half-life 163 days) and 47Ca (half-life 4.54 days). The isotopes lighter than 42Ca usually undergo beta plus decay to isotopes of potassium, and those heavier than 44Ca usually undergo beta minus decay to isotopes of scandium, although near the nuclear drip lines, proton emission and neutron emission begin to be significant decay modes as well.[26]
Like other elements, a variety of processes alter the relative abundance of calcium isotopes.[28] The best studied of these processes is the mass-dependent fractionation of calcium isotopes that accompanies the precipitation of calcium minerals such as calcite, aragonite and apatite from solution. Lighter isotopes are preferentially incorporated into these minerals, leaving the surrounding solution enriched in heavier isotopes at a magnitude of roughly 0.025% per atomic mass unit (amu) at room temperature. Mass-dependent differences in calcium isotope composition are conventionally expressed by the ratio of two isotopes (usually 44Ca/40Ca) in a sample compared to the same ratio in a standard reference material. 44Ca/40Ca varies by about 1% among common earth materials.[29]
History
Calcium compounds were known for millennia, although their chemical makeup was not understood until the 17th century.[30] Lime as a building material[31] and as plaster for statues was used as far back as around 7000 BC.[32] The first dated lime kiln dates back to 2500 BC and was found in Khafajah, Mesopotamia.[33][34]
At about the same time, dehydrated gypsum (CaSO4·2H2O) was being used in the Great Pyramid of Giza. This material would later be used for the plaster in the tomb of Tutankhamun. The ancient Romans instead used lime mortars made by heating limestone (CaCO3). The name «calcium» itself derives from the Latin word calx «lime».[30]
Vitruvius noted that the lime that resulted was lighter than the original limestone, attributing this to the boiling of the water. In 1755, Joseph Black proved that this was due to the loss of carbon dioxide, which as a gas had not been recognised by the ancient Romans.[35]
In 1789, Antoine Lavoisier suspected that lime might be an oxide of a fundamental chemical element. In his table of the elements, Lavoisier listed five «salifiable earths» (i.e., ores that could be made to react with acids to produce salts (salis = salt, in Latin): chaux (calcium oxide), magnésie (magnesia, magnesium oxide), baryte (barium sulfate), alumine (alumina, aluminium oxide), and silice (silica, silicon dioxide)). About these «elements», Lavoisier reasoned:
We are probably only acquainted as yet with a part of the metallic substances existing in nature, as all those which have a stronger affinity to oxygen than carbon possesses, are incapable, hitherto, of being reduced to a metallic state, and consequently, being only presented to our observation under the form of oxyds, are confounded with earths. It is extremely probable that barytes, which we have just now arranged with earths, is in this situation; for in many experiments it exhibits properties nearly approaching to those of metallic bodies. It is even possible that all the substances we call earths may be only metallic oxyds, irreducible by any hitherto known process.[36]
Calcium, along with its congeners magnesium, strontium, and barium, was first isolated by Humphry Davy in 1808. Following the work of Jöns Jakob Berzelius and Magnus Martin af Pontin on electrolysis, Davy isolated calcium and magnesium by putting a mixture of the respective metal oxides with mercury(II) oxide on a platinum plate which was used as the anode, the cathode being a platinum wire partially submerged into mercury. Electrolysis then gave calcium–mercury and magnesium–mercury amalgams, and distilling off the mercury gave the metal.[30][37] However, pure calcium cannot be prepared in bulk by this method and a workable commercial process for its production was not found until over a century later.[35]
Occurrence and production
At 3%, calcium is the fifth most abundant element in the Earth’s crust, and the third most abundant metal behind aluminium and iron.[30] It is also the fourth most abundant element in the lunar highlands.[12] Sedimentary calcium carbonate deposits pervade the Earth’s surface as fossilized remains of past marine life; they occur in two forms, the rhombohedral calcite (more common) and the orthorhombic aragonite (forming in more temperate seas). Minerals of the first type include limestone, dolomite, marble, chalk, and iceland spar; aragonite beds make up the Bahamas, the Florida Keys, and the Red Sea basins. Corals, sea shells, and pearls are mostly made up of calcium carbonate. Among the other important minerals of calcium are gypsum (CaSO4·2H2O), anhydrite (CaSO4), fluorite (CaF2), and apatite ([Ca5(PO4)3F]).[30]
The major producers of calcium are China (about 10000 to 12000 tonnes per year), Russia (about 6000 to 8000 tonnes per year), and the United States (about 2000 to 4000 tonnes per year). Canada and France are also among the minor producers. In 2005, about 24000 tonnes of calcium were produced; about half of the world’s extracted calcium is used by the United States, with about 80% of the output used each year.[10]
In Russia and China, Davy’s method of electrolysis is still used, but is instead applied to molten calcium chloride.[10] Since calcium is less reactive than strontium or barium, the oxide–nitride coating that results in air is stable and lathe machining and other standard metallurgical techniques are suitable for calcium.[38] In the United States and Canada, calcium is instead produced by reducing lime with aluminium at high temperatures.[10]
Geochemical cycling
Calcium cycling provides a link between tectonics, climate, and the carbon cycle. In the simplest terms, uplift of mountains exposes calcium-bearing rocks such as some granites to chemical weathering and releases Ca2+ into surface water. These ions are transported to the ocean where they react with dissolved CO2 to form limestone (CaCO
3), which in turn settles to the sea floor where it is incorporated into new rocks. Dissolved CO2, along with carbonate and bicarbonate ions, are termed «dissolved inorganic carbon» (DIC).[39]
The actual reaction is more complicated and involves the bicarbonate ion (HCO−
3) that forms when CO2 reacts with water at seawater pH:
- Ca2+
+ 2HCO−
3 → CaCO
3(s) + CO
2 + H
2O
At seawater pH, most of the CO2 is immediately converted back into HCO−
3. The reaction results in a net transport of one molecule of CO2 from the ocean/atmosphere into the lithosphere.[40] The result is that each Ca2+ ion released by chemical weathering ultimately removes one CO2 molecule from the surficial system (atmosphere, ocean, soils and living organisms), storing it in carbonate rocks where it is likely to stay for hundreds of millions of years. The weathering of calcium from rocks thus scrubs CO2 from the ocean and atmosphere, exerting a strong long-term effect on climate.[39][41]
Uses
The largest use of metallic calcium is in steelmaking, due to its strong chemical affinity for oxygen and sulfur. Its oxides and sulfides, once formed, give liquid lime aluminate and sulfide inclusions in steel which float out; on treatment, these inclusions disperse throughout the steel and become small and spherical, improving castability, cleanliness and general mechanical properties. Calcium is also used in maintenance-free automotive batteries, in which the use of 0.1% calcium–lead alloys instead of the usual antimony–lead alloys leads to lower water loss and lower self-discharging.[42]
Due to the risk of expansion and cracking, aluminium is sometimes also incorporated into these alloys. These lead–calcium alloys are also used in casting, replacing lead–antimony alloys.[42] Calcium is also used to strengthen aluminium alloys used for bearings, for the control of graphitic carbon in cast iron, and to remove bismuth impurities from lead.[38] Calcium metal is found in some drain cleaners, where it functions to generate heat and calcium hydroxide that saponifies the fats and liquefies the proteins (for example, those in hair) that block drains.[43]
Besides metallurgy, the reactivity of calcium is exploited to remove nitrogen from high-purity argon gas and as a getter for oxygen and nitrogen. It is also used as a reducing agent in the production of chromium, zirconium, thorium, and uranium. It can also be used to store hydrogen gas, as it reacts with hydrogen to form solid calcium hydride, from which the hydrogen can easily be re-extracted.[38]
Calcium isotope fractionation during mineral formation has led to several applications of calcium isotopes. In particular, the 1997 observation by Skulan and DePaolo[44] that calcium minerals are isotopically lighter than the solutions from which the minerals precipitate is the basis of analogous applications in medicine and in paleoceanography. In animals with skeletons mineralized with calcium, the calcium isotopic composition of soft tissues reflects the relative rate of formation and dissolution of skeletal mineral.[45]
In humans, changes in the calcium isotopic composition of urine have been shown to be related to changes in bone mineral balance. When the rate of bone formation exceeds the rate of bone resorption, the 44Ca/40Ca ratio in soft tissue rises and vice versa. Because of this relationship, calcium isotopic measurements of urine or blood may be useful in the early detection of metabolic bone diseases like osteoporosis.[45]
A similar system exists in seawater, where 44Ca/40Ca tends to rise when the rate of removal of Ca2+ by mineral precipitation exceeds the input of new calcium into the ocean. In 1997, Skulan and DePaolo presented the first evidence of change in seawater 44Ca/40Ca over geologic time, along with a theoretical explanation of these changes. More recent papers have confirmed this observation, demonstrating that seawater Ca2+ concentration is not constant, and that the ocean is never in a «steady state» with respect to calcium input and output. This has important climatological implications, as the marine calcium cycle is closely tied to the carbon cycle.[46][47]
Many calcium compounds are used in food, as pharmaceuticals, and in medicine, among others. For example, calcium and phosphorus are supplemented in foods through the addition of calcium lactate, calcium diphosphate, and tricalcium phosphate. The last is also used as a polishing agent in toothpaste and in antacids. Calcium lactobionate is a white powder that is used as a suspending agent for pharmaceuticals. In baking, calcium phosphate is used as a leavening agent. Calcium sulfite is used as a bleach in papermaking and as a disinfectant, calcium silicate is used as a reinforcing agent in rubber, and calcium acetate is a component of liming rosin and is used to make metallic soaps and synthetic resins.[42]
Calcium is on the World Health Organization’s List of Essential Medicines.[48]
Food sources
Foods rich in calcium include dairy products, such as yogurt and cheese, sardines, salmon, soy products, kale, and fortified breakfast cereals.[6]
Because of concerns for long-term adverse side effects, including calcification of arteries and kidney stones, both the U.S. Institute of Medicine (IOM) and the European Food Safety Authority (EFSA) set Tolerable Upper Intake Levels (ULs) for combined dietary and supplemental calcium. From the IOM, people of ages 9–18 years are not to exceed 3 g/day combined intake; for ages 19–50, not to exceed 2.5 g/day; for ages 51 and older, not to exceed 2 g/day.[49] EFSA set the UL for all adults at 2.5 g/day, but decided the information for children and adolescents was not sufficient to determine ULs.[50]
Biological and pathological role
| Age | Calcium (mg/day) |
|---|---|
| 1–3 years | 700 |
| 4–8 years | 1000 |
| 9–18 years | 1300 |
| 19–50 years | 1000 |
| >51 years | 1000 |
| Pregnancy | 1000 |
| Lactation | 1000 |
Global dietary calcium intake among adults (mg/day).[52]
<400
400–500
500–600
600–700
700–800
800–900
900–1000
>1000
Function
Calcium is an essential element needed in large quantities.[5][6] The Ca2+ ion acts as an electrolyte and is vital to the health of the muscular, circulatory, and digestive systems; is indispensable to the building of bone; and supports synthesis and function of blood cells. For example, it regulates the contraction of muscles, nerve conduction, and the clotting of blood. As a result, intra- and extracellular calcium levels are tightly regulated by the body. Calcium can play this role because the Ca2+ ion forms stable coordination complexes with many organic compounds, especially proteins; it also forms compounds with a wide range of solubilities, enabling the formation of the skeleton.[5]
[53]
Binding
Calcium ions may be complexed by proteins through binding the carboxyl groups of glutamic acid or aspartic acid residues; through interacting with phosphorylated serine, tyrosine, or threonine residues; or by being chelated by γ-carboxylated amino acid residues. Trypsin, a digestive enzyme, uses the first method; osteocalcin, a bone matrix protein, uses the third.[54]
Some other bone matrix proteins such as osteopontin and bone sialoprotein use both the first and the second. Direct activation of enzymes by binding calcium is common; some other enzymes are activated by noncovalent association with direct calcium-binding enzymes. Calcium also binds to the phospholipid layer of the cell membrane, anchoring proteins associated with the cell surface.[54]
Solubility
As an example of the wide range of solubility of calcium compounds, monocalcium phosphate is very soluble in water, 85% of extracellular calcium is as dicalcium phosphate with a solubility of 2.0 mM and the hydroxyapatite of bones in an organic matrix is tricalcium phosphate at 100 μM.[54]
Nutrition
Calcium is a common constituent of multivitamin dietary supplements,[5] but the composition of calcium complexes in supplements may affect its bioavailability which varies by solubility of the salt involved: calcium citrate, malate, and lactate are highly bioavailable, while the oxalate is less. Other calcium preparations include calcium carbonate, calcium citrate malate, and calcium gluconate.[5] The intestine absorbs about one-third of calcium eaten as the free ion, and plasma calcium level is then regulated by the kidneys.[5]
Hormonal regulation of bone formation and serum levels
Parathyroid hormone and vitamin D promote the formation of bone by allowing and enhancing the deposition of calcium ions there, allowing rapid bone turnover without affecting bone mass or mineral content.[5] When plasma calcium levels fall, cell surface receptors are activated and the secretion of parathyroid hormone occurs; it then proceeds to stimulate the entry of calcium into the plasma pool by taking it from targeted kidney, gut, and bone cells, with the bone-forming action of parathyroid hormone being antagonised by calcitonin, whose secretion increases with increasing plasma calcium levels.[54]
Abnormal serum levels
Excess intake of calcium may cause hypercalcemia. However, because calcium is absorbed rather inefficiently by the intestines, high serum calcium is more likely caused by excessive secretion of parathyroid hormone (PTH) or possibly by excessive intake of vitamin D, both of which facilitate calcium absorption. All these conditions result in excess calcium salts being deposited in the heart, blood vessels, or kidneys. Symptoms include anorexia, nausea, vomiting, memory loss, confusion, muscle weakness, increased urination, dehydration, and metabolic bone disease.[54]
Chronic hypercalcaemia typically leads to calcification of soft tissue and its serious consequences: for example, calcification can cause loss of elasticity of vascular walls and disruption of laminar blood flow—and thence to plaque rupture and thrombosis. Conversely, inadequate calcium or vitamin D intakes may result in hypocalcemia, often caused also by inadequate secretion of parathyroid hormone or defective PTH receptors in cells. Symptoms include neuromuscular excitability, which potentially causes tetany and disruption of conductivity in cardiac tissue.[54]
Bone disease
As calcium is required for bone development, many bone diseases can be traced to the organic matrix or the hydroxyapatite in molecular structure or organization of bone. Osteoporosis is a reduction in mineral content of bone per unit volume, and can be treated by supplementation of calcium, vitamin D, and bisphosphonates.[5][6] Inadequate amounts of calcium, vitamin D, or phosphates can lead to softening of bones, called osteomalacia.[54]
Safety
Metallic calcium
| Hazards | |
|---|---|
| GHS labelling:[55] | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H261 |
|
Precautionary statements |
P231+P232 |
| NFPA 704 (fire diamond) |
0 3 1
|
Because calcium reacts exothermically with water and acids, calcium metal coming into contact with bodily moisture results in severe corrosive irritation.[56] When swallowed, calcium metal has the same effect on the mouth, oesophagus, and stomach, and can be fatal.[43] However, long-term exposure is not known to have distinct adverse effects.[56]
References
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 112. ISBN 978-0-08-037941-8.
- ^ «Standard Atomic Weights: Calcium». CIAAW. 1983.
- ^ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias (2010). «Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes». Journal of the American Chemical Society. 132 (35): 12492–12501. doi:10.1021/ja105534w. PMID 20718434.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g h i j «Calcium». Linus Pauling Institute, Oregon State University, Corvallis, Oregon. 1 September 2017. Retrieved 31 August 2019.
- ^ a b c d «Calcium: Fact Sheet for Health Professionals». Office of Dietary Supplements, US National Institutes of Health. 9 July 2019. Retrieved 31 August 2019.
- ^ a b c d Greenwood and Earnshaw, pp. 112–13
- ^ Parish, R. V. (1977). The Metallic Elements. London: Longman. p. 34. ISBN 978-0-582-44278-8.
- ^ Ropp, Richard C. (2012). Encyclopedia of the Alkaline Earth Compounds. pp. 12–15. ISBN 978-0-444-59553-9.
- ^ a b c d Hluchan and Pomerantz, p. 484
- ^ a b C. R. Hammond The elements (pp. 4–35) in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ a b Hluchan and Pomerantz, p. 483
- ^ Greenwood and Earnshaw, p. 119
- ^ Greenwood and Earnshaw, p. 121
- ^ Greenwood and Earnshaw, p. 117
- ^ a b Greenwood and Earnshaw, pp. 122–15
- ^ Greenwood and Earnshaw, p. 115
- ^ Harder, S.; Feil, F.; Knoll, K. (2001). «Novel Calcium Half-Sandwich Complexes for the Living and Stereoselective Polymerization of Styrene». Angew. Chem. Int. Ed. 40 (22): 4261–64. doi:10.1002/1521-3773(20011119)40:22<4261::AID-ANIE4261>3.0.CO;2-J. PMID 29712082.
- ^ Crimmin, Mark R.; Casely, Ian J.; Hill, Michael S. (2005). «Calcium-Mediated Intramolecular Hydroamination Catalysis». Journal of the American Chemical Society. 127 (7): 2042–43. doi:10.1021/ja043576n. PMID 15713071.
- ^ Jenter, Jelena; Köppe, Ralf; Roesky, Peter W. (2011). «2,5-Bis{N-(2,6-diisopropylphenyl)iminomethyl}pyrrolyl Complexes of the Heavy Alkaline Earth Metals: Synthesis, Structures, and Hydroamination Catalysis». Organometallics. 30 (6): 1404–13. doi:10.1021/om100937c.
- ^ Arrowsmith, Merle; Crimmin, Mark R.; Barrett, Anthony G. M.; Hill, Michael S.; Kociok-Köhn, Gabriele; Procopiou, Panayiotis A. (2011). «Cation Charge Density and Precatalyst Selection in Group 2-Catalyzed Aminoalkene Hydroamination». Organometallics. 30 (6): 1493–1506. doi:10.1021/om101063m.
- ^ Penafiel, J.; Maron, L.; Harder, S. (2014). «Early Main Group Metal Catalysis: How Important is the Metal?» (PDF). Angew. Chem. Int. Ed. 54 (1): 201–06. doi:10.1002/anie.201408814. PMID 25376952.
- ^ a b Greenwood and Earnshaw, pp. 136–37
- ^ a b Cameron, A. G. W. (1973). «Abundance of the Elements in the Solar System» (PDF). Space Science Reviews. 15 (1): 121–46. Bibcode:1973SSRv…15..121C. doi:10.1007/BF00172440. S2CID 120201972.
- ^ a b c Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. pp. 184–98. ISBN 9780521530835.
- ^ a b c Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Arnold, R.; et al. (NEMO-3 Collaboration) (2016). «Measurement of the double-beta decay half-life and search for the neutrinoless double-beta decay of 48Ca with the NEMO-3 detector». Physical Review D. 93 (11): 112008. arXiv:1604.01710. Bibcode:2016PhRvD..93k2008A. doi:10.1103/PhysRevD.93.112008. S2CID 55485404.
- ^ Russell, W. A.; Papanastassiou, D. A.; Tombrello, T. A. (1978). «Ca isotope fractionation on the earth and other solar system materials». Geochim Cosmochim Acta. 42 (8): 1075–90. Bibcode:1978GeCoA..42.1075R. doi:10.1016/0016-7037(78)90105-9.
- ^ Skulan, J.; Depaolo, D. J. (1999). «Calcium isotope fractionation between soft and mineralized tissues as a monitor of calcium use in vertebrates». Proc Natl Acad Sci USA. 96 (24): 13709–13. Bibcode:1999PNAS…9613709S. doi:10.1073/pnas.96.24.13709. PMC 24129. PMID 10570137.
- ^ a b c d e Greenwood and Earnshaw, p. 108
- ^ Miller, M. Michael. «Commodity report:Lime» (PDF). United States Geological Survey. Retrieved 2012-03-06.
- ^ Garfinkel, Yosef (1987). «Burnt Lime Products and Social Implications in the Pre-Pottery Neolithic B Villages of the Near East». Paléorient. 13 (1): 69–76. doi:10.3406/paleo.1987.4417. JSTOR 41492234.
- ^ Williams, Richard (2004). Lime Kilns and Lime Burning. p. 4. ISBN 978-0-7478-0596-0.
- ^ Oates, J. A. H (2008). Lime and Limestone: Chemistry and Technology, Production and Uses. ISBN 978-3-527-61201-7.
- ^ a b Weeks, Mary Elvira; Leichester, Henry M. (1968). Discovery of the Elements. Easton, PA: Journal of Chemical Education. pp. 505–10. ISBN 978-0-7661-3872-8. LCCN 68-15217.
- ^ p. 218 of: Lavoisier with Robert Kerr, trans., Elements of Chemistry, 4th ed. (Edinburgh, Scotland: William Creech, 1799). (The original passage appears in: Lavoisier, Traité Élémentaire de Chimie, (Paris, France: Cuchet, 1789), vol. 1, p. 174.)
- ^ Davy, H. (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London. 98: 333–70. Bibcode:1808RSPT…98..333D. doi:10.1098/rstl.1808.0023.
- ^ a b c Greenwood and Earnshaw, p. 110
- ^ a b Berner, Robert (2003). «The long-term carbon cycle, fossil fuels and atmospheric composition». Nature. 426 (6964): 323–26. Bibcode:2003Natur.426..323B. doi:10.1038/nature02131. PMID 14628061. S2CID 4420185.
- ^ Zeebe (2006). «Marine carbonate chemistry». National Council for Science and the Environment. Retrieved 2010-03-13.
- ^ Walker, James C. G.; Hays, P. B.; Kasting, J. F. (1981-10-20). «A negative feedback mechanism for the long-term stabilization of Earth’s surface temperature». Journal of Geophysical Research: Oceans. 86 (C10): 9776–82. Bibcode:1981JGR….86.9776W. doi:10.1029/JC086iC10p09776. ISSN 2156-2202.
- ^ a b c Hluchan and Pomerantz, pp. 485–87
- ^ a b Rumack BH. POISINDEX. Information System Micromedex, Inc., Englewood, CO, 2010; CCIS Volume 143. Hall AH and Rumack BH (Eds)
- ^ Skulan, J.; Depaolo, D. J.; Owens, T. L. (June 1997). «Biological control of calcium isotopic abundances in the global calcium cycle». Geochimica et Cosmochimica Acta. 61 (12): 2505–10. Bibcode:1997GeCoA..61.2505S. doi:10.1016/S0016-7037(97)00047-1.
- ^ a b Skulan, J.; Bullen, T.; Anbar, A. D.; Puzas, J. E.; Shackelford, L.; Leblanc, A.; Smith, S. M. (2007). «Natural calcium isotopic composition of urine as a marker of bone mineral balance». Clinical Chemistry. 53 (6): 1155–58. doi:10.1373/clinchem.2006.080143. PMID 17463176.
- ^ Fantle, M.; Depaolo, D. (2007). «Ca isotopes in carbonate sediment and pore fluid from ODP Site 807A: The Ca2+(aq)–calcite equilibrium fractionation factor and calcite recrystallization rates in Pleistocene sediments». Geochim Cosmochim Acta. 71 (10): 2524–46. Bibcode:2007GeCoA..71.2524F. doi:10.1016/j.gca.2007.03.006.
- ^ Griffith, Elizabeth M.; Paytan, Adina; Caldeira, Ken; Bullen, Thomas; Thomas, Ellen (2008). «A Dynamic marine calcium cycle during the past 28 million years». Science. 322 (12): 1671–74. Bibcode:2008Sci…322.1671G. doi:10.1126/science.1163614. PMID 19074345. S2CID 206515318.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. (2011). «ch 6. Tolerable Upper Intake Levels». Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. pp. 403–56. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. (2011). «ch. 5. Dietary Reference Intakes». Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. pp. 345–402. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Balk EM, Adam GP, Langberg VN, Earley A, Clark P, Ebeling PR, Mithal A, Rizzoli R, Zerbini CA, Pierroz DD, Dawson-Hughes B (December 2017). «Global dietary calcium intake among adults: a systematic review». Osteoporosis International. 28 (12): 3315–24. doi:10.1007/s00198-017-4230-x. PMC 5684325. PMID 29026938.
- ^
Sosa Torres, Martha; Kroneck, Peter M.H; «Introduction: From Rocks to Living Cells» pp. 1–32 in «Metals, Microbes and Minerals: The Biogeochemical Side of Life» (2021) pp. xiv + 341. Walter de Gruyter, Berlin. Editors Kroneck, Peter M.H. and Sosa Torres, Martha. doi:10.1515/9783110589771-001 - ^ a b c d e f g Hluchan and Pomerantz, pp. 489–94
- ^ «Calcium turnings, 99% trace metals basis». Sigma-Aldrich. 2021-02-24. Retrieved 2021-12-22.
- ^ a b Hluchan and Pomerantz, pp. 487–89
Bibliography
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Hluchan, Stephen E.; Pomerantz, Kenneth. «Calcium and Calcium Alloys». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_515.pub2.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | dull gray, silver; with a pale yellow tint[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ca) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calcium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1115 K (842 °C, 1548 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1757 K (1484 °C, 2703 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 1.55 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 1.378 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 8.54 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporisation | 154.7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.929 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapour pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | +1,[3] +2 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionisation energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 176±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 231 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of calcium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centred cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 3810 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 22.3 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 201 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 33.6 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +40.0×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 20 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 7.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 170–416 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of calcium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Calcium is a chemical element with the symbol Ca and atomic number 20. As an alkaline earth metal, calcium is a reactive metal that forms a dark oxide-nitride layer when exposed to air. Its physical and chemical properties are most similar to its heavier homologues strontium and barium. It is the fifth most abundant element in Earth’s crust, and the third most abundant metal, after iron and aluminium. The most common calcium compound on Earth is calcium carbonate, found in limestone and the fossilised remnants of early sea life; gypsum, anhydrite, fluorite, and apatite are also sources of calcium. The name derives from Latin calx «lime», which was obtained from heating limestone.
Some calcium compounds were known to the ancients, though their chemistry was unknown until the seventeenth century. Pure calcium was isolated in 1808 via electrolysis of its oxide by Humphry Davy, who named the element. Calcium compounds are widely used in many industries: in foods and pharmaceuticals for calcium supplementation, in the paper industry as bleaches, as components in cement and electrical insulators, and in the manufacture of soaps. On the other hand, the metal in pure form has few applications due to its high reactivity; still, in small quantities it is often used as an alloying component in steelmaking, and sometimes, as a calcium–lead alloy, in making automotive batteries.
Calcium is the most abundant metal and the fifth-most abundant element in the human body.[5] As electrolytes, calcium ions (Ca2+) play a vital role in the physiological and biochemical processes of organisms and cells: in signal transduction pathways where they act as a second messenger; in neurotransmitter release from neurons; in contraction of all muscle cell types; as cofactors in many enzymes; and in fertilization.[5] Calcium ions outside cells are important for maintaining the potential difference across excitable cell membranes, protein synthesis, and bone formation.[5][6]
Characteristics
Classification
Calcium is a very ductile silvery metal (sometimes described as pale yellow) whose properties are very similar to the heavier elements in its group, strontium, barium, and radium. A calcium atom has twenty electrons, arranged in the electron configuration [Ar]4s2. Like the other elements placed in group 2 of the periodic table, calcium has two valence electrons in the outermost s-orbital, which are very easily lost in chemical reactions to form a dipositive ion with the stable electron configuration of a noble gas, in this case argon.[7]
Hence, calcium is almost always divalent in its compounds, which are usually ionic. Hypothetical univalent salts of calcium would be stable with respect to their elements, but not to disproportionation to the divalent salts and calcium metal, because the enthalpy of formation of MX2 is much higher than those of the hypothetical MX. This occurs because of the much greater lattice energy afforded by the more highly charged Ca2+ cation compared to the hypothetical Ca+ cation.[7]
Calcium, strontium, barium, and radium are always considered to be alkaline earth metals; the lighter beryllium and magnesium, also in group 2 of the periodic table, are often included as well. Nevertheless, beryllium and magnesium differ significantly from the other members of the group in their physical and chemical behaviour: they behave more like aluminium and zinc respectively and have some of the weaker metallic character of the post-transition metals, which is why the traditional definition of the term «alkaline earth metal» excludes them.[8]
Physical properties
Calcium metal melts at 842 °C and boils at 1494 °C; these values are higher than those for magnesium and strontium, the neighbouring group 2 metals. It crystallises in the face-centered cubic arrangement like strontium; above 450 °C, it changes to an anisotropic hexagonal close-packed arrangement like magnesium. Its density of 1.55 g/cm3 is the lowest in its group.[7]
Calcium is harder than lead but can be cut with a knife with effort. While calcium is a poorer conductor of electricity than copper or aluminium by volume, it is a better conductor by mass than both due to its very low density.[9] While calcium is infeasible as a conductor for most terrestrial applications as it reacts quickly with atmospheric oxygen, its use as such in space has been considered.[10]
Chemical properties
Structure of the polymeric [Ca(H2O)6]2+ center in hydrated calcium chloride, illustrating the high coordination number typical for calcium complexes.
The chemistry of calcium is that of a typical heavy alkaline earth metal. For example, calcium spontaneously reacts with water more quickly than magnesium and less quickly than strontium to produce calcium hydroxide and hydrogen gas. It also reacts with the oxygen and nitrogen in the air to form a mixture of calcium oxide and calcium nitride.[11] When finely divided, it spontaneously burns in air to produce the nitride. In bulk, calcium is less reactive: it quickly forms a hydration coating in moist air, but below 30% relative humidity it may be stored indefinitely at room temperature.[12]
Besides the simple oxide CaO, the peroxide CaO2 can be made by direct oxidation of calcium metal under a high pressure of oxygen, and there is some evidence for a yellow superoxide Ca(O2)2.[13] Calcium hydroxide, Ca(OH)2, is a strong base, though it is not as strong as the hydroxides of strontium, barium or the alkali metals.[14] All four dihalides of calcium are known.[15] Calcium carbonate (CaCO3) and calcium sulfate (CaSO4) are particularly abundant minerals.[16] Like strontium and barium, as well as the alkali metals and the divalent lanthanides europium and ytterbium, calcium metal dissolves directly in liquid ammonia to give a dark blue solution.[7]
Due to the large size of the calcium ion (Ca2+), high coordination numbers are common, up to 24 in some intermetallic compounds such as CaZn13.[17] Calcium is readily complexed by oxygen chelates such as EDTA and polyphosphates, which are useful in analytic chemistry and removing calcium ions from hard water. In the absence of steric hindrance, smaller group 2 cations tend to form stronger complexes, but when large polydentate macrocycles are involved the trend is reversed.[16]
Although calcium is in the same group as magnesium and organomagnesium compounds are very commonly used throughout chemistry, organocalcium compounds are not similarly widespread because they are more difficult to make and more reactive, although they have recently been investigated as possible catalysts.[18][19][20][21][22] Organocalcium compounds tend to be more similar to organoytterbium compounds due to the similar ionic radii of Yb2+ (102 pm) and Ca2+ (100 pm).[23]
Most of these compounds can only be prepared at low temperatures; bulky ligands tend to favor stability. For example, calcium dicyclopentadienyl, Ca(C5H5)2, must be made by directly reacting calcium metal with mercurocene or cyclopentadiene itself; replacing the C5H5 ligand with the bulkier C5(CH3)5 ligand on the other hand increases the compound’s solubility, volatility, and kinetic stability.[23]
Isotopes
Natural calcium is a mixture of five stable isotopes (40Ca, 42Ca, 43Ca, 44Ca, and 46Ca) and one isotope with a half-life so long that it can be considered stable for all practical purposes (48Ca, with a half-life of about 4.3 × 1019 years). Calcium is the first (lightest) element to have six naturally occurring isotopes.[11]
By far the most common isotope of calcium in nature is 40Ca, which makes up 96.941% of all natural calcium. It is produced in the silicon-burning process from fusion of alpha particles and is the heaviest stable nuclide with equal proton and neutron numbers; its occurrence is also supplemented slowly by the decay of primordial 40K. Adding another alpha particle leads to unstable 44Ti, which quickly decays via two successive electron captures to stable 44Ca; this makes up 2.806% of all natural calcium and is the second-most common isotope.[24][25]
The other four natural isotopes, 42Ca, 43Ca, 46Ca, and 48Ca, are significantly rarer, each comprising less than 1% of all natural calcium. The four lighter isotopes are mainly products of the oxygen-burning and silicon-burning processes, leaving the two heavier ones to be produced via neutron capture processes. 46Ca is mostly produced in a «hot» s-process, as its formation requires a rather high neutron flux to allow short-lived 45Ca to capture a neutron. 48Ca is produced by electron capture in the r-process in type Ia supernovae, where high neutron excess and low enough entropy ensures its survival.[24][25]
46Ca and 48Ca are the first «classically stable» nuclides with a six-neutron or eight-neutron excess respectively. Although extremely neutron-rich for such a light element, 48Ca is very stable because it is a doubly magic nucleus, having 20 protons and 28 neutrons arranged in closed shells. Its beta decay to 48Sc is very hindered because of the gross mismatch of nuclear spin: 48Ca has zero nuclear spin, being even–even, while 48Sc has spin 6+, so the decay is forbidden by the conservation of angular momentum. While two excited states of 48Sc are available for decay as well, they are also forbidden due to their high spins. As a result, when 48Ca does decay, it does so by double beta decay to 48Ti instead, being the lightest nuclide known to undergo double beta decay.[26][27]
The heavy isotope 46Ca can also theoretically undergo double beta decay to 46Ti as well, but this has never been observed. The lightest and most common isotope 40Ca is also doubly magic and could undergo double electron capture to 40Ar, but this has likewise never been observed. Calcium is the only element to have two primordial doubly magic isotopes. The experimental lower limits for the half-lives of 40Ca and 46Ca are 5.9 × 1021 years and 2.8 × 1015 years respectively.[26]
Apart from the practically stable 48Ca, the longest lived radioisotope of calcium is 41Ca. It decays by electron capture to stable 41K with a half-life of about a hundred thousand years. Its existence in the early Solar System as an extinct radionuclide has been inferred from excesses of 41K: traces of 41Ca also still exist today, as it is a cosmogenic nuclide, continuously reformed through neutron activation of natural 40Ca.[25]
Many other calcium radioisotopes are known, ranging from 35Ca to 60Ca. They are all much shorter-lived than 41Ca, the most stable among them being 45Ca (half-life 163 days) and 47Ca (half-life 4.54 days). The isotopes lighter than 42Ca usually undergo beta plus decay to isotopes of potassium, and those heavier than 44Ca usually undergo beta minus decay to isotopes of scandium, although near the nuclear drip lines, proton emission and neutron emission begin to be significant decay modes as well.[26]
Like other elements, a variety of processes alter the relative abundance of calcium isotopes.[28] The best studied of these processes is the mass-dependent fractionation of calcium isotopes that accompanies the precipitation of calcium minerals such as calcite, aragonite and apatite from solution. Lighter isotopes are preferentially incorporated into these minerals, leaving the surrounding solution enriched in heavier isotopes at a magnitude of roughly 0.025% per atomic mass unit (amu) at room temperature. Mass-dependent differences in calcium isotope composition are conventionally expressed by the ratio of two isotopes (usually 44Ca/40Ca) in a sample compared to the same ratio in a standard reference material. 44Ca/40Ca varies by about 1% among common earth materials.[29]
History
Calcium compounds were known for millennia, although their chemical makeup was not understood until the 17th century.[30] Lime as a building material[31] and as plaster for statues was used as far back as around 7000 BC.[32] The first dated lime kiln dates back to 2500 BC and was found in Khafajah, Mesopotamia.[33][34]
At about the same time, dehydrated gypsum (CaSO4·2H2O) was being used in the Great Pyramid of Giza. This material would later be used for the plaster in the tomb of Tutankhamun. The ancient Romans instead used lime mortars made by heating limestone (CaCO3). The name «calcium» itself derives from the Latin word calx «lime».[30]
Vitruvius noted that the lime that resulted was lighter than the original limestone, attributing this to the boiling of the water. In 1755, Joseph Black proved that this was due to the loss of carbon dioxide, which as a gas had not been recognised by the ancient Romans.[35]
In 1789, Antoine Lavoisier suspected that lime might be an oxide of a fundamental chemical element. In his table of the elements, Lavoisier listed five «salifiable earths» (i.e., ores that could be made to react with acids to produce salts (salis = salt, in Latin): chaux (calcium oxide), magnésie (magnesia, magnesium oxide), baryte (barium sulfate), alumine (alumina, aluminium oxide), and silice (silica, silicon dioxide)). About these «elements», Lavoisier reasoned:
We are probably only acquainted as yet with a part of the metallic substances existing in nature, as all those which have a stronger affinity to oxygen than carbon possesses, are incapable, hitherto, of being reduced to a metallic state, and consequently, being only presented to our observation under the form of oxyds, are confounded with earths. It is extremely probable that barytes, which we have just now arranged with earths, is in this situation; for in many experiments it exhibits properties nearly approaching to those of metallic bodies. It is even possible that all the substances we call earths may be only metallic oxyds, irreducible by any hitherto known process.[36]
Calcium, along with its congeners magnesium, strontium, and barium, was first isolated by Humphry Davy in 1808. Following the work of Jöns Jakob Berzelius and Magnus Martin af Pontin on electrolysis, Davy isolated calcium and magnesium by putting a mixture of the respective metal oxides with mercury(II) oxide on a platinum plate which was used as the anode, the cathode being a platinum wire partially submerged into mercury. Electrolysis then gave calcium–mercury and magnesium–mercury amalgams, and distilling off the mercury gave the metal.[30][37] However, pure calcium cannot be prepared in bulk by this method and a workable commercial process for its production was not found until over a century later.[35]
Occurrence and production
At 3%, calcium is the fifth most abundant element in the Earth’s crust, and the third most abundant metal behind aluminium and iron.[30] It is also the fourth most abundant element in the lunar highlands.[12] Sedimentary calcium carbonate deposits pervade the Earth’s surface as fossilized remains of past marine life; they occur in two forms, the rhombohedral calcite (more common) and the orthorhombic aragonite (forming in more temperate seas). Minerals of the first type include limestone, dolomite, marble, chalk, and iceland spar; aragonite beds make up the Bahamas, the Florida Keys, and the Red Sea basins. Corals, sea shells, and pearls are mostly made up of calcium carbonate. Among the other important minerals of calcium are gypsum (CaSO4·2H2O), anhydrite (CaSO4), fluorite (CaF2), and apatite ([Ca5(PO4)3F]).[30]
The major producers of calcium are China (about 10000 to 12000 tonnes per year), Russia (about 6000 to 8000 tonnes per year), and the United States (about 2000 to 4000 tonnes per year). Canada and France are also among the minor producers. In 2005, about 24000 tonnes of calcium were produced; about half of the world’s extracted calcium is used by the United States, with about 80% of the output used each year.[10]
In Russia and China, Davy’s method of electrolysis is still used, but is instead applied to molten calcium chloride.[10] Since calcium is less reactive than strontium or barium, the oxide–nitride coating that results in air is stable and lathe machining and other standard metallurgical techniques are suitable for calcium.[38] In the United States and Canada, calcium is instead produced by reducing lime with aluminium at high temperatures.[10]
Geochemical cycling
Calcium cycling provides a link between tectonics, climate, and the carbon cycle. In the simplest terms, uplift of mountains exposes calcium-bearing rocks such as some granites to chemical weathering and releases Ca2+ into surface water. These ions are transported to the ocean where they react with dissolved CO2 to form limestone (CaCO
3), which in turn settles to the sea floor where it is incorporated into new rocks. Dissolved CO2, along with carbonate and bicarbonate ions, are termed «dissolved inorganic carbon» (DIC).[39]
The actual reaction is more complicated and involves the bicarbonate ion (HCO−
3) that forms when CO2 reacts with water at seawater pH:
- Ca2+
+ 2HCO−
3 → CaCO
3(s) + CO
2 + H
2O
At seawater pH, most of the CO2 is immediately converted back into HCO−
3. The reaction results in a net transport of one molecule of CO2 from the ocean/atmosphere into the lithosphere.[40] The result is that each Ca2+ ion released by chemical weathering ultimately removes one CO2 molecule from the surficial system (atmosphere, ocean, soils and living organisms), storing it in carbonate rocks where it is likely to stay for hundreds of millions of years. The weathering of calcium from rocks thus scrubs CO2 from the ocean and atmosphere, exerting a strong long-term effect on climate.[39][41]
Uses
The largest use of metallic calcium is in steelmaking, due to its strong chemical affinity for oxygen and sulfur. Its oxides and sulfides, once formed, give liquid lime aluminate and sulfide inclusions in steel which float out; on treatment, these inclusions disperse throughout the steel and become small and spherical, improving castability, cleanliness and general mechanical properties. Calcium is also used in maintenance-free automotive batteries, in which the use of 0.1% calcium–lead alloys instead of the usual antimony–lead alloys leads to lower water loss and lower self-discharging.[42]
Due to the risk of expansion and cracking, aluminium is sometimes also incorporated into these alloys. These lead–calcium alloys are also used in casting, replacing lead–antimony alloys.[42] Calcium is also used to strengthen aluminium alloys used for bearings, for the control of graphitic carbon in cast iron, and to remove bismuth impurities from lead.[38] Calcium metal is found in some drain cleaners, where it functions to generate heat and calcium hydroxide that saponifies the fats and liquefies the proteins (for example, those in hair) that block drains.[43]
Besides metallurgy, the reactivity of calcium is exploited to remove nitrogen from high-purity argon gas and as a getter for oxygen and nitrogen. It is also used as a reducing agent in the production of chromium, zirconium, thorium, and uranium. It can also be used to store hydrogen gas, as it reacts with hydrogen to form solid calcium hydride, from which the hydrogen can easily be re-extracted.[38]
Calcium isotope fractionation during mineral formation has led to several applications of calcium isotopes. In particular, the 1997 observation by Skulan and DePaolo[44] that calcium minerals are isotopically lighter than the solutions from which the minerals precipitate is the basis of analogous applications in medicine and in paleoceanography. In animals with skeletons mineralized with calcium, the calcium isotopic composition of soft tissues reflects the relative rate of formation and dissolution of skeletal mineral.[45]
In humans, changes in the calcium isotopic composition of urine have been shown to be related to changes in bone mineral balance. When the rate of bone formation exceeds the rate of bone resorption, the 44Ca/40Ca ratio in soft tissue rises and vice versa. Because of this relationship, calcium isotopic measurements of urine or blood may be useful in the early detection of metabolic bone diseases like osteoporosis.[45]
A similar system exists in seawater, where 44Ca/40Ca tends to rise when the rate of removal of Ca2+ by mineral precipitation exceeds the input of new calcium into the ocean. In 1997, Skulan and DePaolo presented the first evidence of change in seawater 44Ca/40Ca over geologic time, along with a theoretical explanation of these changes. More recent papers have confirmed this observation, demonstrating that seawater Ca2+ concentration is not constant, and that the ocean is never in a «steady state» with respect to calcium input and output. This has important climatological implications, as the marine calcium cycle is closely tied to the carbon cycle.[46][47]
Many calcium compounds are used in food, as pharmaceuticals, and in medicine, among others. For example, calcium and phosphorus are supplemented in foods through the addition of calcium lactate, calcium diphosphate, and tricalcium phosphate. The last is also used as a polishing agent in toothpaste and in antacids. Calcium lactobionate is a white powder that is used as a suspending agent for pharmaceuticals. In baking, calcium phosphate is used as a leavening agent. Calcium sulfite is used as a bleach in papermaking and as a disinfectant, calcium silicate is used as a reinforcing agent in rubber, and calcium acetate is a component of liming rosin and is used to make metallic soaps and synthetic resins.[42]
Calcium is on the World Health Organization’s List of Essential Medicines.[48]
Food sources
Foods rich in calcium include dairy products, such as yogurt and cheese, sardines, salmon, soy products, kale, and fortified breakfast cereals.[6]
Because of concerns for long-term adverse side effects, including calcification of arteries and kidney stones, both the U.S. Institute of Medicine (IOM) and the European Food Safety Authority (EFSA) set Tolerable Upper Intake Levels (ULs) for combined dietary and supplemental calcium. From the IOM, people of ages 9–18 years are not to exceed 3 g/day combined intake; for ages 19–50, not to exceed 2.5 g/day; for ages 51 and older, not to exceed 2 g/day.[49] EFSA set the UL for all adults at 2.5 g/day, but decided the information for children and adolescents was not sufficient to determine ULs.[50]
Biological and pathological role
| Age | Calcium (mg/day) |
|---|---|
| 1–3 years | 700 |
| 4–8 years | 1000 |
| 9–18 years | 1300 |
| 19–50 years | 1000 |
| >51 years | 1000 |
| Pregnancy | 1000 |
| Lactation | 1000 |
Global dietary calcium intake among adults (mg/day).[52]
<400
400–500
500–600
600–700
700–800
800–900
900–1000
>1000
Function
Calcium is an essential element needed in large quantities.[5][6] The Ca2+ ion acts as an electrolyte and is vital to the health of the muscular, circulatory, and digestive systems; is indispensable to the building of bone; and supports synthesis and function of blood cells. For example, it regulates the contraction of muscles, nerve conduction, and the clotting of blood. As a result, intra- and extracellular calcium levels are tightly regulated by the body. Calcium can play this role because the Ca2+ ion forms stable coordination complexes with many organic compounds, especially proteins; it also forms compounds with a wide range of solubilities, enabling the formation of the skeleton.[5]
[53]
Binding
Calcium ions may be complexed by proteins through binding the carboxyl groups of glutamic acid or aspartic acid residues; through interacting with phosphorylated serine, tyrosine, or threonine residues; or by being chelated by γ-carboxylated amino acid residues. Trypsin, a digestive enzyme, uses the first method; osteocalcin, a bone matrix protein, uses the third.[54]
Some other bone matrix proteins such as osteopontin and bone sialoprotein use both the first and the second. Direct activation of enzymes by binding calcium is common; some other enzymes are activated by noncovalent association with direct calcium-binding enzymes. Calcium also binds to the phospholipid layer of the cell membrane, anchoring proteins associated with the cell surface.[54]
Solubility
As an example of the wide range of solubility of calcium compounds, monocalcium phosphate is very soluble in water, 85% of extracellular calcium is as dicalcium phosphate with a solubility of 2.0 mM and the hydroxyapatite of bones in an organic matrix is tricalcium phosphate at 100 μM.[54]
Nutrition
Calcium is a common constituent of multivitamin dietary supplements,[5] but the composition of calcium complexes in supplements may affect its bioavailability which varies by solubility of the salt involved: calcium citrate, malate, and lactate are highly bioavailable, while the oxalate is less. Other calcium preparations include calcium carbonate, calcium citrate malate, and calcium gluconate.[5] The intestine absorbs about one-third of calcium eaten as the free ion, and plasma calcium level is then regulated by the kidneys.[5]
Hormonal regulation of bone formation and serum levels
Parathyroid hormone and vitamin D promote the formation of bone by allowing and enhancing the deposition of calcium ions there, allowing rapid bone turnover without affecting bone mass or mineral content.[5] When plasma calcium levels fall, cell surface receptors are activated and the secretion of parathyroid hormone occurs; it then proceeds to stimulate the entry of calcium into the plasma pool by taking it from targeted kidney, gut, and bone cells, with the bone-forming action of parathyroid hormone being antagonised by calcitonin, whose secretion increases with increasing plasma calcium levels.[54]
Abnormal serum levels
Excess intake of calcium may cause hypercalcemia. However, because calcium is absorbed rather inefficiently by the intestines, high serum calcium is more likely caused by excessive secretion of parathyroid hormone (PTH) or possibly by excessive intake of vitamin D, both of which facilitate calcium absorption. All these conditions result in excess calcium salts being deposited in the heart, blood vessels, or kidneys. Symptoms include anorexia, nausea, vomiting, memory loss, confusion, muscle weakness, increased urination, dehydration, and metabolic bone disease.[54]
Chronic hypercalcaemia typically leads to calcification of soft tissue and its serious consequences: for example, calcification can cause loss of elasticity of vascular walls and disruption of laminar blood flow—and thence to plaque rupture and thrombosis. Conversely, inadequate calcium or vitamin D intakes may result in hypocalcemia, often caused also by inadequate secretion of parathyroid hormone or defective PTH receptors in cells. Symptoms include neuromuscular excitability, which potentially causes tetany and disruption of conductivity in cardiac tissue.[54]
Bone disease
As calcium is required for bone development, many bone diseases can be traced to the organic matrix or the hydroxyapatite in molecular structure or organization of bone. Osteoporosis is a reduction in mineral content of bone per unit volume, and can be treated by supplementation of calcium, vitamin D, and bisphosphonates.[5][6] Inadequate amounts of calcium, vitamin D, or phosphates can lead to softening of bones, called osteomalacia.[54]
Safety
Metallic calcium
| Hazards | |
|---|---|
| GHS labelling:[55] | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H261 |
|
Precautionary statements |
P231+P232 |
| NFPA 704 (fire diamond) |
0 3 1
|
Because calcium reacts exothermically with water and acids, calcium metal coming into contact with bodily moisture results in severe corrosive irritation.[56] When swallowed, calcium metal has the same effect on the mouth, oesophagus, and stomach, and can be fatal.[43] However, long-term exposure is not known to have distinct adverse effects.[56]
References
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 112. ISBN 978-0-08-037941-8.
- ^ «Standard Atomic Weights: Calcium». CIAAW. 1983.
- ^ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias (2010). «Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes». Journal of the American Chemical Society. 132 (35): 12492–12501. doi:10.1021/ja105534w. PMID 20718434.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g h i j «Calcium». Linus Pauling Institute, Oregon State University, Corvallis, Oregon. 1 September 2017. Retrieved 31 August 2019.
- ^ a b c d «Calcium: Fact Sheet for Health Professionals». Office of Dietary Supplements, US National Institutes of Health. 9 July 2019. Retrieved 31 August 2019.
- ^ a b c d Greenwood and Earnshaw, pp. 112–13
- ^ Parish, R. V. (1977). The Metallic Elements. London: Longman. p. 34. ISBN 978-0-582-44278-8.
- ^ Ropp, Richard C. (2012). Encyclopedia of the Alkaline Earth Compounds. pp. 12–15. ISBN 978-0-444-59553-9.
- ^ a b c d Hluchan and Pomerantz, p. 484
- ^ a b C. R. Hammond The elements (pp. 4–35) in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ a b Hluchan and Pomerantz, p. 483
- ^ Greenwood and Earnshaw, p. 119
- ^ Greenwood and Earnshaw, p. 121
- ^ Greenwood and Earnshaw, p. 117
- ^ a b Greenwood and Earnshaw, pp. 122–15
- ^ Greenwood and Earnshaw, p. 115
- ^ Harder, S.; Feil, F.; Knoll, K. (2001). «Novel Calcium Half-Sandwich Complexes for the Living and Stereoselective Polymerization of Styrene». Angew. Chem. Int. Ed. 40 (22): 4261–64. doi:10.1002/1521-3773(20011119)40:22<4261::AID-ANIE4261>3.0.CO;2-J. PMID 29712082.
- ^ Crimmin, Mark R.; Casely, Ian J.; Hill, Michael S. (2005). «Calcium-Mediated Intramolecular Hydroamination Catalysis». Journal of the American Chemical Society. 127 (7): 2042–43. doi:10.1021/ja043576n. PMID 15713071.
- ^ Jenter, Jelena; Köppe, Ralf; Roesky, Peter W. (2011). «2,5-Bis{N-(2,6-diisopropylphenyl)iminomethyl}pyrrolyl Complexes of the Heavy Alkaline Earth Metals: Synthesis, Structures, and Hydroamination Catalysis». Organometallics. 30 (6): 1404–13. doi:10.1021/om100937c.
- ^ Arrowsmith, Merle; Crimmin, Mark R.; Barrett, Anthony G. M.; Hill, Michael S.; Kociok-Köhn, Gabriele; Procopiou, Panayiotis A. (2011). «Cation Charge Density and Precatalyst Selection in Group 2-Catalyzed Aminoalkene Hydroamination». Organometallics. 30 (6): 1493–1506. doi:10.1021/om101063m.
- ^ Penafiel, J.; Maron, L.; Harder, S. (2014). «Early Main Group Metal Catalysis: How Important is the Metal?» (PDF). Angew. Chem. Int. Ed. 54 (1): 201–06. doi:10.1002/anie.201408814. PMID 25376952.
- ^ a b Greenwood and Earnshaw, pp. 136–37
- ^ a b Cameron, A. G. W. (1973). «Abundance of the Elements in the Solar System» (PDF). Space Science Reviews. 15 (1): 121–46. Bibcode:1973SSRv…15..121C. doi:10.1007/BF00172440. S2CID 120201972.
- ^ a b c Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. pp. 184–98. ISBN 9780521530835.
- ^ a b c Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Arnold, R.; et al. (NEMO-3 Collaboration) (2016). «Measurement of the double-beta decay half-life and search for the neutrinoless double-beta decay of 48Ca with the NEMO-3 detector». Physical Review D. 93 (11): 112008. arXiv:1604.01710. Bibcode:2016PhRvD..93k2008A. doi:10.1103/PhysRevD.93.112008. S2CID 55485404.
- ^ Russell, W. A.; Papanastassiou, D. A.; Tombrello, T. A. (1978). «Ca isotope fractionation on the earth and other solar system materials». Geochim Cosmochim Acta. 42 (8): 1075–90. Bibcode:1978GeCoA..42.1075R. doi:10.1016/0016-7037(78)90105-9.
- ^ Skulan, J.; Depaolo, D. J. (1999). «Calcium isotope fractionation between soft and mineralized tissues as a monitor of calcium use in vertebrates». Proc Natl Acad Sci USA. 96 (24): 13709–13. Bibcode:1999PNAS…9613709S. doi:10.1073/pnas.96.24.13709. PMC 24129. PMID 10570137.
- ^ a b c d e Greenwood and Earnshaw, p. 108
- ^ Miller, M. Michael. «Commodity report:Lime» (PDF). United States Geological Survey. Retrieved 2012-03-06.
- ^ Garfinkel, Yosef (1987). «Burnt Lime Products and Social Implications in the Pre-Pottery Neolithic B Villages of the Near East». Paléorient. 13 (1): 69–76. doi:10.3406/paleo.1987.4417. JSTOR 41492234.
- ^ Williams, Richard (2004). Lime Kilns and Lime Burning. p. 4. ISBN 978-0-7478-0596-0.
- ^ Oates, J. A. H (2008). Lime and Limestone: Chemistry and Technology, Production and Uses. ISBN 978-3-527-61201-7.
- ^ a b Weeks, Mary Elvira; Leichester, Henry M. (1968). Discovery of the Elements. Easton, PA: Journal of Chemical Education. pp. 505–10. ISBN 978-0-7661-3872-8. LCCN 68-15217.
- ^ p. 218 of: Lavoisier with Robert Kerr, trans., Elements of Chemistry, 4th ed. (Edinburgh, Scotland: William Creech, 1799). (The original passage appears in: Lavoisier, Traité Élémentaire de Chimie, (Paris, France: Cuchet, 1789), vol. 1, p. 174.)
- ^ Davy, H. (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London. 98: 333–70. Bibcode:1808RSPT…98..333D. doi:10.1098/rstl.1808.0023.
- ^ a b c Greenwood and Earnshaw, p. 110
- ^ a b Berner, Robert (2003). «The long-term carbon cycle, fossil fuels and atmospheric composition». Nature. 426 (6964): 323–26. Bibcode:2003Natur.426..323B. doi:10.1038/nature02131. PMID 14628061. S2CID 4420185.
- ^ Zeebe (2006). «Marine carbonate chemistry». National Council for Science and the Environment. Retrieved 2010-03-13.
- ^ Walker, James C. G.; Hays, P. B.; Kasting, J. F. (1981-10-20). «A negative feedback mechanism for the long-term stabilization of Earth’s surface temperature». Journal of Geophysical Research: Oceans. 86 (C10): 9776–82. Bibcode:1981JGR….86.9776W. doi:10.1029/JC086iC10p09776. ISSN 2156-2202.
- ^ a b c Hluchan and Pomerantz, pp. 485–87
- ^ a b Rumack BH. POISINDEX. Information System Micromedex, Inc., Englewood, CO, 2010; CCIS Volume 143. Hall AH and Rumack BH (Eds)
- ^ Skulan, J.; Depaolo, D. J.; Owens, T. L. (June 1997). «Biological control of calcium isotopic abundances in the global calcium cycle». Geochimica et Cosmochimica Acta. 61 (12): 2505–10. Bibcode:1997GeCoA..61.2505S. doi:10.1016/S0016-7037(97)00047-1.
- ^ a b Skulan, J.; Bullen, T.; Anbar, A. D.; Puzas, J. E.; Shackelford, L.; Leblanc, A.; Smith, S. M. (2007). «Natural calcium isotopic composition of urine as a marker of bone mineral balance». Clinical Chemistry. 53 (6): 1155–58. doi:10.1373/clinchem.2006.080143. PMID 17463176.
- ^ Fantle, M.; Depaolo, D. (2007). «Ca isotopes in carbonate sediment and pore fluid from ODP Site 807A: The Ca2+(aq)–calcite equilibrium fractionation factor and calcite recrystallization rates in Pleistocene sediments». Geochim Cosmochim Acta. 71 (10): 2524–46. Bibcode:2007GeCoA..71.2524F. doi:10.1016/j.gca.2007.03.006.
- ^ Griffith, Elizabeth M.; Paytan, Adina; Caldeira, Ken; Bullen, Thomas; Thomas, Ellen (2008). «A Dynamic marine calcium cycle during the past 28 million years». Science. 322 (12): 1671–74. Bibcode:2008Sci…322.1671G. doi:10.1126/science.1163614. PMID 19074345. S2CID 206515318.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. (2011). «ch 6. Tolerable Upper Intake Levels». Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. pp. 403–56. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. (2011). «ch. 5. Dietary Reference Intakes». Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. pp. 345–402. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Balk EM, Adam GP, Langberg VN, Earley A, Clark P, Ebeling PR, Mithal A, Rizzoli R, Zerbini CA, Pierroz DD, Dawson-Hughes B (December 2017). «Global dietary calcium intake among adults: a systematic review». Osteoporosis International. 28 (12): 3315–24. doi:10.1007/s00198-017-4230-x. PMC 5684325. PMID 29026938.
- ^
Sosa Torres, Martha; Kroneck, Peter M.H; «Introduction: From Rocks to Living Cells» pp. 1–32 in «Metals, Microbes and Minerals: The Biogeochemical Side of Life» (2021) pp. xiv + 341. Walter de Gruyter, Berlin. Editors Kroneck, Peter M.H. and Sosa Torres, Martha. doi:10.1515/9783110589771-001 - ^ a b c d e f g Hluchan and Pomerantz, pp. 489–94
- ^ «Calcium turnings, 99% trace metals basis». Sigma-Aldrich. 2021-02-24. Retrieved 2021-12-22.
- ^ a b Hluchan and Pomerantz, pp. 487–89
Bibliography
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Hluchan, Stephen E.; Pomerantz, Kenneth. «Calcium and Calcium Alloys». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_515.pub2.
|
Кальций |
|
|---|---|
| Атомный номер |
20 |
| Внешний вид простого вещества |
|
| Свойства атома | |
|
Атомная масса (молярная масса) |
40,078 а. е. м. (г/моль) |
| Радиус атома |
197 пм |
|
Энергия ионизации (первый электрон) |
589,4 (6,11) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 4s2 |
| Химические свойства | |
| Ковалентный радиус |
174 пм |
| Радиус иона |
(+2e) 99 пм |
|
Электроотрицательность (по Полингу) |
1,00 |
| Электродный потенциал |
−2,76 В |
| Степени окисления |
2 |
| Термодинамические свойства простого вещества | |
| Плотность |
1,55 г/см³ |
| Молярная теплоёмкость |
25,9[1] Дж/(K·моль) |
| Теплопроводность |
(201) Вт/(м·K) |
| Температура плавления |
1112 K |
| Теплота плавления |
9,20 кДж/моль |
| Температура кипения |
1757 K |
| Теплота испарения |
153,6 кДж/моль |
| Молярный объём |
29,9 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированная |
| Параметры решётки |
5,580 Å |
| Отношение c/a | — |
| Температура Дебая |
230 K |
| Ca | 20 |
| 40,078 | |
| [Ar]4s2 | |
| Кальций |
Ка́льций —элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета.
История и происхождение названия
Схема атома кальция
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием. Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Нахождение в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа).
Изотопы
Кальций встречается в природе в виде смеси шести изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, среди которых наиболее распространённый — 40Ca — составляет 96,97 %.
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжелый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), как было недавно обнаружено, испытывает двойной бета-распад с периодом полураспада 5,3×1019 лет.
В горных породах и минералах
Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
Миграция в земной коре
В естественной миграции кальция существенную роль играет «карбонатное равновесие», связанное с обратимой реакцией взаимодействия карбоната кальция с водой и углекислым газом с образованием растворимого гидрокарбоната:
СаСО3 + H2O + CO2 ↔ Са (НСО3)2 ↔ Ca2+ + 2HCO3—
(равновесие смещается влево или вправо в зависимости от концентрации углекислого газа).
Огромную роль играет биогенная миграция.
В биосфере
Соединения кальция находятся практически во всех животных и растительных тканях (см. тж. ниже). Значительное количество кальция входит в состав живых организмов. Так, гидроксиапатит Ca5(PO4)3OH, или, в другой записи, 3Ca3(PO4)2·Са(OH)2 — основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. В живых тканях человека и животных 1,4-2 % Са (по массовой доле); в теле человека массой 70 кг содержание кальция — около 1,7 кг (в основном в составе межклеточного вещества костной ткани).
Получение
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C:
4CaO + 2Al = CaAl2O4 + 3Ca.
Свойства
Физические свойства
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм), выше устойчив β-Ca с кубической объемно-центрированной решеткой типа α-Fe (параметр a = 0,448 нм). Стандартная энтальпия ΔH0 перехода α → β составляет 0,93 кДж/моль.
Химические свойства
Кальций — типичный щелочноземельный металл. Химическая активность кальция высока, но ниже, чем всех других щелочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щелочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:
Ca + 2Н2О = Ca(ОН)2 + Н2↑ + Q.
С активными неметаллами (кислородом, хлором, бромом) кальций реагирует при обычных условиях:
2Са + О2 = 2СаО, Са + Br2 = CaBr2.
При нагревании на воздухе или в кислороде кальций воспламеняется. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Са + Н2 = СаН2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Са + 2С = СаС2,
3Са + 2Р = Са3Р2 (фосфид кальция), известны также фосфиды кальция составов СаР и СаР5;
2Ca + Si = Ca2Si (силицид кальция), известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты (то есть эти реакции — экзотермические). Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2↑,
Ca3N2 + 3Н2О = 3Са(ОН)2 + 2NH3↑.
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са(НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение:
СаСО3 + СО2 + Н2О = Са(НСО3)2.
В тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция:
Са(НСО3)2 = СаСО3 + СО2↑ + Н2О.
Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет временную жёсткость воды. Временной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Применение
Применение металлического кальция
Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудновосстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом находят применение в аккумуляторных батареях и подшипниковых сплавах. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов.
Металлотермия
Чистый металлический кальций широко применяется в металлотермии при получении редких металлов.
Легирование сплавов
Чистый кальций применяется для легирования свинца, идущего на изготовление аккумуляторных пластин, необслуживаемых стартерных свинцово-кислотных аккумуляторов с малым саморазрядом. Также металлический кальций идет на производство качественных кальциевых баббитов БКА.
Ядерный синтез
Изотоп 48Ca — наиболее эффективный и употребительный материал для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева. Например, в случае использования ионов 48Ca для получения сверхтяжёлых элементов на ускорителях ядра этих элементов образуются в сотни и тысячи раз эффективней, чем при использовании других «снарядов» (ионов).
Применение соединений кальция
Гидрид кальция
Нагреванием кальция в атмосфере водорода получают CaH2 (гидрид кальция), используемый в металлургии (металлотермии) и при получении водорода в полевых условиях.
Оптические и лазерные материалы
Фторид кальция (флюорит) применяется в виде монокристаллов в оптике (астрономические объективы, линзы, призмы) и как лазерный материал. Вольфрамат кальция (шеелит) в виде монокристаллов применяется в лазерной технике, а также как сцинтиллятор.
Карбид кальция
Карбид кальция CaC2 широко применяется для получения ацетилена и для восстановления металлов, а также при получении цианамида кальция (нагреванием карбида кальция в азоте при 1200 °C, реакция идет экзотермически, проводится в цианамидных печах).
Химические источники тока
Кальций, а также его сплавы с алюминием и магнием используются в резервных тепловых электрических батареях в качестве анода(например кальций-хроматный элемент). Хромат кальция используется в таких батареях в качестве катода. Особенность таких батарей — чрезвычайно долгий срок хранения (десятилетия) в пригодном состоянии, возможность эксплуатации в любых условиях (космос, высокие давления), большая удельная энергия по весу и объёму. Недостаток в недолгом сроке действия. Такие батареи используются там, где необходимо на короткий срок создать колоссальную электрическую мощность (баллистические ракеты, некоторые космические аппараты и.др.).
Огнеупорные материалы
Оксид кальция, как в свободном виде, так и в составе керамических смесей, применяется в производстве огнеупорных материалов.
Лекарственные средства
Соединения кальция широко применяются в качестве антигистаминного средства.
Хлорид кальция
Глюконат кальция
Глицерофосфат кальция
Кроме того, соединения кальция вводят в состав препаратов для профилактики остеопороза, в витаминные комплексы для беременных и пожилых.-
Биологическая роль кальция
Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть содержится в скелете и зубах в виде фосфатов. Из различных форм карбоната кальция (извести) состоят скелеты большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также в обеспечении постоянного осмотического давления крови. Ионы кальция также служат одним из универсальных вторичных посредников и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов и др. Концентрация кальция в цитоплазме клеток человека составляет около 10−7 моль, в межклеточных жидкостях около 10−3 моль.
Потребность в кальции зависит от возраста. Для взрослых необходимая дневная норма составляет от 800 до 1000 миллиграммов (мг), а для детей от 600 до 900 мг, что для детей очень важно из-за интенсивного роста скелета. Большая часть кальция, поступающего в организм человека с пищей, содержится в молочных продуктах, оставшийся кальций приходится на мясо, рыбу, и некоторые растительные продукты (особенно много содержат бобовые). Всасывание происходит как в толстом, так и тонком кишечнике и облегчается кислой средой, витамином Д и витамином С, лактозой, ненасыщеными жирными кислотами. Немаловажна роль магния в кальциевом обмене, при его недостатке кальций «вымывается» из костей и осаждается в почках (почечные камни) и мышцах.
Усваиванию кальция препятствуют аспирин, щавелевая кислота, производные эстрогенов. Соединияясь с щавелевой кислотой, кальций дает нерастворимые в воде соединения, которые являются компонентами камней в почках.
Содержания кальция в крови из-за большого количества связанных с ним процессов точно регулируется, и при правильном питании дефицита не возникает. Продолжительное отсутствие в рационе может вызвать судороги, боль в суставах, сонливость, дефекты роста, а также запоры. Более глубокий дефицит приводит к постоянным мышечным судорогам и остеопорозу. Злоупотребление кофе и алкоголем могут быть причинами дефицита кальция, так как часть его выводится с мочой.
Избыточные дозы кальция и витамина Д могут вызвать гиперкальцемию, после которой следует интенсивная кальцификация костей и тканей (в основном затрагивает мочевыделительную систему). Продолжительный переизбыток нарушает функционирование мышечных и нервных тканей, увеличивает свертываемость крови и уменьшает усвояемость цинка клетками костной ткани. Максимальная дневная безопасная доза составляет для взрослого от 1500 до 1800 миллиграмм.
Содержание кальция в продуктах питания:
Продукты Кальций, мг/100 г
Мак 1460
Кунжут 783
Крапива 713
Просвирник лесной 505
Подорожник большой 412
Галинсога 372
Сардины в масле 330
Будра плющевидная 289
Шиповник собачий 257
Миндаль 252
Подорожник ланцетолист. 248
Лесной орех 226
Амарант семя 214
Кресс-салат 214
Кале 212
Соя бобы сухие 201
Молоко коровье 120
Малое содержание кальция: рыба (30-90); творог (80); хлеб с отрубями (60); мясо, субпродукты, крупы, свекла (менее 50).
Рекомендуемые Всемирной Организацией Здравоохранения суточные нормы потребления кальция:
- Дети до 3 лет — 600 мг.
- Дети от 4 до 10 лет — 800 мг.
- Дети от 10 до 13 лет — 1000 мг.
- Подростки от 13 до 16 лет — 1200 мг.
- Молодежь от 16 и старше — 1000 мг.
- Взрослые от 25 до 50 лет — от 800 до 1200 мг.
- Беременные и кормящие грудью женщины — от 1500 до 2000 мг.
История открытия
Считается, что кальций был известен человеку еще с древних времён. В Древнем Риме, в Месопотамии и других цивилизациях Востока с использованием гашеной и негашеной извести возводили массивные и долговечные здания и сооружения. Но в чистом виде этот микроэлемент удалось получить лишь в XIX веке. Английский химик Гемфри Дэви в 1808 году проводил опыты и путём электролизации гашеной извести получил оксиды ртути, из которой выплавил новый металл, названный кальцием.
Ученый смог определить молярную формулу, вычислить уравнение и степень валентности этого микроэлемента.
В последующем человек научился получать чистый кальций путем использования различных технологий. Проведенные в последующем исследования показали, что этот микроэлемент содержится в большом количестве в земле, причём по мере приближения к ядру его массовая доля увеличивается. Он находится в различных горных породах, но в чистом виде в природе не встречается.
Нахождение в природе
Считается, что кальций — это один из самых распространённых элементов на Земле. Его общая доля составляет 3,38% всей массы коры. Однако из-за высокой активности его большая часть содержится в составе различных оксидов. Также он встречается в горных породах, в том числе в граните, различных силикатах и алюмосиликатах. В осадочных породах это соединение представлено в виде известняка, мела и различных минералов.
Природными источниками являются:
- доломит;
- флюорит;
- кальцит;
- гипс;
- алебастр;
- апатиты.
Также широко распространены в природе минералы кальция, в том числе ангидрид, известняк, доломит, апатиты и флюорит. Соли этого элемента содержатся в пресной или морской воде, определяя её показатели жесткости.
Экспериментальным путем установлено, что кальций входит в состав различных живых организмов, в том числе в костную ткань позвоночных видов, к которым относится человек. Из карбоната состоят жёсткие панцири и раковины различных беспозвоночных, скорлупа яиц птиц с пресмыкающимися.
Характеристики вещества
В естественных условиях кальций представляет собой металл с характерным серебристо-белым цветом. Он имеет высокую химическую активность, поэтому часто образует множество различных классов и всевозможных соединений с оксидами. Этот элемент представляет большую ценность для промышленного и технического химического синтеза, он необходим для правильной жизнедеятельности большинства живых видов на планете Земля. По своим физическим свойствам кальций относится к категории щелочноземельных, он отлично растворяется в воде, в особенности много этого соединения содержится в морской воде.
Его химические и физические характеристики зависят от особенностей схемы кристаллической решетки этого элемента. Строение атома кальция стандартно и отличается простотой. В зависимости от содержащихся в нем примесей, строение решетки этого микроэлемента может быть объемно-центрическим или кубическо-гранецентрическим. За счёт наличия металлического типа связи в молекуле обеспечивается максимально возможная прочность такого соединения.
Основные свойства:
- способность быстро окисляться на воздухе;
- образует многочисленные оксиды;
- применяется в восстановительных реакциях редкоземельных металлов.
Характеристики и химические свойства кальция могут изменяться в зависимости от наличия примесей и температуры окружающей среды. В обычных условиях этот металл имеет агрегатное твердое состояние. Его температура плавления составляет 842 градусов по Цельсию. Он является отличным тепло и электропроводником. Он реагирует на изменения показателей давления, которое модифицирует конфигурацию и положение его атомной решетки. При нагревании выше температуры плавления металл становится жидким, в последующем теряет свои свойства и переходит в парообразное состояние. Температура кипения составляет 1448 градусов.
Опытным путем установлена крайне интересная способность этого элемента. Под воздействием высокого давления это соединение теряет свою способность электропроводимости и другие характеристики кальция.
Однако в последующем после остывания все параметры восстанавливаются при этом отмечаются признаки сверхпроводника, которые в несколько раз превышают аналогичные показатели других элементов. Подобное делает кальций перспективным материалом при изготовлении микрочипов и изделий точной электроники.
Основные способы получения
Кальций обладает повышенной активностью, поэтому часто входит в различные соединения с другими элементами. Именно по этой причине длительное время не удавалось получить чистый материал без содержания различных примесей. Только лишь в начале XIX века англичанину Гемфри Дэви удалось путем электролиза синтезировать металл без содержания примесей. Ученый смог обнаружить взаимодействие электрического тока и расплавов солей с твердыми минералами.
Даже сегодня по прошествии стольких лет технология электролиза солей является наиболее востребованной, что объясняется её простотой и эффективностью. В металлургии применяется способ алюминотермии, который позволяет получить металл с чистотой порядка 98%. Развитие технологий и методов получения этого металла ограничено тем фактом, что такой процесс является ресурсоемким, требуя большого количества тепловой энергии и электрического тока огромной мощности.
Чистый металл хранят в герметичных емкостях с ограниченным доступом кислорода. Для предупреждения реакции с кислородом и водой кальций заливают слоем специальной жидкости (керосином или жидким парафином), что позволяет осуществлять транспортировку и длительное хранение этого металла, предупреждая его окисление и потерю химической чистоты.
На открытом воздухе кальций быстро начинает взаимодействовать с углекислым газом и кислородом, покрываясь характерным темным налетом.
Применение кальция
В чистом виде металл кальций применяют в качестве восстановителя при химических реакциях изготовления редкоземельных сплавов. Также этот элемент незаменим как раскислитель для бронзы, стали и других различных соединений. В химической промышленности он применяется при производстве бензина, позволяя удалять из топлива лишнюю серу. Из оксидов этого элемента изготавливают оболочки электрических кабелей, также из него выполняют антифрикционные материалы, которые незаменимы в радиоэлектронике и электронной промышленности.
Кальций — это биогенный элемент, необходимый для правильного протекания всех жизненных процессов в организме человека. Он присутствует в жидкостях и тканях растений и животных, поэтому играет важнейшую роль в правильной регенерации клеток. Польза и значение этого элемента для организма была установлена в начале прошлого века, а сегодня выводы ученых подтверждены многочисленными исследованиями. У человека содержание кальция достигает 2%, а у некоторых микроорганизмов — до 38%. Ученым известно лишь несколько видов простейших животных, жизнедеятельность которых может происходить без этого микроэлемента.
Большинство растений насыщаются кальцием из почвы, потребляя чистые микроэлементы с помощью специальных окислителей, выделяемых их клетками. Животные, в том числе человек, получают этот минерал с водой и пищей. Кальций необходим для образования клеточных мембран, также этот микроэлемент требуется для правильного обмена веществ. Его нехватка в организме приводит к развитию различных опасных заболеваний, вплоть до смерти человека.
Отдельные виды беспозвоночных научились запасаться кальцием, который необходим им для построения нового скелета и защитного панциря. К сожалению, у высших животных такой способности нет, поэтому им требуется постоянно получать этот микроэлемент извне, в том числе употребляя в пищу различные овощи и фрукты. Последние исследования показали, что обеспечить правильное всасывание кальция в организме человека можно лишь при наличии большого количества витамина D и других различных ферментов.
Этот химический элемент жизненно важен в буквальном смысле: из него состоят наши кости и зубы. Кальций – это также морские раковины, цветные мелки, сталактиты и сталагмиты в пещерах.
Содержание
- Что представляет собой
- История
- Физико-химические характеристики
- Присутствие в природе
- Технология получения
- Где используется
- Промышленность
- Наука
- Другие сферы
- Биологическое влияние
- Жизненные процессы
- Питание
- Нормы
- Симптомы нехватки/переизбытка
- Цены
Что представляет собой
Кальций – это химический элемент периодической системы Д. И. Менделеева под №20. Мягкий серебристо-белый металл блестит, но затем тускнеет под пленкой-оксидом.
Состоит из шести стабильных изотопов, при этом 97% состава приходится на Ca40.
Относится к щелочноземельным металлам.
Международное обозначение – Calcium (Ca).
История
Применение кальциевых минералов – мрамора, гипса, известняка – исчисляется тысячелетиями.
Чистый металл первым в истории получил британский химик Гемфри Дэви (1808 год). Для этого он применил электролиз к смеси из оксида ртути и мокрой гашеной извести. Получив амальгаму, отделил ртуть.
Он же предложил латинское название элемента: calcis означает мягкий камень, известка.
Физико-химические характеристики
Кальций представлен двумя модификациями кубической решетки: с гране- и объемноцентрированной структурой.
Металл наделен многими достоинствами: пластичен, режется ножом, обрабатывается прессованием, прокаткой.
Химические свойства проявляются при нагревании:
- Взаимодействие с горячей водой приводит к образованию водородного «фонтана». Но реакция проходит без взрывов или горения.
- Взаимодействует с кислотами, неметаллами, образуя соединения.
- Даже при комнатной температуре во влажном микроклимате покрывается пленкой.
Нагреваясь в кислороде либо на воздухе, кальций, его растворимые соли горят. Пламя получается красно-оранжевым. По цвету его легко отличить от других металлов.
Химическая активность вещества зашкаливает. Для устранения этого недостатка металл хранят в керосине, растопленном парафине либо закупоренном сосуде.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ка́льций/Calcium (Ca), 20 |
| Атомная масса (молярная масса) |
40,078(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s2 |
| Радиус атома | 197 пм |
| Химические свойства | |
| Ковалентный радиус | 174 пм |
| Радиус иона | (+2e) 99 пм |
| Электроотрицательность | 1,00 (шкала Полинга) |
| Электродный потенциал | −2,76 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) |
589,4 (6,11) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,55 г/см³ |
| Температура плавления | 1112 К; 838,85 °C |
| Температура кипения | 1757 К; 1483,85 °C |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 153,6 кДж/моль |
| Молярная теплоёмкость | 25,9 Дж/(K·моль) |
| Молярный объём | 29,9 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 5,580 Å |
| Температура Дебая | 230 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) (201) Вт/(м·К) |
| Номер CAS | 7440-70-2 |
Уникальные свойства кальция как металла проявляются при усилении давления.
Под давлением он ведет себя как полупроводник, затем как металл, потом подобно сверхпроводнику. По проводимости в разы превосходит все химические элементы (например, ртуть – вшестеро).
Присутствие в природе
Кальций – третий по распространенности в земной коре среди металлов, пятый среди всех элементов. Четвертый по количеству минералов (385).
Однако высокая химическая активность исключает присутствие элемента в свободном виде:
- Это компонент минералов и соединений. Самые распространенные минералы – гипс, кальцит, алебастр, флюорит, апатит, доломит.
Апатит - Из кальцита состоит известняк. Метаморфизм превращает его в мрамор. Самая известная разновидность известняка – мел.
Горная порода кальцит
Вещество с формулой СаСО3 – обычный мел.
- Щелочноземельный металл обнаружен в каменных метеоритах – как почти ненаходимые на земле сульфиды.
Тонна земной коры содержит 32,7 кг кальция, литр морской воды – 410 мг.
Из морской воды кальций как строительный материал вытаскивают моллюски, кораллы.
Концентрацией кальция в составе определяется степень жесткости воды.
Технология получения
Конечный продукт промышленного производства – металлический кальций.
Получение металла проходит двумя методами:
- Электролиз. Расплавляют CaCl2, задействуя медно-кальциевый анод. Из полученного медно-кальциевого сплава (2:1) отгоняют металл.
- Алюминотермия. Прокаливается смесь CaO и порошковый алюминий. Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Для обоих способов получения металла требуется вакуум и 960-1900°С.
Единственный производитель кальция в Европе – Чепецкий механический завод. Его открыли в 1949 году для нужд отечественной урановой промышленности. Уже тогда СССР отработал процесс восстановления урана кальцием. Сегодняшний ассортимент шире.
Где используется
Утилитарные характеристики металла обусловили сферы применения.
Промышленность
Львиная доля продукции металлургических комбинатов достается промышленному комплексу.
Здесь миссия кальция многогранна:
- Восстановление редкоземельных, тугоплавких элементов из соединений. Речь о хроме, никеле, меди, тории, уране.
- Удаление серы из бензина, керосина, других нефтепродуктов.
- Раскисление стали и сплавов цветных металлов.
- Получение антифрикционных сплавов.
- Очистка электровакуумных приборов от воздуха, других газов.
- Обезвоживание органических растворителей.
Металл используется при производстве аккумуляторных батарей, подшипников, оболочек кабелей.
Наука
Изотоп Ca-48 – материал с высоким КПД для производства сверхтяжелых элементов.
Кальцием восстанавливают уран.
С его помощью ученые пополняют таблицу Менделеева.
Другие сферы
Кальциевые материалы нашли применение на бытовом уровне:
- Строительный материал (известняк, гипс, мрамор).
- Сырье при производстве гипса, включая медицинский.
- Дезинфектор (хлорка).
- Мелки для рисования.
- Аптечные препараты, БАДы (особенно с витамином D).
Эстетично выглядящие образцы (флюорит, кальцинит, мрамор) попадают в минералогические коллекции.
Биологическое влияние
Кальций – важный для биологических организмов макроэлемент (1,6-2,1% по массе): он есть в растениях, организме животных, человека.
Жизненные процессы
Макроэлемент аккумулируется костями и зубами.
Известь (карбонат кальция) – строительный материал ракушек, кораллов, яичной скорлупы, накипи в чайнике.
Вещество задействовано в следующих процессах:
- Свертывание крови.
- Сокращение мышц.
- Секреция гормонов.
Тело человека массой 60 кг содержит полтора килограмма кальция.
Достаточное количество металла критично для детей и подростков: их скелет растет каждую минуту. У младенцев может проявиться рахитичность.
Питание
Макроэлемент поступает в организм во время еды. В детском возрасте продукт номер один – молоко.
Рацион взрослых разнообразнее. Веществом насыщены продукты всех групп:
- Цельнозерновой хлеб, гречка.
- Морепродукты, рыба (особенно мягкие кости).
- Бобовые.
- Орехи, свежий кунжут.
- Листовой салат, укроп, петрушка, спаржа.
Всасыванию кальция содействует лактоза, препятствуют кофе, углеводы, пальмовое масло, животные жиры (кроме сала).
Нормы
Суточная потребность в макроэлементе определяется возрастом (г):
| Возраст (лет) | Количество кальция (мг) |
| 0-6 | 1490 |
| 7-9 | 750 |
| 10-12 (мальчики) | 910 |
| 10-12 (девочки) | 1250 |
| 13-19 | 1250 |
| 20-49 | 1050 |
| 49+ | 1150-1350 |
Беременным и кормящим матерям требуется повышенная норма вещества.
Симптомы нехватки/переизбытка
Дефицит металла в организме проявляется многопланово:
- судороги, онемение конечностей, суставная боль;
- тахикардия;
- гипертония;
- расслоение, ломкость ногтей.
На ментальном плане это депрессия, нервозность.
Хроническая нехватка макроэлемента ведет к хрупкости костей (остеопорозу).
Об избытке макроэлемента сигнализируют отвращение к еде, неутолимая жажда, расстройство ЖКТ (тошнота, рвота), повышенное мочеотделение, слабость.
Избыток вещества опасен: организм «цементируется».
Максимальная суточная доза кальция для взрослых – 2,5 г.
Цены
На российском рынке представлена промышленная и аптечная продукция.
Цены на промышленный кальций (руб. / кг):
- металлический – 450;
- кусковой (чистота: 99,82%) – 1500;
- хлористый технический – 47;
- хлористый пищевой – 95.
Аптечный сегмент представлен отечественной и зарубежной продукцией. Упаковка глюконата кальция (10 таблеток) российского производства стоит 15-25 руб., препарата «Кальций-Д3 Никомед» – 300 – 700 руб.
Кальций — химический элемент с атомным номером 20 в периодической системе, обозначается символом Ca (лат. Calcium), мягкий щелочноземельный металл серебристо-серого цвета.
|
Кальций (Ca) |
|
|---|---|
| Атомный номер |
20 |
| Внешний вид |
Умеренно твёрдый, |
| Свойства атома | |
| Атомная масса (молярная масса) |
40,078 а. е. м. (г/моль) |
| Радиус атома |
197 пм |
| Энергия ионизации (первый электрон) |
589,4 (6,11) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 4s2 |
| Химические свойства | |
| Ковалентный радиус |
174 пм |
| Радиус иона |
(+2e) 99 пм |
| Электроотрицательность (по Полингу) |
1,00 |
| Электродный потенциал |
-2,76В |
| Степени окисления |
2 |
| Термодинамические свойства | |
| Плотность |
1,55 г/см³ |
| Удельная теплоёмкость |
0,653 Дж/(K·моль) |
| Теплопроводность |
(201) Вт/(м·K) |
| Температура плавления |
1112 K |
| Теплота плавления |
9,20 кДж/моль |
| Температура кипения |
1757 K |
| Теплота испарения |
153,6 кДж/моль |
| Молярный объём |
29,9 см³/моль |
| Кристаллическая решётка | |
| Структура решётки |
кубическая гранецентрированная |
| Период решётки |
5,580 Å |
| Отношение c/a |
n/a |
| Температура Дебая |
230,00 K |
История и происхождение названия
Название элемента происходит от лат. calx, calcis — известь («мягкий камень»). Оно было предложено англ. химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви смешивал влажную гашёную известь с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция.
Нахождение в природе
Соединения кальция находятся практически во всех животных и растительных тканях. В организме человека и животного 1,4-2 % Са3(РО4)2 и 13 % СаСО3.
Получение
Кальций в природе не существует в чистом виде. Этот элемент содержится в таких минералах и осадочных породах, как мел, известняк, гипс или флюорит. Сталактиты и сталагмиты также содержат в основном карбонат кальция.
Свойства
Химические свойства
Кальций — типичный щелочноземельный металл. Кальций активно, но без воспламенения, реагирует с водой с выделением водорода и разогревом. Поэтому хранят кальций в ампулах; или в банках, под слоем жидкого парафина.
Растворим в кислотах (медленно в плавиковой).
При нагревании сгорает в воздухе (с образованием оксида и нитрида) и в кислороде, пламя имеет оранжево-желтый цвет.
Реагирует со всеми галогенами.
При нагревании кальция в водороде образует гидрид, а в азоте нитрид.
С бором кальций образует гексаборид (очень химически инертный), а с кремнием силициды.
Применение
Применение металлического кальция
Металлотермия
Чистый металлический кальций широко применяется в металлотермии при получении редких металлов.
Ядерный синтез
Изотоп 48Ca наиболее эффективный и употребительный материал для производства сверхтяжелых элементов, и открытия новых элементов таблицы Менделеева. Например в случае использования ионов 48Ca для получения сверхтяжелых элементов на ускорителях, ядра этих элементов образуются в сотни и тысячи раз эффективней чем при использовании других «снарядов»(ионов).
Применение соединений кальция
Легирование сплавов
Чистый кальций применяется для легирования свинца идущего на изготовление аккумуляторных пластин необслуживаемых стартерных свинцово-кислотных аккумуляторов с малым саморазрядом. Так же металлический кальций идет на производство качественных кальциевых баббитов БКА.
Гидрид кальция
Нагреванием кальция в атмосфере водорода получают CaH (гидрид кальция) используемый в металлургии (металлотермии) и при получении водорода в полевых условиях.
Оптика
Фторид кальция (флюорит) применяется в виде монокристаллов в оптике (астрономические объективы, линзы, призмы), и как лазерный материал.
Лазерные материалы
Вольфрамат кальция (шеелит) в виде монокристаллов применяется в лазерной технике.
Карбид кальция
Карбид кальция широко применяется для получения ацетилена, и для восстановления металлов, а так же при получении цианамида кальция (нагреванием карбида кальция в азоте при 1200°C идет экзотермически, проводится в цианамидных печах).
Химические источники тока
Кальций, а так же его сплавы с алюминием и магнием используются в резервных тепловых электрических батареях в качестве анода(например кальций-хроматный элемент). Хромат кальция используется в таких батареях в качестве катода. Особенность таких батарей — чрезвычайно долгий срок хранения (десятилетия) в пригодном состоянии, возможность эксплуатации в любых условиях (космос, высокие давления), большая удельная энергия по весу и объему. Недостаток в недолгом сроке действия. Такие батареи используются там где необходимо на короткий срок создать колоссальную электрическую мощность (баллистические ракеты, некоторые космические аппараты и.т.д).
Огнеупорные материалы
Оксид кальция в свободном виде так и в составе керамических смесей применяется в производстве огнеупорных материалов.
Лекарственные средства
Соединения кальция широко применяются в качестве антигистаминного средства.
- Хлорид кальция
- Глюконат кальция
- Глицерофосфат кальция
Кроме того, соединения кальция вводят в состав препаратов для профилактики остеопороза, в витаминные комплексы для беременных и пожилых.
Биологическая роль
В организме животных ионы кальция играют существенную роль (кальциевые каналы).
Кальций — важнейший элемент для формирования скелета (см. витамин Д).
С возрастом в организме усиливаются процессы, связанные с потерей ионов кальция, что приводит к остеопорозу (в отсутствие коррекции).
Изотопы
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжелый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), как было недавно обнаружено, испытывает двойной бета-распад с периодом полураспада 5,3×1019 лет.
См. также
Категория:Соединения кальция
Ссылки
- Кальций на Webelements
- Кальций в Популярной библиотеке химических элементов
- «Кальций» — статья в Физической энциклопедии
Литература
- Доронин. Н. А. Кальций, Госхимиздат, 1962. 191 стр. с илл.
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
af:Kalsium
ar:كالسيوم
ast:Calciu
bg:Калций
bn:ক্যালসিয়াম
bs:Kalcijum
ca:Calci
co:Calciu
cs:Vápník
da:Calcium
de:Calcium
el:Ασβέστιο
en:Calcium
eo:Kalcio
es:Calcio
et:Kaltsium
fi:Kalsium
fr:Calcium
gl:Calcio (elemento)
he:סידן
hr:Kalcij
hu:Kalcium
hy:Կալցիում
id:Kalsium
io:Kalcio
is:Kalsín
it:Calcio (metallo)
ja:カルシウム
jbo:bogjinme
ko:칼슘
ku:Kalsiyûm
la:Calcium
lb:Kalzium
lt:Kalcis
lv:Kalcijs
mi:Konupūmā
mk:Калциум
ml:കാത്സ്യം
ms:Kalsium
nl:Calcium
nn:Kalsium
no:Kalsium
oc:Calci
pl:Wapń
pt:Cálcio
ro:Calciu
sh:Kalcij
simple:Calcium
sk:Vápnik
sl:Kalcij
sq:Kalciumi
sr:Калцијум
su:Kalsium
sv:Kalcium
ta:கல்சியம்
th:แคลเซียม
tr:Kalsiyum
uk:Кальцій
uz:Kalsiy
vi:Canxi
zh:钙
zh-yue:鈣
|
Выделить Кальций и найти в:
|
|
|
- Страница 0 — краткая статья
- Страница 1 — энциклопедическая статья
- Разное — на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Кальций 1», чтобы сохранить ее
Комментарии читателей:
Химический элемент с атомным номером 20
Химический элемент с атомным номером 20
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кальций | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешний вид | тускло-серый, серебристый; с бледно-желтым оттенком | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Ca) | 40.078 (4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кальций в периодической таблице | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 2 (щелочноземельные металлы) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | s-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Щелочноземельный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Ar ] 4s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое вещество | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1115 K (842 ° C, 1548 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 1757 K (1484 ° C, 2703 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 1,55 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при т.пл. ) | 1,378 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 8,54 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 154,7 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,929 Дж / ( моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Окисление состояния | +1, +2 (сильно основной оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга : 1,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 176 ± 10 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| радиус Ван-дер-Ваальса | 231 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | pri мордиал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая (fcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 3810 м / с (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термический расширение | 22,3 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 201 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 33,6 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | + 40,0 · 10 см / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 20 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 7,4 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 17 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 1,75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 170–416 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первое выделение | Хамфри Дэви (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы кальция | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Кальций — это химический элемент с символом Caи атомным номером 20. Как щелочноземельный металл, кальций является химически активным металлом, который контакте с воздухом образует темный оксидно-нитридный слой. Его физические и химические свойства наиболее близки к его более тяжелым гомологам стронций и барий. Это пятый по содержанию элемент в земной коре и третий по содержанию металл после железа и алюминия. Наиболее распространенное соединение кальция на Земле — это карбонат кальция, обнаруженный в известняке и окаменелых остатках ранней морской жизни; гипс, ангидрит, флюорит и апатит также являются источниками кальция. Название происходит от латинского calx «известь », которое происходит при нагревании известняка.
Некоторые соединения кальция были известны древним, хотя был неизвестен до семнадцатого века. Чистый кальций был выделен в 1808 году электролизом его оксида Хамфри Дэви, который назвал элемент. Соединения кальция широко используются во многих отраслях промышленности: пищевой и фармацевтической промышленности для добавок кальция, в бумажной промышленности в отбеливателей, в качестве компонентов цемента и электрических изоляторов, а также в производстве мыла. С другой стороны, металл в чистом виде мало применений из-за его высокой реакционной способности; Он часто используется в качестве легирующего компонента в сталеплавильном производстве, а иногда в качестве сплава кальция и свинца при производстве автомобильных аккумуляторов.
Кальций — самый распространенный металл и пятый по содержанию элемент в человеческом теле. Как электролиты, ионы кальция играют жизненно важную роль в физиологических и биохимических процессах организмов и клеток : в передаче сигнала пути, где они как второй посланник ; в высвобождении нейромедиатора из нейронов ; при сокращении всех типов клеток мышц ; как кофакторы во многих ферментов ; и в оплодотворении. Ионы кальция вне клеток важны для поддержания разности потенциалов на возбудимых клеточных мембранах, синтез белка и образования костей.
Содержание
- 1 Характеристики
- 1.1 Класс
- 1.2 Физический
- 1.3 Химический
- 1.4 Изотопы
- 2 История
- 3 Возникновение и производство
- 3.1 Геохимический цикл
- 4 Использование
- 5 Источники питания
- 6 Биологическая и патологическая роль
- 6.1 Функция
- 6.2 Связывание
- 6.3 Растворимость
- 6.4 Питание
- 6.5 Гормональная регуляция образования костей и уровни сыворотки
- 6.6 Аномальные уровни сыворотки
- 6.7 Камни в почках
- 6.8 Заболевания костей
- 7 Безопасность
- 7.1 Металлический кальций
- 8 См. Также
- 9 Ссылки
- 10 Библиография
Характеристики
Классификация
Кальций — очень пластичный серебристый металл (иногда его называют бледно-желтым), свойства которого очень похожи на более тяжелые элементы в его группе: стронций, барий и радий.. Атом кальция имеет двадцать электронов, используемую в электронной конфигурации [Ar] 4s. Как и другие элементы, входящие в группу 2 периодической таблицы, кальций имеет два валентных электрона на внешней s-орбитали, которые очень легко теряются в химических реакциях с образованием дипозитивного иона со стабильной электронной конфигурацией благородный газ, в данном случае аргон. Следовательно, кальций почти всегда двухвалентен в своих соединениях, которые обычно ионны. Гипотетические одновалентные соли кальция были бы стабильны по отношению к своим элементам, но не к диспропорционированию двухвалентным солям и металлическому кальцию, энтальпия образования MX 2 намного выше, чем у гипотетического MX. Это происходит из-за гораздо большей энергии решетки, обеспечиваемой более сильно заряженным катионом Са по сравнению с гипотетическим катионом Са.
Кальций, стронций, барий и радий всегда считаются щелочноземельные металлы ; более легкий бериллий и магний, также входящие в группу 2 периодической таблицы, также часто включаются. Тем не менее, бериллий и магний отличаются от других групп по своему физическому и химическому поведению: они ведут себя больше как алюминий и цинк соответственно и имеют более слабый металлический характер, чем постпереходные металлы, поэтому традиционное определение термина «щелочноземельный металл» исключает их. Эта классификация в основном устарела в русскоязычных источниках, но все еще используется в других странах, таких как Япония. В результате сравнения со стронцием и барием больше подходят для химии кальция, чем сравнение с магнием.
Физические
Металлический кальций плавится при 842 ° C и кипит при 1494 ° C; эти значения выше, чем у магния и стронция, соседних металлов 2 группы. Он кристаллизуется в форме гранецентрированной кубической структуры, как стронций; при температуре выше 450 ° C он меняется на анизотропное гексагональное плотноупакованное расположение, подобное магнию. Его плотность 1,55 г / см — самая низкая в своей группе. Кальций тверже свинца, но его можно разрезать ножом с усилием. Хотя кальций является более плохим проводником электричества, чем медь или алюминий по объему, он является лучшим проводником по массе, чем оба, из-за своей очень низкой плотности. Использование как таковое в космосе было рассмотрено, использование калькуляций в качестве проводника для наземных применений, он быстро реагирует с атмосферным кислородом, его использование как таковое в космосе было рассмотрено.
Химическое вещество

Химический состав другого химического состава типичного тяжелого щелочноземельного металла. Например, кальций самопроизвольно реагирует с водой, чем магний, и менее быстро, чем стронций с образованием гидроксида кальция и газообразного водорода. Он также реагирует с кислородом и азотом в среде с образованием смеси оксида кальция <187.>и нитрид кальция. При тонком измельчении он самопроизвольно сгорает на воздухе с образованием нитрида. В массе кальций менее реакционноспособен: он быстро образует гидратное покрытие во влажном воздухе, но ниже 30% относительная влажность может храниться неограниченное время при комнатной температуре.
Besi Из простого оксида CaO пероксид CaO 2 может быть получен прямым окислением металлического кальция под высоким давлением кислорода, и есть некоторые доказательства желтого супероксида Ca (O 2)2. Гидроксид кальция, Ca (OH) 2, является сильным основанием, хотя и не таким сильным, как гидроксиды стронция, бария или щелочные металлов. Известны все четыре дигалогенида кальция. карбонат кальция (CaCO 3) и сульфат кальция (CaSO 4) являются особенно распространенными минералами, как стронций и барий, а также щелочные металлы и двухвалентные. лантаноиды европий и иттербий, металлический кальций растворяется непосредственно в жидком аммиаке с образованием темно-синего раствора.
Из -за большого размера иона Ca обычно высокие координационные числа, вплоть до 24 в некоторых интерметаллических соединенийх, таких как CaZn 13. легко образует комплексы с кислородными хелатами, такими как EDTA и полифосфаты, которые используются в аналитической химии и удалении кальция из жесткая вода. В стерических препятствий меньшие отсутствие катионы группы 2 имеют тенденцию образовывать более сильные комплексы, но когда задействованы большие полидентатные макроциклы, тенденция меняется на противоположную.
Хотя кальций находится в той же группе, что и магний, и магнийорганические соединения очень часто используются в химии, органо-кальциевые соединения не так широко распространены, потому что их труднее получить и они более реакционноспособны, хотя недавно они стали исследовали как возможные катализаторы. Органокальциевые соединения имеют тенденцию быть более похожими на органоиттербиевые соединения из-за схожих ионных радиусов Yb (102 мкм) и Ca (100 мкм). Основные соединения можно получить только при низких температурах; объемные лиганды обычно способствуют стабильности. Например, ди циклопентадиенил, Ca (C 5H5)2, должен быть получен путем прямого преобразования металлического кальция или циклопентадиена с самим собой; замена лиганда C 5H5более объемным C 5 (с другой стороны, лиганд CH 3)5увеличивает растворимость, летучесть и кинетическую стабильность соединения.
Изотопы
Природный кальций представляет собой смесь пяти стабильных изотопов (Ca, Ca, Ca, Ca и Ca) и один изотоп с таким длительным периодом полураспада, что можно считать стабильным для всех практических целей (Ca, с половиной -срок жизни около 4,3 × 10 лет
Безусловно, наиболее распространенным изотопом кальция в природе Са, который составляет 96,941% весь природный кальций, он производит в процессе сжигания. кремния из синтеза альфа-частиц является самым тяжелым стабильным нуклидом с ра вным номером протонов и нейтронов; его наличие также медленно дополняется то распад первоначального K. Добавление еще одной альфа-частицы приводит к нестабильному Ti, который быстро распадается в результате двух последовательных захватов электрона до стабильного Ca; это составляет 2,806% всего природного кальция и является вторым по распространенности изотопом. Остальные четыре природных изотопа, Са, Са, Са и Са встречаются значительно реже, каждый из которых составляет менее 1% всего природного кальция. Четыре более легких изотопа в основном являются продуктами процессов сжигания кислорода и кремния, а два более тяжелых изотопа должны быть получены с помощью процессов захвата нейтронов. Са в основном образует в «горячем» s-процессе, поскольку для его образования требуется высокий поток нейтронов, чтобы вызвать короткоживущему Ca захватить нейтрон. Са образует в результате захвата электронов в r-процессе в сверхновых типа Ia, где высокий нейтронный избыток и достаточно низкий энтропия его выживание.
Ca и Ca являются первыми «классически стабильными» нуклиды с избытком в шесть или восемь нейтронов соответственно. Он очень стабилен, потому что это дважды магическое ядро , имеющее 20 протонов и 28 нейтронов, используемых в закрытых оболочках. Его бета-распад до Sc очень затруднен из-за грубого несоответствия ядерный спина : Ca имеет нулевой ядерный спин, четным-четным, в то время как Sc имеет спин 6+, поэтому распад запрещен из-за сохранение углового момента. Хотя два возбужденных состояния также доступны для распада, они также запрещены из-за их высоких спинов. В результате, когда Са распадается, он делает это путем двойного бета-распада до Ti, поскольку он является самым легким из известных из нуклидов, подвергшихся двойному бета-распаду. Тяжелый изотоп Ca также теоретически может подвергаться двойному бета-распаду до Ti, но этого никогда не наблюдалось; самый легкий и самый распространенный изотоп Ca также дважды магическим и может подвергаться двойному захвату электрона в Ar, но этого никогда не наблюдалось. Кальций — единственный элемент, который имеет два первичных магических изотопа. Экспериментальные нижние пределы периодов полураспада Са и Са составляют 5,9 × 10 лет и 2,8 × 10 лет соответственно.
Помимо практически стабильного Са, самый долгоживущий радиоизотоп Кальций это Ca. Он распадается в результате захвата электрона до стабильного K с периодом полураспада около тысяч ста лет. Его существование в ранней Солнечной системе как потухший радионуклид было выведено из избытка K: следы Ca все еще существуют сегодня, поскольку это космогенный нуклид, непрерывно преобразованный посредством нейтронная активация природный Ca. Известно много других радиоизотопов кальция, от Ca до Ca. Все они намного короче, чем Са, наиболее стабильными они являются Са (период полураспада 163 дня) и Са (период полураспада 4,54 дня). Изотопы более легкие, чем Са, обычно претерпевают бета-распад до изотопов калия, а те, которые тяжелее Са, обычно претерпевают бета-минус-распад до изотопов скандия, хотя почти ядерные капельные линии, испускание протонов и нейтронное излучение также начинают быть значимыми модами распада.
Как и другие элементы, множество процессов изменяют относительное содержание изотопов кальция. Наиболее изученным из этих процессов является массовое фракционирование изотопов кальция, которое сопровождает осаждение минералов кальция, таких как кальцит, арагонит и апатит. из решения. Более легкие изотопы предпочтительно включаются в эти минералы, оставляя окружающий раствор, обогащенный более тяжелыми изотопами с величиной примерно 0,025% на атомную единицу массы (а.е.м.) при комнатной температуре. Зависимые от массы различия в изотопном составе кальция обычно выражаются соотношением двух изотопов (обычно Ca / Ca) в образце по сравнению с таким же соотношением в стандартном эталонном материале. Ca / Ca колеблется примерно на 1% среди обычных земных материалов.
История

Соединения кальция были известны на протяжении тысячелетий, хотя их химический состав не был понят до 17 века. Известь в качестве строительного материала и штукатурки для статуй использовалась еще около 7000 г. до н.э. Первая датированная печью для обжига извести датируется 2500 г. до н.э. и была обнаружена в Хафадже, Месопотамии. Примерно в то же время обезвоженный гипс (CaSO 4 · 2H 2 O) использовался в Великой пирамиде в Гизе ; этот материал позже будет использован для штукатурки в гробнице Тутанхамона. древние римляне вместо этого использовали известковые растворы, полученные нагреванием известняка (CaCO 3); само название «кальций» происходит от латинского слова calx «известь». Витрувий заметил, что образовавшаяся известь была легче, чем исходный известняк, объясняя это кипением воды; в 1755 году Джозеф Блэк доказал, что это произошло из-за потери углекислого газа, который в качестве газа был признан древними римлянами.
В 1787 году, Антуан Лавуазье подозревал, что известь может быть оксидом основного химического элемента. В своей таблице элементов Лавуазье перечислил пять «солефицируемых земель» (т. Е. Руд, которые можно заставить реагировать с кислотами с образованием солей (salis = соль на латыни): chaux (оксид кальция), magnésie (магнезия, оксид магния), барит (сульфат бария), оксид алюминия (оксид алюминия, оксид алюминия) и кремний (диоксид кремния, диоксид кремния)). Об этих «элементах» размышлял Лавуазье:
Вероятно, пока знакомы только с частными металлическими веществами, действующими в природе, поскольку все те, которые имеют более сильное сродство к кислороду, чем углерод, до сих пор неспособны к приведенным к металлическому состояние и, следовательно, представленные нашему наблюдению только в виде оксидов, смешиваются с землей. Весьма вероятно, что бариты, которые мы только что устроили с землями, находятся в этой ситуации; как во экспериментах он проявляет свойства, близкие к свойствам металлических тел. Возможно даже, что все вещества, которые мы называем землей, могут быть только металлическими оксидами, не восстанавливаемыми каким-либо до сих пор известного процесса.
Кальций, вместе с его родственными соединениями магнием, стронцием и барием, был впервые выделен Хамфри Дэви в 1808 г. Следуя работе Йона Якоба Берцелиуса и электролизу, Дэви изолировал кальций и магний, добавив смесь соответствующих оксидов металлов с ртутью (II). оксид на платиновой пластине , которая использовалась в качестве анода, причем катодом была платиновая проволока, частично погруженная в ртуть. Затем электролиз дал амальгамы кальция с ртутью и магний-ртуть, а отгонка ртути дала металл. Однако чистый кальций не может быть получен в больших объемах этим методом, и работоспособный коммерческий процесс его производства был найден только спустя столетие.
Возникновение и производство

При 3% кальций является пятым наиболее распространенным элементом в земной коре и третьим по распространенности металлом после алюминия и железо. Также является четвертым по численности нагорьях Луны. Осадочные карбонатные отложения кальция пронизывают поверхность Земли в виде окаменелых останков прошлой морской жизни; они встречаются в двух формах: ромбоэдрический кальцит (чаще встречается) и орторомбический арагонит (образует в морях с более умеренным климатом). Минералы первого типа включают известняк, доломит, мрамор, мел и исландский шпат ; Слои арагонита составляют бассейны Багамы, Флорида-Кис и Красного моря. Кораллы, морские раковины и жемчуг в основном состоят из карбоната кальция. К другим важным минералам гипс (CaSO 4 · 2H 2 O), ангидрит (CaSO 4), флюорит (CaF 2) и апатит ([Ca 5 (PO 4)3F]).
Основными производителями кальция являются Китай (от 10000 12000 тонн в год), Россия (от 6000 до 8000 тонн в год), и США (примерно от 2000 до 4000 тонн в год). Канада и Франция также входят в число второстепенных производителей. В 2005 году около 24000 тонн был произведен кальций; около половины добываемого В России и в Китае метод электролиза используется, но вместо этого используется для расплавленного металла хлорид кальция. стронций или барий, оксидно-нитридное покрытие, образующееся в воздухе, стабильно и тока рная обработка и другие стандартные металлургические методы подходят для кальция. В наших Штатах и Канаде кальций вместо этого путем восстановления известием при высоких температурах.
Геохимический цикл
Цикл кальция обеспечивает связь между тектоникой, климат и углеродный цикл. Проще говоря, поднятие гор подвергает кальцийсодержащие породы химического выветриванию и высвобождает Ca в поверхностные воды. Эти ионы переносятся в океан, где они реагируют с растворенным CO 2 с образованием известняка (CaCO. 3), который, в свою очередь, оседает на морское дно, где он включается в новые горные породы. Растворенный CO 2 вместе с ионами карбоната и бикарбоната называется «растворенным неорганическим углеродом » (DIC).
Фактическая реакция более сложная и включает ионный бикарбонат (HCO. 3), который образует, когда CO 2 реагирует с водой в морской воде pH :
- Ca. + 2HCO. 3→ CaCO. 3 (s )+ CO. 2+ H. 2O
При pH морской воды большая часть CO 2 немедленно превращается обратно в HCO. 3. Реакция приводит к чистому переносу одной молекулы CO 2 из океана / атмосферы в литосферу. В результате каждого ионного Ca, высвобождаемый в результате химического выветривания, в конечном итоге удаляет одну молекулу CO 2 из поверхностной системы (атмосферы, океана, почвы и живых организмов), сохраняя ее в карбонатных породах, где она, вероятно, останется в течение длительного времени. сотни миллионов лет. Выветривание кальция из горных пород, таким образом, вымывает CO 2 из океана и атмосферы, оказывая сильное долгое воздействие на климат.
Использует
Наиболее широко используются металлические кальций используется в сталеплавильном производстве из-за его сильного химического сродства к кислороду и сере. Его оксиды и сульфиды после образования дают жидкую известь алюминат и сульфидные включения в стали, которые всплывают; при обработке эти включения рассеиваются по стали и становятся маленькими и сферическими, улучшая литье, чистоту и общие механические свойства. Кальций также используется в необслуживаемых автомобильных аккумуляторах, в которых используется 0,1% сплавов кальция и свинца вместо обычных сплавов сурьмы со свинцом приводит к меньшая потеря воды и меньший саморазряд. Из-за риска расширения и растрескивания алюминий иногда также включается в эти сплавы. Эти свинцово-кальциевые сплавы также используются в литье, заменяя сплавы свинец-сурьма. Кальций также используется для упрочнения алюминиевых сплавов, используемых в подшипниках, для контроля содержания графита углерода в чугуне и для удаления примесей висмута из свинца. Металлический кальций содержит в некоторых очистителях канализации, где он генерирует тепло, и гидроксид кальция, который омыляет жиры и разжижает белки (например, в волосах), блокирующие сток. Помимо металлургии, реакционная способность кальция используется для удаления азота из высокочистого газа аргона и в качестве газопоглотителя для кислорода и азота. Он также используется в качестве в качестве восстановителя при производстве хрома, циркония, тория и урана. Его также можно использовать для хранения газообразного водорода, так как он реагирует с водородом с образованием твердого гидрида кальция, из которого водород может быть повторно извлечен.
Фракционирование изотопов кальция во время образования минералов привело к нескольким применениям изотопов кальция. В частности, наблюдение Скулана и ДеПаоло в 1997 г. о том, что минералы кальция изотопно легче, чем растворы, которые используются в медицине и палеоокеанографии. У животных со скелетом, минерализованным кальцием, изотопным составом кальция мягких животных, относительной скоростью образования и растворением скелетных минералов. Было показано, что у людей изменения изотопного состава кальция в моче связаны с изменениями минерального баланса костей. Когда скорость образования увеличивает скорость резорбции кости, соотношение Са / Са в мягких тканях повышается и наоборот. Из-за этой взаимосвязи измерения изотопного состава кальция в моче или крови могут быть полезны раннего метаболических заболеваний, таких как остеопороз. Подобная система существует в морской воде, где Ca / Ca имеет тенденцию повышаться, когда скорость удаления Ca минеральными осадками поступает нового кальция в океан. В 1997 году Скулан и ДеПаоло представили первое свидетельство изменений Ca / Ca в морской воде в течение геологического времени, а также теоретическое объяснение этих изменений. Более поздние сообщения подтвердили это наблюдение, что поведение Ca в морской воде непостоянна, и что океан никогда не находится в «устойчивом состоянии» по отношению к поступлению и выходу кальция. Эти химические соединения используются в пищевых продуктах, в фармацевтических препаратах, среди прочего прочего. Например, кальций и фосфор добавляются в пищевые продукты за счет добавления лактата кальция, дифосфата кальция и трикальцийфосфата. Последний также используется в качестве в полирующего агента в зубной пасте и в антацидах. Лактобионат кальция представляет собой белый порошок, который используется в качестве суспендирующего агента в фармацевтических препаратах. В выпечке используется как разрыхлитель. Сульфит кальция используется в качестве отбеливателя при производстве бумаги и в качестве дезинфицирующего средства, силикат кальция используется в качестве армирующего агента в резине, а ацетат кальция является компонентом используется и используется для производства металлического мыла и синтетических смол.
Кальций входит в Список основных лекарственных средств Всемирной организации здравоохранения.
Источники питания
К продуктам, богатым кальцием, брон молочные продукты, такие как йогурт и сыр, сардины, лосось, соевые продукты, капуста и обогащенные сухие завтраки.
Из-за долгосрочных побочных эффектов, включая кальцификацию артерий и камни в почках, оба Институт медицины (IOM) США и Европейское управление по безопасности пищевых продуктов (EFSA) установило допустимые верхние уровни потребления (UL) для комбинированного диетического и дополнительного кальция. Согласно МОМ, люди в возрасте 9–18 лет не должны содержать комбинированное потребление 3 г / день; в возрасте 19–50 лет — не более 2,5 г / день; для возраста 51 года и старше — не более 2 г / день. EFSA установило UL для всех взрослых на уровне 2,5 г / день, но решило, что для детей и подростков недостаточно определения UL.
Биологическая и патологическая роль
| Возраст | Кальций (мг / день) |
|---|---|
| 1-3 года | 700 |
| 4-8 лет | 1000 |
| 9–18 лет | 1300 |
| 19–50 лет | 1000 |
| >51 год | 1000 |
| Беременность | 1000 |
| Лактация среди | 1000 |

Функция
Кальций является важных элементов, необходимых в Большие количества. Ион Са действует как электролит и жизненно важен для здоровья мышечной, кровеносной и пищеварительной систем; незаменим для строительства костей; и поддерживает синтез и функцию клеток крови. Например, он регулирует сокращение мышц, нервную проводимость и свертывание крови. В результате уровень внутри- и внеклеточного кальция жестко регулируется организмом. Кальций может играть эту роль, потому что ионные Са образует стабильные координационные комплексы со многими органическими соединениями, особенно с белками ; он также образует соединения с широким диапазоном растворимости, позволяя формировать скелет.
Связывание
Ионы кальция могут образовывать комплекс с белками посредством связывания карбоксильных групп остатков глутаминовой кислоты или аспарагиновой кислоты ; путем взаимодействия с остатками фосфорилированного серина, тирозина или треонина ; или будучи хелатированным γ-карбоксилированными аминокислотными остатками. Трипсин, пищеварительный фермент, использует первый метод; остеокальцин, белок костного матрикса, использует третий. Некоторые другие белки костного матрикса, такие как остеопонтин и костный сиалопротеин, используют как первый, так и второй. Прямая активация ферментов связыванием кальция является обычным явлением; некоторые другие ферменты активируются нековалентной связью с ферментами прямого связывания кальция. Кальций также связывается со слоем фосфолипидов на клеточной мембране, закрепляя белки, связанные с поверхностью клетки.
Растворимость
В качестве примера широкий диапазон растворимости соединений кальция, монокальцийфосфат очень растворим в воде, 85% внеклеточного кальция представляет собой дикальцийфосфат с растворимостью 2,0 мМ и гидроксиапатит костей в органической матрице — это трикальцийфосфат в концентрации 100 мкМ.
Питание
Кальций является обычным компонентом поливитаминов. диетические добавки, но состав комплексов кальция в добавках может влиять на их биодоступность, которая зависит от растворимости задействованной соли: цитрат кальция, малат, и лактат имеют высокую биодоступность, а оксалат — меньше. Другие препараты кальция включают карбонат кальция, малат цитрата кальция и глюконат кальция. Кишечник поглощает около одной трети потребляемого кальция в виде свободных ионов, а затем уровень кальция в плазме регулируется почками.
Гормональная регуляция образования костей и уровни сыворотки
Паратироидный гормон и витамин D способствуют формированию костной ткани за счет всего за счет ускоренного обновления костной ткани, не влияя на массу костной ткани или содержания минералов. Когда уровень кальция в плазме падает, рецепторы клеточной поверхности активируются и происходит секреция паратироидного гормона; Затем он стимулирует поступление кальция в пул плазмы, забирает его из целевых клеток, кишечника и кишечника, при этом костеобразующее действие паратироидного гормона антагонизируется кальцитонином, секреция которого увеличивается с повышением уровня кальция в плазме.
Аномальные уровни в сыворотке
Избыточное потребление кальция может вызвать гиперкальциемию. Однако, поскольку кальций абсорбируется кишечником довольно неэффективно, высокий уровень кальция в сыворотке, скорее всего, вызван чрезмерной секрецией паратироидного гормона (ПТГ) или, возможно, чрезмерным потреблением витамина D, которые способствуют усвоению кальция. Все эти условия приводят к тому, что избыток солей кальция откладывается в сердце, кровеносных сосудах или почках. Симптомы включают анорексию, тошноту, рвоту, потерю памяти, спутанность сознания, мышечную слабость, учащенное мочеиспускание, обезвоживание и метаболические заболевания костей. Хроническая гиперкальциемия обычно приводит к кальцификации мягких тканей и ее серьезным последствиям: например, кальцификация может вызвать потерю эластичности сосудистых стенок и нарушение ламинарного кровотока — и, следовательно, разрыв бляшки и тромбоз. И наоборот, недостаточное потребление кальция или витамина может привести к >вызываемой недостаточной секрецией паратироидного гормона или дефектными рецепторами ПТГ в клетках. Симптомы включают нервно-мышечную возбудимость, которая вызывает тетанию и нарушение проводимости сердечной ткани.
Камни в почках
Чрезмерное потребление кальция увеличивает риск камней в почках, болезненное состояние, развивающее в результате образования кристаллов оксалата кальция, оседающих в мочевыводящих путях.
Болезнь костей
кальций необходимого для развития костей, многие заболевания костей можно проследить до органического матрикс или гидроксиапатит в молекулярной структуре или организации кости. Остеопороз — это снижение содержания минералов в костях на единицу объема, и его можно лечить добавлением кальция, витамина D и бисфосфонатов. Недостаточное количество кальция, витамина D или фосфатов может привести к размягчению костей, что называется остеомаляция.
Безопасность
Металлический кальций
| Опасности | |
|---|---|
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H261 |
| Меры предосторожности GHS | P231 + 232, P422 |
| NFPA 704 (пожарный алмаз) |  3 0 1 3 0 1 |
Экзотермически реагирует с водой и кислотами, металлический кальций, контакт с влагой тела, сильное разъедающее раздражение. При проглатывании металлический кальций оказывает такое же действие на ротовую полость, пищевод и желудок и может быть смертельным. Однако не известно, что длительное воздействие имеет явные побочные эффекты.
См. Также
Ссылки
Библиография
- Гринвуд, Норман Н. ; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Хлучан, Стивен Э.; Померанц, Кеннет. «Кальций и кальциевые сплавы». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. doi :10.1002/14356007.a04_515.pub2.
.

Содержание
- Как был открыт Кальций;
- Где и как добывают Кальций;
- Распространенность Кальция;
- Применение Кальция;
- Интересные факты
Как был открыт Кальций
История открытия кальция, как химического элемента, начинается очень давно. Его соединения были известны по крайней мере 9000 лет назад. Это утверждение базируется на том, что известь как строительный материал впервые использовался в седьмом тысячелетии до нашей эры. Примерно в это же время, гипс начали так же использовать в строительстве. В пример можно привести «Великую пирамиду в Гизе» и могилу «Тутанхамона». Там гипс использовался в качестве штукатурки. Древние Римляне использовали строительные растворы, изготовленные путем нагревания известняка. До XVII века такая наука как химия начинала только развиваться. В 1787 году Антуан Лавуазье предположил, что известь может быть оксидом нового химического элемента. Он занес оксид кальция в свою таблицу химических элементов под названием «chaux». Известь являлась одной из пяти так называемых «засоленых земель» в этой таблице.
Попытки отделить кальций из извести, таких ученых как А. Лавуазье, Я. Берцелиус и М. Понтина, не увенчались успехом. Только в 1808 году английскому химику Хэмфри Дэви удалось отделить кальций из смеси методом электролиза. В качестве анода использовалась платиновая пластина, а в качестве катода использовалась платиновая проволока погруженная в ртуть. На анод помещалась кальциевая смесь и пропускалось электричество. В результате химической реакции получилась кальций-ртутная амальгама. Чистый элемент Дэви получил термическим отделением ртути. Для коммерческих целей кальций, полученный таким способом, не подойдет. Промышленный метод был разработан только спустя век.
Где и как добывают Кальций
Мировая ежегодная добыча кальция составляет около 25000 тонн. Лидерами в этом направлении являются такие страны как Китай, Россия и США. Более мелкими производителями кальция являются Канада и Франция. Чистый кальций в природе не встречается из-за его высокой реакционной способности. Он встречается в виде таких минералов как мрамор, мел, исландский шпат, доломит, известняк, гипс, ангидрит, флюорит и апатит.
Чистый металл в промышленных масштабах получают путем восстановления оксида кальция(негашеной извести) алюминиевым порошком при высокой температуре. Температура варьируется в пределах 1200°C.
4CaO + 2Al —1200°C—> CaAl2O4 + 3Ca↑
Хотя алюминий имеет меньшую реакционную способность и энтальпию чем кальций, баланс реакции находится в левой части этого уравнения. Очистка до чистого химического элемента осуществляется путем перегонки кальция.
Распространенность Кальция
Кальций является довольно распространенным элементом. Он занимает почетное пятое место по распространенности в земной коре. Так же он является одним из самых распространенных металлов. Он замыкает тройку лидеров после алюминия и железа в земной коре. Как уже говорилось выше, кальций является очень реакционным металлом, поэтому он встречается в природе исключительно в виде соединений. Самыми распространенными кальцийсодержащими веществами являются карбонат кальция и окаменелые остатки древней морской среды. Что касается мирового океана, то тут можно так же отметить повышенную распространенность этого химического элемента. Порциальное содержание кальция в морской воде составляет порядка 400 милиграмм на литр.
Если рассматривать распространенность кальция во Вселенной, то можно отметить так же обильность распространения этого химического элемента. Точных данных по порциальности его распространенности нет, но можно утверждать что оно достаточное. Исходя из того что было вышесказано о нашей планете, и того что большая часть поверхности Луны состоит из кальция и он горит желто-оранжевым цветом можно предполагать, что его распространение во Вселенной сравнимо с кремнием. Плюс не стоит забывать, что кальций играет огромную роль во всех живых организмах. Например, по содержанию в организме человека, он занимает пятое место. Основная масса кальция рассредотачивается в зубах и костях, а так же его ионы присутствуют и в нашей крови.
Применение Кальция
Применение такого химического элемента как кальций относительное. С одной стороны применение чистого кальция довольно ограничено, а с другой стороны кальциевые соединения применяются почти во всех сферах жизнедеятельности. Наибольшее использование чистого кальция приходится на литейную промышленность благодаря его сильному химическому родству к кислороду и сере. В конкретных случаях, он применяется в качестве добавки при производстве стали, а так же в качестве восстановителя при производстве таких металлов ка торий, цирконий, ванадия, хрома и урана. Он также может использоваться для хранения газообразного водорода, так как он реагирует с водородом с образованием твердого гидрида кальция. Из этого соединения водород извлекается без особого труда и затрат.
Конечно с самого начала следует отметить роль кальциевых соединений в сторительной промышленности. Такие вещества как известь, гипс и мрамор используются повсеместно. Ионы кальция могут применяться в автомобильных необслуживаемых аккумуляторах. В этих аккумуляторах он уменьшает снижение потерь воды и саморазряда. Химическая промышленность добавляет ионы кальция в некоторые очистители сточных вод, моющие и дезинфицирующие средства, зубные пасты и многое другое. Роль кальция в пищевой промышленности почти полностью посвящается пищевым добавкам из-за благоприятного воздействия на организм человека.
Это утверждение можно связать и с медициной, так как кальций укрепляет(восстанавливает) кости и играет роль в синтезе белков. Поэтому разработано очень много медицинских препаратов предназначенных для восстановления баланса кальция в организме человека. У соединений кальция очень широкий круг применения начиная от школьного мела и заканчивая наполнителями пластмасс, металлическим мылом и синтетических смол.
Интересные факты
Интересных фактов связанных с кальцием очень много. Стоит начать с того, что европейский орган по безопасности пищевых продуктов установили нормы суточного потребления кальция. Она составляет не более 2,5 граммов в день. Продукты содержащие кальций включают в себя молочные продукты, сардины, лосось, капуста, соевые продукты и др. Избыточный кальций в пище является главной причиной образования камней в почках. В тоже время недостаток кальция в пище может приводить к таким болезням как остеопароз или остеохандроз. Чистый металлический кальций при вступании в контакт с влагой экзотермически способен наносить значительные поражения организму человека(разъедающее раздражение). Из-за этого при проглатывании металлического кальция может наступить даже летальный исход. Из-за недостаточного поступления в организм кальция, витамина D или фосфатов может привести организм человека к остеомаляции. Остеомаляция — это заболевание при котором кости становятся мягкими и чрезвычайно ломкими.