|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (RAY-dee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery white metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mass number | [226] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Rn] 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 973 K (700 °C, 1292 °F) (disputed) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2010 K (1737 °C, 3159 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 5.5 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 8.5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 113 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | +2 (expected to have a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 221±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 283 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of radium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | from decay | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 18.6 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 1 µΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | nonmagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-14-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Pierre and Marie Curie (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Marie Curie (1910) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of radium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Radium is a chemical element with the symbol Ra and atomic number 88. It is the sixth element in group 2 of the periodic table, also known as the alkaline earth metals. Pure radium is silvery-white, but it readily reacts with nitrogen (rather than oxygen) upon exposure to air, forming a black surface layer of radium nitride (Ra3N2). All isotopes of radium are radioactive, the most stable isotope being radium-226 with a half-life of 1600 years. When radium decays, it emits ionizing radiation as a by-product, which can excite fluorescent chemicals and cause radioluminescence.
Radium, in the form of radium chloride, was discovered by Marie and Pierre Curie in 1898 from ore mined at Jáchymov. They extracted the radium compound from uraninite and published the discovery at the French Academy of Sciences five days later. Radium was isolated in its metallic state by Marie Curie and André-Louis Debierne through the electrolysis of radium chloride in 1911.[1]
In nature, radium is found in uranium and (to a lesser extent) thorium ores in trace amounts as small as a seventh of a gram per ton of uraninite. Radium is not necessary for living organisms, and adverse health effects are likely when it is incorporated into biochemical processes because of its radioactivity and chemical reactivity. As of 2014, other than its use in nuclear medicine, radium has no commercial applications. Formerly, around the 1950s, it was used as a radioactive source for radioluminescent devices and also in radioactive quackery for its supposed curative power. These applications have become obsolete owing to radium’s toxicity; as of 2020, less dangerous isotopes (of other elements) are instead used in radioluminescent devices.
Bulk properties
Radium is the heaviest known alkaline earth metal and is the only radioactive member of its group. Its physical and chemical properties most closely resemble its lighter congener, barium.[2]
Pure radium is a volatile silvery-white metal, although its lighter congeners calcium, strontium, and barium have a slight yellow tint.[2] This tint rapidly vanishes on exposure to air, yielding a black layer of what is probably radium nitride (Ra3N2).[3] Its melting point is either 700 °C (1,292 °F) or 960 °C (1,760 °F)[a] and its boiling point is 1,737 °C (3,159 °F); however, this is not well established.[4] Both of these values are slightly lower than those of barium, confirming periodic trends down the group 2 elements.[5] Like barium and the alkali metals, radium crystallizes in the body-centered cubic structure at standard temperature and pressure: the radium–radium bond distance is 514.8 picometers.[6] Radium has a density of 5.5 g/cm3, higher than that of barium, again confirming periodic trends; the radium-barium density ratio is comparable to the radium-barium atomic mass ratio,[7] due to the two elements’ similar crystal structures.[7][8]
Isotopes
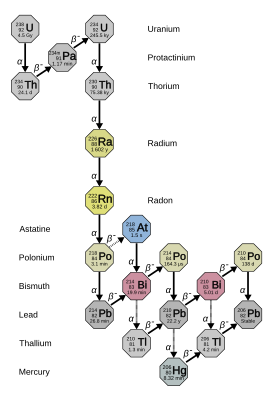
Radium has 33 known isotopes, with mass numbers from 202 to 234: all of them are radioactive.[9] Four of these – 223Ra (half-life 11.4 days), 224Ra (3.64 days), 226Ra (1600 years), and 228Ra (5.75 years) – occur naturally in the decay chains of primordial thorium-232, uranium-235, and uranium-238 (223Ra from uranium-235, 226Ra from uranium-238, and the other two from thorium-232). These isotopes nevertheless still have half-lives too short to be primordial radionuclides and only exist in nature from these decay chains.[10] Together with the mostly artificial 225Ra (15 d), which occurs in nature only as a decay product of minute traces of neptunium-237,[11] these are the five most stable isotopes of radium.[12] All other 27 known radium isotopes have half-lives under two hours, and the majority have half-lives under a minute.[9] At least 12 nuclear isomers have been reported; the most stable of them is radium-205m, with a half-life between 130 and 230 milliseconds; this is still shorter than twenty-four ground-state radium isotopes.[9]
In the early history of the study of radioactivity, the different natural isotopes of radium were given different names. In this scheme, 223Ra was named actinium X (AcX), 224Ra thorium X (ThX), 226Ra radium (Ra), and 228Ra mesothorium 1 (MsTh1).[10] When it was realized that all of these are isotopes of the same element, many of these names fell out of use, and «radium» came to refer to all isotopes, not just 226Ra. Some of radium-226’s decay products received historical names including «radium», ranging from radium A to radium G, with the letter indicating approximately how far they were down the chain from their parent 226Ra. Radium emanation = 222Rn, RaA = 218Po, RaB = 214Pb, RaC = 214Bi, RaC1 = 214Po, RaC2 = 210Tl, RaD = 210Pb, RaE = 210Bi, RaF = 210Po and RaG = 206Pb.[12][13]
226Ra is the most stable isotope of radium and is the last isotope in the (4n + 2) decay chain of uranium-238 with a half-life of over a millennium: it makes up almost all of natural radium. Its immediate decay product is the dense radioactive noble gas radon (specifically the isotope 222Rn), which is responsible for much of the danger of environmental radium.[14] It is 2.7 million times more radioactive than the same molar amount of natural uranium (mostly uranium-238), due to its proportionally shorter half-life.[15][16]
A sample of radium metal maintains itself at a higher temperature than its surroundings because of the radiation it emits – alpha particles, beta particles, and gamma rays. More specifically, natural radium (which is mostly 226Ra) emits mostly alpha particles, but other steps in its decay chain (the uranium or radium series) emit alpha or beta particles, and almost all particle emissions are accompanied by gamma rays.[17]
In 2013, it was discovered at CERN that the nucleus of radium-224 is pear-shaped using a technique called coulomb excitation. This was the first discovery of an asymmetric nucleus.[18] This is a strong circumstantial evidence that certain heavy, unstable atomic nuclei have distorted nuclei, in this case, a pear shape.[19]
Chemistry
Radium, like barium, is a highly reactive metal and always exhibits its group oxidation state of +2.[3] It forms the colorless Ra2+ cation in aqueous solution, which is highly basic and does not form complexes readily.[3] Most radium compounds are therefore simple ionic compounds,[3] though participation from the 6s and 6p electrons (in addition to the valence 7s electrons) is expected due to relativistic effects and would enhance the covalent character of radium compounds such as RaF2 and RaAt2.[20] For this reason, the standard electrode potential for the half-reaction Ra2+ (aq) + 2e− → Ra (s) is −2.916 V, even slightly lower than the value −2.92 V for barium, whereas the values had previously smoothly increased down the group (Ca: −2.84 V; Sr: −2.89 V; Ba: −2.92 V).[21] The values for barium and radium are almost exactly the same as those of the heavier alkali metals potassium, rubidium, and caesium.[21]
Compounds
Solid radium compounds are white as radium ions provide no specific coloring, but they gradually turn yellow and then dark over time due to self-radiolysis from radium’s alpha decay.[3] Insoluble radium compounds coprecipitate with all barium, most strontium, and most lead compounds.[22]
Radium oxide (RaO) has not been characterized well past its existence, despite oxides being common compounds for the other alkaline earth metals. Radium hydroxide (Ra(OH)2) is the most readily soluble among the alkaline earth hydroxides and is a stronger base than its barium congener, barium hydroxide.[23] It is also more soluble than actinium hydroxide and thorium hydroxide: these three adjacent hydroxides may be separated by precipitating them with ammonia.[23]
Radium chloride (RaCl2) is a colorless, luminous compound. It becomes yellow after some time due to self-damage by the alpha radiation given off by radium when it decays. Small amounts of barium impurities give the compound a rose color.[23] It is soluble in water, though less so than barium chloride, and its solubility decreases with increasing concentration of hydrochloric acid. Crystallization from aqueous solution gives the dihydrate RaCl2·2H2O, isomorphous with its barium analog.[23]
Radium bromide (RaBr2) is also a colorless, luminous compound.[23] In water, it is more soluble than radium chloride. Like radium chloride, crystallization from aqueous solution gives the dihydrate RaBr2·2H2O, isomorphous with its barium analog. The ionizing radiation emitted by radium bromide excites nitrogen molecules in the air, making it glow. The alpha particles emitted by radium quickly gain two electrons to become neutral helium, which builds up inside and weakens radium bromide crystals. This effect sometimes causes the crystals to break or even explode.[23]
Radium nitrate (Ra(NO3)2) is a white compound that can be made by dissolving radium carbonate in nitric acid. As the concentration of nitric acid increases, the solubility of radium nitrate decreases, an important property for the chemical purification of radium.[23]
Radium forms much the same insoluble salts as its lighter congener barium: it forms the insoluble sulfate (RaSO4, the most insoluble known sulfate), chromate (RaCrO4), carbonate (RaCO3), iodate (Ra(IO3)2), tetrafluoroberyllate (RaBeF4), and nitrate (Ra(NO3)2). With the exception of the carbonate, all of these are less soluble in water than the corresponding barium salts, but they are all isostructural to their barium counterparts. Additionally, radium phosphate, oxalate, and sulfite are probably also insoluble, as they coprecipitate with the corresponding insoluble barium salts.[24] The great insolubility of radium sulfate (at 20 °C, only 2.1 mg will dissolve in 1 kg of water) means that it is one of the less biologically dangerous radium compounds.[25] The large ionic radius of Ra2+ (148 pm) results in weak complexation and poor extraction of radium from aqueous solutions when not at high pH.[26]
Occurrence
All isotopes of radium have half-lives much shorter than the age of the Earth, so that any primordial radium would have decayed long ago. Radium nevertheless still occurs in the environment, as the isotopes 223Ra, 224Ra, 226Ra, and 228Ra are part of the decay chains of natural thorium and uranium isotopes; since thorium and uranium have very long half-lives, these daughters are continually being regenerated by their decay.[10] Of these four isotopes, the longest-lived is 226Ra (half-life 1600 years), a decay product of natural uranium. Because of its relative longevity, 226Ra is the most common isotope of the element, making up about one part per trillion of the Earth’s crust; essentially all natural radium is 226Ra.[27] Thus, radium is found in tiny quantities in the uranium ore uraninite and various other uranium minerals, and in even tinier quantities in thorium minerals. One ton of pitchblende typically yields about one seventh of a gram of radium.[28] One kilogram of the Earth’s crust contains about 900 picograms of radium, and one liter of sea water contains about 89 femtograms of radium.[29]
History
Marie and Pierre Curie experimenting with radium, a drawing by André Castaigne
Glass tube of radium chloride kept by the US Bureau of Standards that served as the primary standard of radioactivity for the United States in 1927.
Radium was discovered by Marie Skłodowska-Curie and her husband Pierre Curie on 21 December 1898, in a uraninite (pitchblende) sample from Jáchymov.[30] While studying the mineral earlier, the Curies removed uranium from it and found that the remaining material was still radioactive. In July 1898, while studying pitchblende, they isolated an element similar to bismuth which turned out to be polonium. They then isolated a radioactive mixture consisting of two components: compounds of barium, which gave a brilliant green flame color, and unknown radioactive compounds which gave carmine spectral lines that had never been documented before. The Curies found the radioactive compounds to be very similar to the barium compounds, except they were less soluble. This discovery made it possible for the Curies to isolate the radioactive compounds and discover a new element in them. The Curies announced their discovery to the French Academy of Sciences on 26 December 1898.[31][32] The naming of radium dates to about 1899, from the French word radium, formed in Modern Latin from radius (ray): this was in recognition of radium’s power of emitting energy in the form of rays.[33][34][35]
In September 1910, Marie Curie and André-Louis Debierne announced that they had isolated radium as a pure metal through the electrolysis of pure radium chloride (RaCl2) solution using a mercury cathode, producing radium–mercury amalgam.[36] This amalgam was then heated in an atmosphere of hydrogen gas to remove the mercury, leaving pure radium metal.[37] Later that same year, E. Eoler isolated radium by thermal decomposition of its azide, Ra(N3)2.[10] Radium metal was first industrially produced at the beginning of the 20th century by Biraco, a subsidiary company of Union Minière du Haut Katanga (UMHK) in its Olen plant in Belgium.[38]
The general historical unit for radioactivity, the curie, is based on the radioactivity of 226Ra: it was originally defined as the radioactivity of one gram of radium-226,[39] but the definition was later slightly refined to be 3.7×1010 disintegrations per second.
Historical applications
Luminescent paint
Radium watch hands under ultraviolet light
Radium was formerly used in self-luminous paints for watches, nuclear panels, aircraft switches, clocks, and instrument dials. A typical self-luminous watch that uses radium paint contains around 1 microgram of radium.[40] In the mid-1920s, a lawsuit was filed against the United States Radium Corporation by five dying «Radium Girls» – dial painters who had painted radium-based luminous paint on the dials of watches and clocks. The dial painters were instructed to lick their brushes to give them a fine point, thereby ingesting radium.[41] Their exposure to radium caused serious health effects which included sores, anemia, and bone cancer.[14]
During the litigation, it was determined that the company’s scientists and management had taken considerable precautions to protect themselves from the effects of radiation, but it did not seem to protect their employees. Additionally, for several years the companies had attempted to cover up the effects and avoid liability by insisting that the Radium Girls were instead suffering from syphilis. This complete disregard for employee welfare had a significant impact on the formulation of occupational disease labor law.[42]
As a result of the lawsuit, the adverse effects of radioactivity became widely known, and radium-dial painters were instructed in proper safety precautions and provided with protective gear. In particular, dial painters no longer licked paint brushes to shape them (which caused some ingestion of radium salts). Radium was still used in dials as late as the 1960s, but there were no further injuries to dial painters. This highlighted that the harm to the Radium Girls could easily have been avoided.[43]
From the 1960s the use of radium paint was discontinued. In many cases luminous dials were implemented with non-radioactive fluorescent materials excited by light; such devices glow in the dark after exposure to light, but the glow fades.[14] Where long-lasting self-luminosity in darkness was required, safer radioactive promethium-147 (half-life 2.6 years) or tritium (half-life 12 years) paint was used; both continue to be used as of 2004.[44] These had the added advantage of not degrading the phosphor over time, unlike radium.[45] Tritium emits very low-energy beta radiation (even lower-energy than the beta radiation emitted by promethium)[9] which cannot penetrate the skin,[46] rather than the penetrating gamma radiation of radium, and is regarded as safer.[47]
Clocks, watches, and instruments dating from the first half of the 20th century, often in military applications, may have been painted with radioactive luminous paint. They are usually no longer luminous; however, this is not due to radioactive decay of the radium (which has a half-life of 1600 years) but to the fluorescence of the zinc sulfide fluorescent medium being worn out by the radiation from the radium.[48] The appearance of an often thick layer of green or yellowish brown paint in devices from this period suggests a radioactive hazard. The radiation dose from an intact device is relatively low and usually not an acute risk; but the paint is dangerous if released and inhaled or ingested.[4][49]
Commercial use
Radium was once an additive in products such as toothpaste, hair creams, and even food items due to its supposed curative powers.[50] Such products soon fell out of vogue and were prohibited by authorities in many countries after it was discovered they could have serious adverse health effects. (See, for instance, Radithor or Revigator types of «radium water» or «Standard Radium Solution for Drinking».)[48] Spas featuring radium-rich water are still occasionally touted as beneficial, such as those in Misasa, Tottori, Japan. In the U.S., nasal radium irradiation was also administered to children to prevent middle-ear problems or enlarged tonsils from the late 1940s through the early 1970s.[51]
Medical use
1918 ad for Radior cosmetics, which the manufacturer claimed contained radium.
Radium (usually in the form of radium chloride or radium bromide) was used in medicine to produce radon gas, which in turn was used as a cancer treatment; for example, several of these radon sources were used in Canada in the 1920s and 1930s.[4][52] However, many treatments that were used in the early 1900s are not used anymore because of the harmful effects radium bromide exposure caused. Some examples of these effects are anaemia, cancer, and genetic mutations.[53] As of 2011, safer gamma emitters such as 60Co, which is less costly and available in larger quantities, are usually used to replace the historical use of radium in this application.[26]
Early in the 1900s, biologists used radium to induce mutations and study genetics. As early as 1904, Daniel MacDougal used radium in an attempt to determine whether it could provoke sudden large mutations and cause major evolutionary shifts. Thomas Hunt Morgan used radium to induce changes resulting in white-eyed fruit flies.
Nobel-winning biologist Hermann Muller briefly studied the effects of radium on fruit fly mutations before turning to more affordable x-ray experiments.[54]
Howard Atwood Kelly, one of the founding physicians of Johns Hopkins Hospital, was a major pioneer in the medical use of radium to treat cancer.[55] His first patient was his own aunt in 1904, who died shortly after surgery.[56] Kelly was known to use excessive amounts of radium to treat various cancers and tumors. As a result, some of his patients died from radium exposure.[57] His method of radium application was inserting a radium capsule near the affected area, then sewing the radium «points» directly to the tumor.[57] This was the same method used to treat Henrietta Lacks, the host of the original HeLa cells, for cervical cancer.[58] As of 2015, safer and more available radioisotopes are used instead.[14]
Production
Monument to the Discovery of Radium in Jáchymov
Uranium had no large scale application in the late 19th century and therefore no large uranium mines existed. In the beginning the only large source for uranium ore was the silver mines in Jáchymov, Austria-Hungary (now Czech Republic).[30] The uranium ore was only a byproduct of the mining activities.[59]
In the first extraction of radium, Curie used the residues after extraction of uranium from pitchblende. The uranium had been extracted by dissolution in sulfuric acid leaving radium sulfate, which is similar to barium sulfate but even less soluble in the residues. The residues also contained rather substantial amounts of barium sulfate which thus acted as a carrier for the radium sulfate. The first steps of the radium extraction process involved boiling with sodium hydroxide, followed by hydrochloric acid treatment to minimize impurities of other compounds. The remaining residue was then treated with sodium carbonate to convert the barium sulfate into barium carbonate (carrying the radium), thus making it soluble in hydrochloric acid. After dissolution, the barium and radium were reprecipitated as sulfates; this was then repeated to further purify the mixed sulfate. Some impurities that form insoluble sulfides were removed by treating the chloride solution with hydrogen sulfide, followed by filtering. When the mixed sulfates were pure enough, they were once more converted to mixed chlorides; barium and radium thereafter were separated by fractional crystallisation while monitoring the progress using a spectroscope (radium gives characteristic red lines in contrast to the green barium lines), and the electroscope.[60]
After the isolation of radium by Marie and Pierre Curie from uranium ore from Jáchymov, several scientists started to isolate radium in small quantities. Later, small companies purchased mine tailings from Jáchymov mines and started isolating radium. In 1904, the Austrian government nationalised the mines and stopped exporting raw ore. Until 1912 when radium production increased, radium availability was low.[59]
The formation of an Austrian monopoly and the strong urge of other countries to have access to radium led to a worldwide search for uranium ores. The United States took over as leading producer in the early 1910s. The Carnotite sands in Colorado provide some of the element, but richer ores are found in the Congo and the area of the Great Bear Lake and the Great Slave Lake of northwestern Canada. Neither of the deposits is mined for radium but the uranium content makes mining profitable.[30][61]
The Curies’ process was still used for industrial radium extraction in 1940, but mixed bromides were then used for the fractionation. If the barium content of the uranium ore is not high enough it is easy to add some to carry the radium. These processes were applied to high grade uranium ores but may not work well with low grade ores.[62]
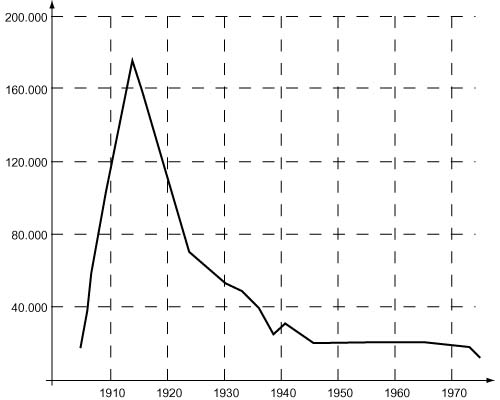
Small amounts of radium were still extracted from uranium ore by this method of mixed precipitation and ion exchange as late as the 1990s,[27] but as of 2011 they are extracted only from spent nuclear fuel.[63] In 1954, the total worldwide supply of purified radium amounted to about 5 pounds (2.3 kg)[40] and it is still in this range in 2015, while the annual production of pure radium compounds is only about 100 g in total as of 1984.[27] The chief radium-producing countries are Belgium, Canada, the Czech Republic, Slovakia, the United Kingdom, and Russia.[27] The amounts of radium produced were and are always relatively small; for example, in 1918, 13.6 g of radium were produced in the United States.[64] The metal is isolated by reducing radium oxide with aluminium metal in a vacuum at 1200 °C.[26]
Modern applications
This is an example of a king plot where it zooms in the important points to show its details.
Radium is seeing increasing use in the field of atomic, molecular, and optical physics. Symmetry breaking forces scale proportional to 
Radium is also promising for a trapped ion optical clock. The radium ion has two subhertz-linewidth transitions from the 
Though radium has no stable isotopes, there are eleven radium isotopes with half-lives longer than one minute that could be compared with high precision on a King plot. Isotope shifts could be measured with high precision on either of the radium ion subhertz-linewidth transitions from the ground state, or on the 

Some of the few practical uses of radium are derived from its radioactive properties. More recently discovered radioisotopes, such as cobalt-60 and caesium-137, are replacing radium in even these limited uses because several of these isotopes are more powerful emitters, safer to handle, and available in more concentrated form.[74][75]
The isotope 223Ra (the chloride is under the trade name Xofigo)[76] was approved by the United States Food and Drug Administration in 2013 for use in medicine as a cancer treatment of bone metastasis.[77][78] The main indication of treatment with Xofigo is the therapy of bony metastases from castration-resistant prostate cancer due to the favourable characteristics of this alpha-emitter radiopharmaceutical.[79] 225Ra has also been used in experiments concerning therapeutic irradiation, as it is the only reasonably long-lived radium isotope which does not have radon as one of its daughters.[80]
Radium is still used in 2007 as a radiation source in some industrial radiography devices to check for flawed metallic parts, similarly to X-ray imaging.[14] When mixed with beryllium, radium acts as a neutron source.[48][81] As of 2004, radium-beryllium neutron sources are still sometimes used,[14][82] but other materials such as polonium are more common: about 1500 polonium-beryllium neutron sources, with an individual activity of 1,850 Ci (68 TBq), have been used annually in Russia. These RaBeF4-based (α, n) neutron sources have been deprecated despite the high number of neutrons they emit (1.84×106 neutrons per second) in favour of 241Am–Be sources.[26] As of 2011, the isotope 226Ra is mainly used to form 227Ac by neutron irradiation in a nuclear reactor.[26]
Hazards
Radium is highly radioactive, and its immediate daughter, radon gas, is also radioactive. When ingested, 80% of the ingested radium leaves the body through the feces, while the other 20% goes into the bloodstream, mostly accumulating in the bones. This is because the body treats radium as calcium and deposits it in the bones, where radioactivity degrades marrow and can mutate bone cells. Exposure to radium, internal or external, can cause cancer and other disorders, because radium and radon emit alpha and gamma rays upon their decay, which kill and mutate cells.[14] At the time of the Manhattan Project in 1944, the «tolerance dose» for workers was set at 0.1 micrograms of ingested radium.[83][84]
Some of the biological effects of radium include the first case of «radium-dermatitis», reported in 1900, two years after the element’s discovery. The French physicist Antoine Becquerel carried a small ampoule of radium in his waistcoat pocket for six hours and reported that his skin became ulcerated. Pierre and Marie Curie were so intrigued by radiation that they sacrificed their own health to learn more about it. Pierre Curie attached a tube filled with radium to his arm for ten hours, which resulted in the appearance of a skin lesion, suggesting the use of radium to attack cancerous tissue as it had attacked healthy tissue.[85] Handling of radium has been blamed for Marie Curie’s death due to aplastic anemia. A significant amount of radium’s danger comes from its daughter radon: being a gas, it can enter the body far more readily than can its parent radium.[14]
As of 2015, 226Ra is considered to be the most toxic of the quantity radioelements, and it must be handled in tight glove boxes with significant airstream circulation that is then treated to avoid escape of its daughter 222Rn to the environment. Old ampoules containing radium solutions must be opened with care because radiolytic decomposition of water can produce an overpressure of hydrogen and oxygen gas.[26] The world’s largest concentration of 226Ra is stored within the Interim Waste Containment Structure, approximately 9.6 mi (15.4 km) north of Niagara Falls, New York.[86] The Maximum Contaminant Level (MCL) for radium is 5pCi/L for drinking water, however, the OSHA doesn’t set a exposure limit, as there is a radiation limit already set up.[87]
See also
Notes
- ^ Both values are encountered in sources and there is no agreement among scientists as to the true value of the melting point of radium.[3]
References
- ^ «Radium». Royal Society of Chemistry. Archived from the original on 24 March 2016. Retrieved 5 July 2016.
- ^ a b Greenwood and Earnshaw, p. 112
- ^ a b c d e f Kirby et al., p. 4
- ^ a b c Radium. Encyclopædia Britannica
- ^ Lide, D. R. (2004). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0484-2.
- ^ Weigel, F.; Trinkl, A. (1968). «Zur Kristallchemie des Radiums». Radiochim. Acta. 10 (1–2): 78. doi:10.1524/ract.1968.10.12.78. S2CID 100313675.
- ^ a b Young, David A. (1991). «Radium». Phase Diagrams of the Elements. University of California Press. p. 85. ISBN 978-0-520-91148-2.
- ^ «Crystal Structures of the Chemical Elements at 1 bar» Archived 26 August 2014 at the Wayback Machine. uni-bielefeld.de.
- ^ a b c d Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b c d Salutsky, M.L. & Kirby, H.W. THE RADIOCHEMISTRY OF RADIUM, report, December 1, 1964; United States, University of North Texas Libraries, UNT Digital Library; crediting UNT Libraries Government Documents Department. Page 3.
- ^ Peppard, D. F.; Mason, G. W.; Gray, P. R.; Mech, J. F (1952). «Occurrence of the (4n + 1) series in nature». Journal of the American Chemical Society. 74 (23): 6081–6084. doi:10.1021/ja01143a074. Archived from the original on 28 July 2019. Retrieved 6 July 2019.
- ^ a b Ropp, R.C. (2013), «The Alkaline Earths as Metals», Encyclopedia of the Alkaline Earth Compounds, Elsevier, pp. 1–23, doi:10.1016/b978-0-444-59550-8.00001-6, ISBN 978-0-444-59550-8, retrieved 30 March 2021
- ^ Kuhn, W. (1929). «LXVIII. Scattering of thorium C» γ-radiation by radium G and ordinary lead». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 8 (52): 628. doi:10.1080/14786441108564923. ISSN 1941-5982.
- ^ a b c d e f g h Radium: Radiation Protection. United States Environmental Protection Agency
- ^ Soddy, Frederick (25 August 2004). The Interpretation of Radium. pp. 139–. ISBN 978-0-486-43877-1. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Malley, Marjorie C. (2011). Radioactivity. Oxford University Press. pp. 115–. ISBN 978-0-19-983178-4. Retrieved 27 June 2015.
- ^ Strutt, R. J. (7 September 2004). The Becquerel Rays and the Properties of Radium. pp. 133–. ISBN 978-0-486-43875-7. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ «First observations of short-lived pear-shaped atomic nuclei – CERN». home.cern. Archived from the original on 12 June 2018. Retrieved 8 June 2018.
- ^ Gaffney, L. P.; Butler, P. A.; Scheck, M.; et al. (2013). «Studies of pear-shaped nuclei using accelerated radioactive beams». Nature. 497 (7448): 199–204. Bibcode:2013Natur.497..199G. doi:10.1038/nature12073. PMID 23657348. S2CID 4380776.
- ^ Thayer, John S. (2010), «Relativistic Effects and the Chemistry of the Heavier Main Group Elements», Relativistic Methods for Chemists, Challenges and Advances in Computational Chemistry and Physics, vol. 10, p. 81, doi:10.1007/978-1-4020-9975-5_2, ISBN 978-1-4020-9974-8
- ^ a b Greenwood and Earnshaw, p. 111
- ^ Kirby et al., p. 8
- ^ a b c d e f g Kirby et al., pp. 4–8
- ^ Kirby et al., pp. 8–9
- ^ Kirby et al., p. 12
- ^ a b c d e f Keller, Cornelius; Wolf, Walter; Shani, Jashovam. «Radionuclides, 2. Radioactive Elements and Artificial Radionuclides». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 97–98. doi:10.1002/14356007.o22_o15.
- ^ a b c d Greenwood and Earnshaw, pp. 109–110
- ^ «Radium» Archived 15 November 2012 at the Wayback Machine, Los Alamos National Laboratory. Retrieved 5 August 2009.
- ^ Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth’s Crust and in the Sea, in Lide, David R. (ed.), CRC Handbook of Chemistry and Physics, 85th Edition. CRC Press. Boca Raton, Florida (2005).
- ^ a b c Hammond, C. R. «Radium» in Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. ISBN 1-4398-5511-0.
- ^ Curie, Pierre; Curie, Marie & Bémont, Gustave (1898). «Sur une nouvelle substance fortement radio-active, contenue dans la pechblende (On a new, strongly radioactive substance contained in pitchblende)». Comptes Rendus. 127: 1215–1217. Archived from the original on 6 August 2009. Retrieved 1 August 2009.
- ^ Weeks, Mary Elvira (1933). «The discovery of the elements. XIX. The radioactive elements». Journal of Chemical Education. 10 (2): 79. Bibcode:1933JChEd..10…79W. doi:10.1021/ed010p79.
- ^ Ball, David W. (1985). «Elemental etymology: What’s in a name?». Journal of Chemical Education. 62 (9): 787–788. Bibcode:1985JChEd..62..787B. doi:10.1021/ed062p787.
- ^ Carvalho, Fernando P. (2011), «Marie Curie and the Discovery of Radium», The New Uranium Mining Boom, Springer Geology, pp. 3–13, doi:10.1007/978-3-642-22122-4_1, ISBN 978-3-642-22121-7
- ^ Weeks, Mary Elvira (1933). «The discovery of the elements. XIX. The radioactive elements». Journal of Chemical Education. 10 (2): 79. Bibcode:1933JChEd..10…79W. doi:10.1021/ed010p79.
- ^ Frank Moore Colby; Allen Leon Churchill (1911). New International Yearbook: A Compendium of the World’s Progress. Dodd, Mead and Co. pp. 152–.
- ^ Curie, Marie & Debierne, André (1910). «Sur le radium métallique» (On metallic radium)». Comptes Rendus (in French). 151: 523–525. Archived from the original on 20 July 2011. Retrieved 1 August 2009.
- ^ Ronneau, C.; Bitchaeva, O. (1997). Biotechnology for waste management and site restoration: Technological, educational, business, political aspects. Scientific Affairs Division, North Atlantic Treaty Organization. p. 206. ISBN 978-0-7923-4769-9. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Frame, Paul W. «How the Curie Came to Be». Archived from the original on 20 March 2012. Retrieved 30 April 2008.
- ^ a b Terrill, J. G. Jr.; Ingraham Sc, 2nd; Moeller, D. W. (1954). «Radium in the healing arts and in industry: Radiation exposure in the United States». Public Health Reports. 69 (3): 255–62. doi:10.2307/4588736. JSTOR 4588736. PMC 2024184. PMID 13134440.
- ^ Frame, Paul (1999). «Radioluminescent Paint». Museum of Radiation and Radioactivity. Oak Ridge Associated Universities. Archived from the original on 31 July 2014.
- ^ «Environmental history timeline – Radium Girls». 20 July 2012. Archived from the original on 2 September 2018. Retrieved 1 September 2018.
- ^ Rowland, R. E. (1995) Radium in humans: a review of U.S. studies Archived 9 November 2011 at the Wayback Machine. Argonne National Laboratory. p. 22
- ^ Tykva, Richard; Berg, Dieter (2004). Man-made and natural radioactivity in environmental pollution and radiochronology. Springer. p. 78. ISBN 978-1-4020-1860-2.
- ^ Lavrukhina, Avgusta Konstantinovna; Pozdnyakov, Aleksandr Aleksandrovich (1966). Аналитическая химия технеция, прометия, астатина и франция [Analytical Chemistry of Technetium, Promethium, Astatine, and Francium] (in Russian). Nauka. p. 118.
- ^ Nuclide safety data sheet: Hydrogen-3. ehso.emory.edu
- ^ Zerriffi, Hisham (January 1996). «Tritium: The environmental, health, budgetary, and strategic effects of the Department of Energy’s decision to produce tritium». Institute for Energy and Environmental Research. Archived from the original on 13 July 2010. Retrieved 15 September 2010.
- ^ a b c Emsley, John (2003). Nature’s building blocks: an A-Z guide to the elements. Oxford University Press. pp. 351–. ISBN 978-0-19-850340-8. Retrieved 27 June 2015.
- ^ Luminous Radium Paint Archived 4 March 2013 at the Wayback Machine. vintagewatchstraps.com
- ^ «French Web site featuring products (medicines, mineral water, even underwear) containing radium». Archived from the original on 15 March 2011. Retrieved 1 August 2009.
- ^ Cherbonnier, Alice (1 October 1997). «Nasal Radium Irradiation of Children Has Health Fallout». Baltimore Chronicle. Archived from the original on 28 September 2011. Retrieved 1 August 2009.
- ^ Hayter, Charles (2005). «The Politics of Radon Therapy in the 1930s». An Element of Hope: Radium and the Response to Cancer in Canada, 1900–1940. McGill-Queen’s Press. ISBN 978-0-7735-2869-7.
- ^ Harvie, David I. (1999). «The radium century». Endeavour. 23 (3): 100–5. doi:10.1016/S0160-9327(99)01201-6. PMID 10589294.
- ^ Hamilton, Vivien (2016). «The Secrets of Life: Historian Luis Campos resurrects radium’s role in early genetics research». Distillations. 2 (2): 44–45. Archived from the original on 23 March 2018. Retrieved 22 March 2018.
- ^ «The Four Founding Physicians». Archived from the original on 10 March 2015. Retrieved 10 April 2013.
- ^ Dastur, Adi E.; Tank, P. D. (2011). «Howard Atwood Kelly: much beyond the stitch». The Journal of Obstetrics and Gynecology of India. 60 (5): 392–394. doi:10.1007/s13224-010-0064-6. PMC 3394615.
- ^ a b Aronowitz, Jesse N.; Robison, Roger F. (2010). «Howard Kelly establishes gynecologic brachytherapy in the United States». Brachytherapy. 9 (2): 178–184. doi:10.1016/j.brachy.2009.10.001. PMID 20022564.
- ^ Rebecca Skloot (2 February 2010). The Immortal Life of Henrietta Lacks. Random House Digital, Inc. ISBN 978-0-307-58938-5. Archived from the original on 17 June 2013. Retrieved 8 April 2013.
- ^ a b Ceranski, Beate (2008). «Tauschwirtschaft, Reputationsökonomie, Bürokratie». NTM Zeitschrift für Geschichte der Wissenschaften, Technik und Medizin. 16 (4): 413–443. doi:10.1007/s00048-008-0308-z.
- ^ «Lateral Science» Archived 2 April 2015 at the Wayback Machine. lateralscience.blogspot.se. November 2012
- ^ Just, Evan; Swain, Philip W. & Kerr, William A. (1952). «Peacetíme Impact of Atomíc Energy». Financial Analysts Journal. 8 (1): 85–93. doi:10.2469/faj.v8.n1.85. JSTOR 40796935.
- ^ Kuebel, A. (1940). «Extraction of radium from Canadian pitchblende». Journal of Chemical Education. 17 (9): 417. Bibcode:1940JChEd..17..417K. doi:10.1021/ed017p417.
- ^ Emsley, John (2011). Nature’s building blocks: an A-Z guide to the elements. Oxford University Press. p. 437. ISBN 9780199605637.
- ^ Viol, C. H. (1919). «Radium Production». Science. 49 (1262): 227–8. Bibcode:1919Sci….49..227V. doi:10.1126/science.49.1262.227. PMID 17809659.
- ^ Bouchiat, Marie-Anne; Bouchiat, Claude (28 November 1997). «Parity violation in atoms». Reports on Progress in Physics. 60 (11): 1351–1396. Bibcode:1997RPPh…60.1351B. doi:10.1088/0034-4885/60/11/004. S2CID 250910046 – via Institute of Physics.
- ^ Commins, Eugene D.; Jackson, J. D.; DeMille, David P. (10 May 2007). «The electric dipole moment of the electron: An intuitive explanation for the evasion of Schiff’s theorem». American Journal of Physics. 75 (6): 532–536. Bibcode:2007AmJPh..75..532C. doi:10.1119/1.2710486 – via aapt.scitation.org (Atypon).
- ^ Dobaczewski, J.; Engel, J. (13 June 2005). «Nuclear Time-Reversal Violation and the Schiff Moment of $^{225}mathrm{Ra}$». Physical Review Letters. 94 (23): 232502. arXiv:nucl-th/0503057. doi:10.1103/PhysRevLett.94.232502. PMID 16090465. S2CID 328830 – via APS.
- ^ Graner, B.; Chen, Y.; Lindahl, E. G.; Heckel, B. R. (18 April 2016). «Reduced Limit on the Permanent Electric Dipole Moment of $^{199}mathrm{Hg}$». Physical Review Letters. 116 (16): 161601. arXiv:1601.04339. doi:10.1103/PhysRevLett.116.161601. PMID 27152789. S2CID 2230011 – via APS.
- ^ Parker, R. H.; Dietrich, M. R.; Kalita, M. R.; Lemke, N. D.; Bailey, K. G.; Bishof, M.; Greene, J. P.; Holt, R. J.; Korsch, W.; Lu, Z.-T.; Mueller, P.; O’Connor, T. P.; Singh, J. T. (9 June 2015). «First Measurement of the Atomic Electric Dipole Moment of $^{225}mathrm{Ra}$». Physical Review Letters. 114 (23): 233002. arXiv:1504.07477. doi:10.1103/PhysRevLett.114.233002. PMID 26196797. S2CID 41982867 – via APS.
- ^ Nuñez Portela, M.; Dijck, E. A.; Mohanty, A.; Bekker, H.; van den Berg, J. E.; Giri, G. S.; Hoekstra, S.; Onderwater, C. J. G.; Schlesser, S.; Timmermans, R. G. E.; Versolato, O. O.; Willmann, L.; Wilschut, H. W.; Jungmann, K. (1 January 2014). «Ra+ ion trapping: toward an atomic parity violation measurement and an optical clock». Applied Physics B. 114 (1): 173–182. Bibcode:2014ApPhB.114..173N. doi:10.1007/s00340-013-5603-2. S2CID 119948902 – via Springer Link.
- ^ «Energy Levels of Singly Ionized Radium (Ra II)». physics.nist.gov.
- ^ Bieroń, J.; Indelicato, P.; Jönsson, P. (1 May 2007). «Multiconfiguration Dirac-Hartree-Fock calculations oftransition rates and lifetimes of the eight lowest excited levels of radium». The European Physical Journal Special Topics. 144 (1): 75–84. arXiv:physics/0701239. Bibcode:2007EPJST.144…75B. doi:10.1140/epjst/e2007-00110-3. S2CID 18380607 – via Springer Link.
- ^ Antypas, D.; Fabricant, A.; Stalnaker, J. E.; Tsigutkin, K.; Flambaum, V. V.; Budker, D. (28 February 2019). «Isotopic variation of parity violation in atomic ytterbium». Nature Physics. 15 (2): 120–123. arXiv:1804.05747. doi:10.1038/s41567-018-0312-8. S2CID 89612054 – via www.nature.com.
- ^ Committee On Radiation Source Use And Replacement, National Research Council (U.S.); Nuclear And Radiation Studies Board, National Research Council (U.S.) (January 2008). Radiation source use and replacement: Abbreviated version. p. 24. ISBN 978-0-309-11014-3. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Bentel, Gunilla Carleson (1996). Radiation therapy planning. p. 8. ISBN 978-0-07-005115-7. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ «Xofigo US Patent». Xofigo. Xofigo. Retrieved 28 September 2022.
- ^ «FDA OKs pinpoint prostate cancer radiation drug Xofigo from Bayer, Algeta». Archived from the original on 28 June 2013. Retrieved 1 October 2014.
- ^ «FDA Approves Xofigo for Advanced Prostate Cancer». cancer.org. (2013-05-15)
- ^ Maffioli, L.; Florimonte, L.; Costa, D. C.; Correia Castanheira, J.; Grana, C.; Luster, M.; Bodei, L.; Chinol, M. (2015). «New radiopharmaceutical agents for the treatment of castration-resistant prostate cancer». Q J Nucl Med Mol Imaging. 59 (4): 420–38. PMID 26222274.
- ^ Stoll, Wolfgang (2005). «Thorium and Thorium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. p. 717. doi:10.1002/14356007.a27_001. ISBN 978-3-527-31097-5.
- ^ l’Annunziata, Michael F. (2007). «Alpha particle induced nuclear reactions». Radioactivity: Introduction and history. Elsevier. pp. 260–261. ISBN 978-0-444-52715-8.
- ^ Holden, N. E.; Reciniello, R. N.; Hu, J. P.; Rorer, David C. (2004). «Radiation dosimetry of a graphite moderated radium-beryllium source» (PDF). Health Physics. 86 (5 Suppl): S110–2. Bibcode:2003rdtc.conf..484H. doi:10.1142/9789812705563_0060. PMID 15069300. Archived (PDF) from the original on 23 July 2018. Retrieved 25 October 2017.
- ^ Weisgall, Jonathan M. (1994). Operation crossroads: the atomic tests at Bikini Atoll. Naval Institute Press. p. 238. ISBN 978-1-55750-919-2. Retrieved 20 August 2011.
- ^ Fry, Shirley A. (1998). «Supplement: Madame Curie’s Discovery of Radium (1898): A Commemoration by Women in Radiation Sciences». Radiation Research. 150 (5): S21–S29. Bibcode:1998RadR..150S..21F. doi:10.2307/3579805. JSTOR 3579805. PMID 9806606.
- ^ Redniss, Lauren (2011). Radioactive: Marie & Pierre Curie: A Tale Of Love And Fallout. New York, NY: HarperCollins. p. 70. ISBN 978-0-06-135132-7.
- ^ Jenks, Andrew (July 2002). «Model City USA: The Environmental Cost of Victory in World War II and the Cold War». Environmental History. 12 (77): 552–577. doi:10.1093/envhis/12.3.552. (subscription required)
- ^ https://semspub.epa.gov/work/11/176334.pdf[bare URL PDF]
Bibliography
- Kirby, H. W.; Salutsky, Murrell L. (1964). The Radiochemistry of Radium (PDF). National Academies Press.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
Further reading
- Albert Stwertka (1998). Guide to the Elements – Revised Edition. Oxford University Press. ISBN 978-0-19-508083-4.
- Denise Grady (6 October 1998). «A Glow in the Dark, and a Lesson in Scientific Peril». The New York Times. Retrieved 25 December 2007.
- Nanny Fröman (1 December 1996). «Marie and Pierre Curie and the Discovery of Polonium and Radium». Nobel Foundation. Retrieved 25 December 2007.
- Macklis, R. M. (1993). «The great radium scandal». Scientific American. 269 (2): 94–99. Bibcode:1993SciAm.269b..94M. doi:10.1038/scientificamerican0893-94. PMID 8351514.
- Clark, Claudia (1987). Radium Girls: Women and Industrial Health Reform, 1910–1935. University of North Carolina Press. ISBN 978-0-8078-4640-7.
- Marie Curie (1921), The Discovery of Radium: Address by Madame M. Curie at Vassar College May 14, 1921 (1st ed.), Poughkeepsie: Vassar College, Wikidata Q22920166
External links
- «Lateral Science: The Discovery of Radium». 8 July 2012. Archived from the original on 9 March 2016. Retrieved 13 May 2017.
- Photos of Radium Water Bath in Oklahoma
- NLM Hazardous Substances Databank – Radium, Radioactive
- Annotated bibliography for radium from the Alsos Digital Library for Nuclear Issues Archived 25 June 2019 at the Wayback Machine
- Radium at The Periodic Table of Videos (University of Nottingham)
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (RAY-dee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery white metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mass number | [226] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Rn] 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 973 K (700 °C, 1292 °F) (disputed) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2010 K (1737 °C, 3159 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 5.5 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 8.5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 113 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | +2 (expected to have a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 221±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 283 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of radium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | from decay | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 18.6 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 1 µΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | nonmagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-14-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Pierre and Marie Curie (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Marie Curie (1910) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of radium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Radium is a chemical element with the symbol Ra and atomic number 88. It is the sixth element in group 2 of the periodic table, also known as the alkaline earth metals. Pure radium is silvery-white, but it readily reacts with nitrogen (rather than oxygen) upon exposure to air, forming a black surface layer of radium nitride (Ra3N2). All isotopes of radium are radioactive, the most stable isotope being radium-226 with a half-life of 1600 years. When radium decays, it emits ionizing radiation as a by-product, which can excite fluorescent chemicals and cause radioluminescence.
Radium, in the form of radium chloride, was discovered by Marie and Pierre Curie in 1898 from ore mined at Jáchymov. They extracted the radium compound from uraninite and published the discovery at the French Academy of Sciences five days later. Radium was isolated in its metallic state by Marie Curie and André-Louis Debierne through the electrolysis of radium chloride in 1911.[1]
In nature, radium is found in uranium and (to a lesser extent) thorium ores in trace amounts as small as a seventh of a gram per ton of uraninite. Radium is not necessary for living organisms, and adverse health effects are likely when it is incorporated into biochemical processes because of its radioactivity and chemical reactivity. As of 2014, other than its use in nuclear medicine, radium has no commercial applications. Formerly, around the 1950s, it was used as a radioactive source for radioluminescent devices and also in radioactive quackery for its supposed curative power. These applications have become obsolete owing to radium’s toxicity; as of 2020, less dangerous isotopes (of other elements) are instead used in radioluminescent devices.
Bulk properties
Radium is the heaviest known alkaline earth metal and is the only radioactive member of its group. Its physical and chemical properties most closely resemble its lighter congener, barium.[2]
Pure radium is a volatile silvery-white metal, although its lighter congeners calcium, strontium, and barium have a slight yellow tint.[2] This tint rapidly vanishes on exposure to air, yielding a black layer of what is probably radium nitride (Ra3N2).[3] Its melting point is either 700 °C (1,292 °F) or 960 °C (1,760 °F)[a] and its boiling point is 1,737 °C (3,159 °F); however, this is not well established.[4] Both of these values are slightly lower than those of barium, confirming periodic trends down the group 2 elements.[5] Like barium and the alkali metals, radium crystallizes in the body-centered cubic structure at standard temperature and pressure: the radium–radium bond distance is 514.8 picometers.[6] Radium has a density of 5.5 g/cm3, higher than that of barium, again confirming periodic trends; the radium-barium density ratio is comparable to the radium-barium atomic mass ratio,[7] due to the two elements’ similar crystal structures.[7][8]
Isotopes
Radium has 33 known isotopes, with mass numbers from 202 to 234: all of them are radioactive.[9] Four of these – 223Ra (half-life 11.4 days), 224Ra (3.64 days), 226Ra (1600 years), and 228Ra (5.75 years) – occur naturally in the decay chains of primordial thorium-232, uranium-235, and uranium-238 (223Ra from uranium-235, 226Ra from uranium-238, and the other two from thorium-232). These isotopes nevertheless still have half-lives too short to be primordial radionuclides and only exist in nature from these decay chains.[10] Together with the mostly artificial 225Ra (15 d), which occurs in nature only as a decay product of minute traces of neptunium-237,[11] these are the five most stable isotopes of radium.[12] All other 27 known radium isotopes have half-lives under two hours, and the majority have half-lives under a minute.[9] At least 12 nuclear isomers have been reported; the most stable of them is radium-205m, with a half-life between 130 and 230 milliseconds; this is still shorter than twenty-four ground-state radium isotopes.[9]
In the early history of the study of radioactivity, the different natural isotopes of radium were given different names. In this scheme, 223Ra was named actinium X (AcX), 224Ra thorium X (ThX), 226Ra radium (Ra), and 228Ra mesothorium 1 (MsTh1).[10] When it was realized that all of these are isotopes of the same element, many of these names fell out of use, and «radium» came to refer to all isotopes, not just 226Ra. Some of radium-226’s decay products received historical names including «radium», ranging from radium A to radium G, with the letter indicating approximately how far they were down the chain from their parent 226Ra. Radium emanation = 222Rn, RaA = 218Po, RaB = 214Pb, RaC = 214Bi, RaC1 = 214Po, RaC2 = 210Tl, RaD = 210Pb, RaE = 210Bi, RaF = 210Po and RaG = 206Pb.[12][13]
226Ra is the most stable isotope of radium and is the last isotope in the (4n + 2) decay chain of uranium-238 with a half-life of over a millennium: it makes up almost all of natural radium. Its immediate decay product is the dense radioactive noble gas radon (specifically the isotope 222Rn), which is responsible for much of the danger of environmental radium.[14] It is 2.7 million times more radioactive than the same molar amount of natural uranium (mostly uranium-238), due to its proportionally shorter half-life.[15][16]
A sample of radium metal maintains itself at a higher temperature than its surroundings because of the radiation it emits – alpha particles, beta particles, and gamma rays. More specifically, natural radium (which is mostly 226Ra) emits mostly alpha particles, but other steps in its decay chain (the uranium or radium series) emit alpha or beta particles, and almost all particle emissions are accompanied by gamma rays.[17]
In 2013, it was discovered at CERN that the nucleus of radium-224 is pear-shaped using a technique called coulomb excitation. This was the first discovery of an asymmetric nucleus.[18] This is a strong circumstantial evidence that certain heavy, unstable atomic nuclei have distorted nuclei, in this case, a pear shape.[19]
Chemistry
Radium, like barium, is a highly reactive metal and always exhibits its group oxidation state of +2.[3] It forms the colorless Ra2+ cation in aqueous solution, which is highly basic and does not form complexes readily.[3] Most radium compounds are therefore simple ionic compounds,[3] though participation from the 6s and 6p electrons (in addition to the valence 7s electrons) is expected due to relativistic effects and would enhance the covalent character of radium compounds such as RaF2 and RaAt2.[20] For this reason, the standard electrode potential for the half-reaction Ra2+ (aq) + 2e− → Ra (s) is −2.916 V, even slightly lower than the value −2.92 V for barium, whereas the values had previously smoothly increased down the group (Ca: −2.84 V; Sr: −2.89 V; Ba: −2.92 V).[21] The values for barium and radium are almost exactly the same as those of the heavier alkali metals potassium, rubidium, and caesium.[21]
Compounds
Solid radium compounds are white as radium ions provide no specific coloring, but they gradually turn yellow and then dark over time due to self-radiolysis from radium’s alpha decay.[3] Insoluble radium compounds coprecipitate with all barium, most strontium, and most lead compounds.[22]
Radium oxide (RaO) has not been characterized well past its existence, despite oxides being common compounds for the other alkaline earth metals. Radium hydroxide (Ra(OH)2) is the most readily soluble among the alkaline earth hydroxides and is a stronger base than its barium congener, barium hydroxide.[23] It is also more soluble than actinium hydroxide and thorium hydroxide: these three adjacent hydroxides may be separated by precipitating them with ammonia.[23]
Radium chloride (RaCl2) is a colorless, luminous compound. It becomes yellow after some time due to self-damage by the alpha radiation given off by radium when it decays. Small amounts of barium impurities give the compound a rose color.[23] It is soluble in water, though less so than barium chloride, and its solubility decreases with increasing concentration of hydrochloric acid. Crystallization from aqueous solution gives the dihydrate RaCl2·2H2O, isomorphous with its barium analog.[23]
Radium bromide (RaBr2) is also a colorless, luminous compound.[23] In water, it is more soluble than radium chloride. Like radium chloride, crystallization from aqueous solution gives the dihydrate RaBr2·2H2O, isomorphous with its barium analog. The ionizing radiation emitted by radium bromide excites nitrogen molecules in the air, making it glow. The alpha particles emitted by radium quickly gain two electrons to become neutral helium, which builds up inside and weakens radium bromide crystals. This effect sometimes causes the crystals to break or even explode.[23]
Radium nitrate (Ra(NO3)2) is a white compound that can be made by dissolving radium carbonate in nitric acid. As the concentration of nitric acid increases, the solubility of radium nitrate decreases, an important property for the chemical purification of radium.[23]
Radium forms much the same insoluble salts as its lighter congener barium: it forms the insoluble sulfate (RaSO4, the most insoluble known sulfate), chromate (RaCrO4), carbonate (RaCO3), iodate (Ra(IO3)2), tetrafluoroberyllate (RaBeF4), and nitrate (Ra(NO3)2). With the exception of the carbonate, all of these are less soluble in water than the corresponding barium salts, but they are all isostructural to their barium counterparts. Additionally, radium phosphate, oxalate, and sulfite are probably also insoluble, as they coprecipitate with the corresponding insoluble barium salts.[24] The great insolubility of radium sulfate (at 20 °C, only 2.1 mg will dissolve in 1 kg of water) means that it is one of the less biologically dangerous radium compounds.[25] The large ionic radius of Ra2+ (148 pm) results in weak complexation and poor extraction of radium from aqueous solutions when not at high pH.[26]
Occurrence
All isotopes of radium have half-lives much shorter than the age of the Earth, so that any primordial radium would have decayed long ago. Radium nevertheless still occurs in the environment, as the isotopes 223Ra, 224Ra, 226Ra, and 228Ra are part of the decay chains of natural thorium and uranium isotopes; since thorium and uranium have very long half-lives, these daughters are continually being regenerated by their decay.[10] Of these four isotopes, the longest-lived is 226Ra (half-life 1600 years), a decay product of natural uranium. Because of its relative longevity, 226Ra is the most common isotope of the element, making up about one part per trillion of the Earth’s crust; essentially all natural radium is 226Ra.[27] Thus, radium is found in tiny quantities in the uranium ore uraninite and various other uranium minerals, and in even tinier quantities in thorium minerals. One ton of pitchblende typically yields about one seventh of a gram of radium.[28] One kilogram of the Earth’s crust contains about 900 picograms of radium, and one liter of sea water contains about 89 femtograms of radium.[29]
History
Marie and Pierre Curie experimenting with radium, a drawing by André Castaigne
Glass tube of radium chloride kept by the US Bureau of Standards that served as the primary standard of radioactivity for the United States in 1927.
Radium was discovered by Marie Skłodowska-Curie and her husband Pierre Curie on 21 December 1898, in a uraninite (pitchblende) sample from Jáchymov.[30] While studying the mineral earlier, the Curies removed uranium from it and found that the remaining material was still radioactive. In July 1898, while studying pitchblende, they isolated an element similar to bismuth which turned out to be polonium. They then isolated a radioactive mixture consisting of two components: compounds of barium, which gave a brilliant green flame color, and unknown radioactive compounds which gave carmine spectral lines that had never been documented before. The Curies found the radioactive compounds to be very similar to the barium compounds, except they were less soluble. This discovery made it possible for the Curies to isolate the radioactive compounds and discover a new element in them. The Curies announced their discovery to the French Academy of Sciences on 26 December 1898.[31][32] The naming of radium dates to about 1899, from the French word radium, formed in Modern Latin from radius (ray): this was in recognition of radium’s power of emitting energy in the form of rays.[33][34][35]
In September 1910, Marie Curie and André-Louis Debierne announced that they had isolated radium as a pure metal through the electrolysis of pure radium chloride (RaCl2) solution using a mercury cathode, producing radium–mercury amalgam.[36] This amalgam was then heated in an atmosphere of hydrogen gas to remove the mercury, leaving pure radium metal.[37] Later that same year, E. Eoler isolated radium by thermal decomposition of its azide, Ra(N3)2.[10] Radium metal was first industrially produced at the beginning of the 20th century by Biraco, a subsidiary company of Union Minière du Haut Katanga (UMHK) in its Olen plant in Belgium.[38]
The general historical unit for radioactivity, the curie, is based on the radioactivity of 226Ra: it was originally defined as the radioactivity of one gram of radium-226,[39] but the definition was later slightly refined to be 3.7×1010 disintegrations per second.
Historical applications
Luminescent paint
Radium watch hands under ultraviolet light
Radium was formerly used in self-luminous paints for watches, nuclear panels, aircraft switches, clocks, and instrument dials. A typical self-luminous watch that uses radium paint contains around 1 microgram of radium.[40] In the mid-1920s, a lawsuit was filed against the United States Radium Corporation by five dying «Radium Girls» – dial painters who had painted radium-based luminous paint on the dials of watches and clocks. The dial painters were instructed to lick their brushes to give them a fine point, thereby ingesting radium.[41] Their exposure to radium caused serious health effects which included sores, anemia, and bone cancer.[14]
During the litigation, it was determined that the company’s scientists and management had taken considerable precautions to protect themselves from the effects of radiation, but it did not seem to protect their employees. Additionally, for several years the companies had attempted to cover up the effects and avoid liability by insisting that the Radium Girls were instead suffering from syphilis. This complete disregard for employee welfare had a significant impact on the formulation of occupational disease labor law.[42]
As a result of the lawsuit, the adverse effects of radioactivity became widely known, and radium-dial painters were instructed in proper safety precautions and provided with protective gear. In particular, dial painters no longer licked paint brushes to shape them (which caused some ingestion of radium salts). Radium was still used in dials as late as the 1960s, but there were no further injuries to dial painters. This highlighted that the harm to the Radium Girls could easily have been avoided.[43]
From the 1960s the use of radium paint was discontinued. In many cases luminous dials were implemented with non-radioactive fluorescent materials excited by light; such devices glow in the dark after exposure to light, but the glow fades.[14] Where long-lasting self-luminosity in darkness was required, safer radioactive promethium-147 (half-life 2.6 years) or tritium (half-life 12 years) paint was used; both continue to be used as of 2004.[44] These had the added advantage of not degrading the phosphor over time, unlike radium.[45] Tritium emits very low-energy beta radiation (even lower-energy than the beta radiation emitted by promethium)[9] which cannot penetrate the skin,[46] rather than the penetrating gamma radiation of radium, and is regarded as safer.[47]
Clocks, watches, and instruments dating from the first half of the 20th century, often in military applications, may have been painted with radioactive luminous paint. They are usually no longer luminous; however, this is not due to radioactive decay of the radium (which has a half-life of 1600 years) but to the fluorescence of the zinc sulfide fluorescent medium being worn out by the radiation from the radium.[48] The appearance of an often thick layer of green or yellowish brown paint in devices from this period suggests a radioactive hazard. The radiation dose from an intact device is relatively low and usually not an acute risk; but the paint is dangerous if released and inhaled or ingested.[4][49]
Commercial use
Radium was once an additive in products such as toothpaste, hair creams, and even food items due to its supposed curative powers.[50] Such products soon fell out of vogue and were prohibited by authorities in many countries after it was discovered they could have serious adverse health effects. (See, for instance, Radithor or Revigator types of «radium water» or «Standard Radium Solution for Drinking».)[48] Spas featuring radium-rich water are still occasionally touted as beneficial, such as those in Misasa, Tottori, Japan. In the U.S., nasal radium irradiation was also administered to children to prevent middle-ear problems or enlarged tonsils from the late 1940s through the early 1970s.[51]
Medical use
1918 ad for Radior cosmetics, which the manufacturer claimed contained radium.
Radium (usually in the form of radium chloride or radium bromide) was used in medicine to produce radon gas, which in turn was used as a cancer treatment; for example, several of these radon sources were used in Canada in the 1920s and 1930s.[4][52] However, many treatments that were used in the early 1900s are not used anymore because of the harmful effects radium bromide exposure caused. Some examples of these effects are anaemia, cancer, and genetic mutations.[53] As of 2011, safer gamma emitters such as 60Co, which is less costly and available in larger quantities, are usually used to replace the historical use of radium in this application.[26]
Early in the 1900s, biologists used radium to induce mutations and study genetics. As early as 1904, Daniel MacDougal used radium in an attempt to determine whether it could provoke sudden large mutations and cause major evolutionary shifts. Thomas Hunt Morgan used radium to induce changes resulting in white-eyed fruit flies.
Nobel-winning biologist Hermann Muller briefly studied the effects of radium on fruit fly mutations before turning to more affordable x-ray experiments.[54]
Howard Atwood Kelly, one of the founding physicians of Johns Hopkins Hospital, was a major pioneer in the medical use of radium to treat cancer.[55] His first patient was his own aunt in 1904, who died shortly after surgery.[56] Kelly was known to use excessive amounts of radium to treat various cancers and tumors. As a result, some of his patients died from radium exposure.[57] His method of radium application was inserting a radium capsule near the affected area, then sewing the radium «points» directly to the tumor.[57] This was the same method used to treat Henrietta Lacks, the host of the original HeLa cells, for cervical cancer.[58] As of 2015, safer and more available radioisotopes are used instead.[14]
Production
Monument to the Discovery of Radium in Jáchymov
Uranium had no large scale application in the late 19th century and therefore no large uranium mines existed. In the beginning the only large source for uranium ore was the silver mines in Jáchymov, Austria-Hungary (now Czech Republic).[30] The uranium ore was only a byproduct of the mining activities.[59]
In the first extraction of radium, Curie used the residues after extraction of uranium from pitchblende. The uranium had been extracted by dissolution in sulfuric acid leaving radium sulfate, which is similar to barium sulfate but even less soluble in the residues. The residues also contained rather substantial amounts of barium sulfate which thus acted as a carrier for the radium sulfate. The first steps of the radium extraction process involved boiling with sodium hydroxide, followed by hydrochloric acid treatment to minimize impurities of other compounds. The remaining residue was then treated with sodium carbonate to convert the barium sulfate into barium carbonate (carrying the radium), thus making it soluble in hydrochloric acid. After dissolution, the barium and radium were reprecipitated as sulfates; this was then repeated to further purify the mixed sulfate. Some impurities that form insoluble sulfides were removed by treating the chloride solution with hydrogen sulfide, followed by filtering. When the mixed sulfates were pure enough, they were once more converted to mixed chlorides; barium and radium thereafter were separated by fractional crystallisation while monitoring the progress using a spectroscope (radium gives characteristic red lines in contrast to the green barium lines), and the electroscope.[60]
After the isolation of radium by Marie and Pierre Curie from uranium ore from Jáchymov, several scientists started to isolate radium in small quantities. Later, small companies purchased mine tailings from Jáchymov mines and started isolating radium. In 1904, the Austrian government nationalised the mines and stopped exporting raw ore. Until 1912 when radium production increased, radium availability was low.[59]
The formation of an Austrian monopoly and the strong urge of other countries to have access to radium led to a worldwide search for uranium ores. The United States took over as leading producer in the early 1910s. The Carnotite sands in Colorado provide some of the element, but richer ores are found in the Congo and the area of the Great Bear Lake and the Great Slave Lake of northwestern Canada. Neither of the deposits is mined for radium but the uranium content makes mining profitable.[30][61]
The Curies’ process was still used for industrial radium extraction in 1940, but mixed bromides were then used for the fractionation. If the barium content of the uranium ore is not high enough it is easy to add some to carry the radium. These processes were applied to high grade uranium ores but may not work well with low grade ores.[62]
Small amounts of radium were still extracted from uranium ore by this method of mixed precipitation and ion exchange as late as the 1990s,[27] but as of 2011 they are extracted only from spent nuclear fuel.[63] In 1954, the total worldwide supply of purified radium amounted to about 5 pounds (2.3 kg)[40] and it is still in this range in 2015, while the annual production of pure radium compounds is only about 100 g in total as of 1984.[27] The chief radium-producing countries are Belgium, Canada, the Czech Republic, Slovakia, the United Kingdom, and Russia.[27] The amounts of radium produced were and are always relatively small; for example, in 1918, 13.6 g of radium were produced in the United States.[64] The metal is isolated by reducing radium oxide with aluminium metal in a vacuum at 1200 °C.[26]
Modern applications
This is an example of a king plot where it zooms in the important points to show its details.
Radium is seeing increasing use in the field of atomic, molecular, and optical physics. Symmetry breaking forces scale proportional to 
Radium is also promising for a trapped ion optical clock. The radium ion has two subhertz-linewidth transitions from the 
Though radium has no stable isotopes, there are eleven radium isotopes with half-lives longer than one minute that could be compared with high precision on a King plot. Isotope shifts could be measured with high precision on either of the radium ion subhertz-linewidth transitions from the ground state, or on the 

Some of the few practical uses of radium are derived from its radioactive properties. More recently discovered radioisotopes, such as cobalt-60 and caesium-137, are replacing radium in even these limited uses because several of these isotopes are more powerful emitters, safer to handle, and available in more concentrated form.[74][75]
The isotope 223Ra (the chloride is under the trade name Xofigo)[76] was approved by the United States Food and Drug Administration in 2013 for use in medicine as a cancer treatment of bone metastasis.[77][78] The main indication of treatment with Xofigo is the therapy of bony metastases from castration-resistant prostate cancer due to the favourable characteristics of this alpha-emitter radiopharmaceutical.[79] 225Ra has also been used in experiments concerning therapeutic irradiation, as it is the only reasonably long-lived radium isotope which does not have radon as one of its daughters.[80]
Radium is still used in 2007 as a radiation source in some industrial radiography devices to check for flawed metallic parts, similarly to X-ray imaging.[14] When mixed with beryllium, radium acts as a neutron source.[48][81] As of 2004, radium-beryllium neutron sources are still sometimes used,[14][82] but other materials such as polonium are more common: about 1500 polonium-beryllium neutron sources, with an individual activity of 1,850 Ci (68 TBq), have been used annually in Russia. These RaBeF4-based (α, n) neutron sources have been deprecated despite the high number of neutrons they emit (1.84×106 neutrons per second) in favour of 241Am–Be sources.[26] As of 2011, the isotope 226Ra is mainly used to form 227Ac by neutron irradiation in a nuclear reactor.[26]
Hazards
Radium is highly radioactive, and its immediate daughter, radon gas, is also radioactive. When ingested, 80% of the ingested radium leaves the body through the feces, while the other 20% goes into the bloodstream, mostly accumulating in the bones. This is because the body treats radium as calcium and deposits it in the bones, where radioactivity degrades marrow and can mutate bone cells. Exposure to radium, internal or external, can cause cancer and other disorders, because radium and radon emit alpha and gamma rays upon their decay, which kill and mutate cells.[14] At the time of the Manhattan Project in 1944, the «tolerance dose» for workers was set at 0.1 micrograms of ingested radium.[83][84]
Some of the biological effects of radium include the first case of «radium-dermatitis», reported in 1900, two years after the element’s discovery. The French physicist Antoine Becquerel carried a small ampoule of radium in his waistcoat pocket for six hours and reported that his skin became ulcerated. Pierre and Marie Curie were so intrigued by radiation that they sacrificed their own health to learn more about it. Pierre Curie attached a tube filled with radium to his arm for ten hours, which resulted in the appearance of a skin lesion, suggesting the use of radium to attack cancerous tissue as it had attacked healthy tissue.[85] Handling of radium has been blamed for Marie Curie’s death due to aplastic anemia. A significant amount of radium’s danger comes from its daughter radon: being a gas, it can enter the body far more readily than can its parent radium.[14]
As of 2015, 226Ra is considered to be the most toxic of the quantity radioelements, and it must be handled in tight glove boxes with significant airstream circulation that is then treated to avoid escape of its daughter 222Rn to the environment. Old ampoules containing radium solutions must be opened with care because radiolytic decomposition of water can produce an overpressure of hydrogen and oxygen gas.[26] The world’s largest concentration of 226Ra is stored within the Interim Waste Containment Structure, approximately 9.6 mi (15.4 km) north of Niagara Falls, New York.[86] The Maximum Contaminant Level (MCL) for radium is 5pCi/L for drinking water, however, the OSHA doesn’t set a exposure limit, as there is a radiation limit already set up.[87]
See also
Notes
- ^ Both values are encountered in sources and there is no agreement among scientists as to the true value of the melting point of radium.[3]
References
- ^ «Radium». Royal Society of Chemistry. Archived from the original on 24 March 2016. Retrieved 5 July 2016.
- ^ a b Greenwood and Earnshaw, p. 112
- ^ a b c d e f Kirby et al., p. 4
- ^ a b c Radium. Encyclopædia Britannica
- ^ Lide, D. R. (2004). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0484-2.
- ^ Weigel, F.; Trinkl, A. (1968). «Zur Kristallchemie des Radiums». Radiochim. Acta. 10 (1–2): 78. doi:10.1524/ract.1968.10.12.78. S2CID 100313675.
- ^ a b Young, David A. (1991). «Radium». Phase Diagrams of the Elements. University of California Press. p. 85. ISBN 978-0-520-91148-2.
- ^ «Crystal Structures of the Chemical Elements at 1 bar» Archived 26 August 2014 at the Wayback Machine. uni-bielefeld.de.
- ^ a b c d Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b c d Salutsky, M.L. & Kirby, H.W. THE RADIOCHEMISTRY OF RADIUM, report, December 1, 1964; United States, University of North Texas Libraries, UNT Digital Library; crediting UNT Libraries Government Documents Department. Page 3.
- ^ Peppard, D. F.; Mason, G. W.; Gray, P. R.; Mech, J. F (1952). «Occurrence of the (4n + 1) series in nature». Journal of the American Chemical Society. 74 (23): 6081–6084. doi:10.1021/ja01143a074. Archived from the original on 28 July 2019. Retrieved 6 July 2019.
- ^ a b Ropp, R.C. (2013), «The Alkaline Earths as Metals», Encyclopedia of the Alkaline Earth Compounds, Elsevier, pp. 1–23, doi:10.1016/b978-0-444-59550-8.00001-6, ISBN 978-0-444-59550-8, retrieved 30 March 2021
- ^ Kuhn, W. (1929). «LXVIII. Scattering of thorium C» γ-radiation by radium G and ordinary lead». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 8 (52): 628. doi:10.1080/14786441108564923. ISSN 1941-5982.
- ^ a b c d e f g h Radium: Radiation Protection. United States Environmental Protection Agency
- ^ Soddy, Frederick (25 August 2004). The Interpretation of Radium. pp. 139–. ISBN 978-0-486-43877-1. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Malley, Marjorie C. (2011). Radioactivity. Oxford University Press. pp. 115–. ISBN 978-0-19-983178-4. Retrieved 27 June 2015.
- ^ Strutt, R. J. (7 September 2004). The Becquerel Rays and the Properties of Radium. pp. 133–. ISBN 978-0-486-43875-7. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ «First observations of short-lived pear-shaped atomic nuclei – CERN». home.cern. Archived from the original on 12 June 2018. Retrieved 8 June 2018.
- ^ Gaffney, L. P.; Butler, P. A.; Scheck, M.; et al. (2013). «Studies of pear-shaped nuclei using accelerated radioactive beams». Nature. 497 (7448): 199–204. Bibcode:2013Natur.497..199G. doi:10.1038/nature12073. PMID 23657348. S2CID 4380776.
- ^ Thayer, John S. (2010), «Relativistic Effects and the Chemistry of the Heavier Main Group Elements», Relativistic Methods for Chemists, Challenges and Advances in Computational Chemistry and Physics, vol. 10, p. 81, doi:10.1007/978-1-4020-9975-5_2, ISBN 978-1-4020-9974-8
- ^ a b Greenwood and Earnshaw, p. 111
- ^ Kirby et al., p. 8
- ^ a b c d e f g Kirby et al., pp. 4–8
- ^ Kirby et al., pp. 8–9
- ^ Kirby et al., p. 12
- ^ a b c d e f Keller, Cornelius; Wolf, Walter; Shani, Jashovam. «Radionuclides, 2. Radioactive Elements and Artificial Radionuclides». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 97–98. doi:10.1002/14356007.o22_o15.
- ^ a b c d Greenwood and Earnshaw, pp. 109–110
- ^ «Radium» Archived 15 November 2012 at the Wayback Machine, Los Alamos National Laboratory. Retrieved 5 August 2009.
- ^ Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth’s Crust and in the Sea, in Lide, David R. (ed.), CRC Handbook of Chemistry and Physics, 85th Edition. CRC Press. Boca Raton, Florida (2005).
- ^ a b c Hammond, C. R. «Radium» in Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. ISBN 1-4398-5511-0.
- ^ Curie, Pierre; Curie, Marie & Bémont, Gustave (1898). «Sur une nouvelle substance fortement radio-active, contenue dans la pechblende (On a new, strongly radioactive substance contained in pitchblende)». Comptes Rendus. 127: 1215–1217. Archived from the original on 6 August 2009. Retrieved 1 August 2009.
- ^ Weeks, Mary Elvira (1933). «The discovery of the elements. XIX. The radioactive elements». Journal of Chemical Education. 10 (2): 79. Bibcode:1933JChEd..10…79W. doi:10.1021/ed010p79.
- ^ Ball, David W. (1985). «Elemental etymology: What’s in a name?». Journal of Chemical Education. 62 (9): 787–788. Bibcode:1985JChEd..62..787B. doi:10.1021/ed062p787.
- ^ Carvalho, Fernando P. (2011), «Marie Curie and the Discovery of Radium», The New Uranium Mining Boom, Springer Geology, pp. 3–13, doi:10.1007/978-3-642-22122-4_1, ISBN 978-3-642-22121-7
- ^ Weeks, Mary Elvira (1933). «The discovery of the elements. XIX. The radioactive elements». Journal of Chemical Education. 10 (2): 79. Bibcode:1933JChEd..10…79W. doi:10.1021/ed010p79.
- ^ Frank Moore Colby; Allen Leon Churchill (1911). New International Yearbook: A Compendium of the World’s Progress. Dodd, Mead and Co. pp. 152–.
- ^ Curie, Marie & Debierne, André (1910). «Sur le radium métallique» (On metallic radium)». Comptes Rendus (in French). 151: 523–525. Archived from the original on 20 July 2011. Retrieved 1 August 2009.
- ^ Ronneau, C.; Bitchaeva, O. (1997). Biotechnology for waste management and site restoration: Technological, educational, business, political aspects. Scientific Affairs Division, North Atlantic Treaty Organization. p. 206. ISBN 978-0-7923-4769-9. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Frame, Paul W. «How the Curie Came to Be». Archived from the original on 20 March 2012. Retrieved 30 April 2008.
- ^ a b Terrill, J. G. Jr.; Ingraham Sc, 2nd; Moeller, D. W. (1954). «Radium in the healing arts and in industry: Radiation exposure in the United States». Public Health Reports. 69 (3): 255–62. doi:10.2307/4588736. JSTOR 4588736. PMC 2024184. PMID 13134440.
- ^ Frame, Paul (1999). «Radioluminescent Paint». Museum of Radiation and Radioactivity. Oak Ridge Associated Universities. Archived from the original on 31 July 2014.
- ^ «Environmental history timeline – Radium Girls». 20 July 2012. Archived from the original on 2 September 2018. Retrieved 1 September 2018.
- ^ Rowland, R. E. (1995) Radium in humans: a review of U.S. studies Archived 9 November 2011 at the Wayback Machine. Argonne National Laboratory. p. 22
- ^ Tykva, Richard; Berg, Dieter (2004). Man-made and natural radioactivity in environmental pollution and radiochronology. Springer. p. 78. ISBN 978-1-4020-1860-2.
- ^ Lavrukhina, Avgusta Konstantinovna; Pozdnyakov, Aleksandr Aleksandrovich (1966). Аналитическая химия технеция, прометия, астатина и франция [Analytical Chemistry of Technetium, Promethium, Astatine, and Francium] (in Russian). Nauka. p. 118.
- ^ Nuclide safety data sheet: Hydrogen-3. ehso.emory.edu
- ^ Zerriffi, Hisham (January 1996). «Tritium: The environmental, health, budgetary, and strategic effects of the Department of Energy’s decision to produce tritium». Institute for Energy and Environmental Research. Archived from the original on 13 July 2010. Retrieved 15 September 2010.
- ^ a b c Emsley, John (2003). Nature’s building blocks: an A-Z guide to the elements. Oxford University Press. pp. 351–. ISBN 978-0-19-850340-8. Retrieved 27 June 2015.
- ^ Luminous Radium Paint Archived 4 March 2013 at the Wayback Machine. vintagewatchstraps.com
- ^ «French Web site featuring products (medicines, mineral water, even underwear) containing radium». Archived from the original on 15 March 2011. Retrieved 1 August 2009.
- ^ Cherbonnier, Alice (1 October 1997). «Nasal Radium Irradiation of Children Has Health Fallout». Baltimore Chronicle. Archived from the original on 28 September 2011. Retrieved 1 August 2009.
- ^ Hayter, Charles (2005). «The Politics of Radon Therapy in the 1930s». An Element of Hope: Radium and the Response to Cancer in Canada, 1900–1940. McGill-Queen’s Press. ISBN 978-0-7735-2869-7.
- ^ Harvie, David I. (1999). «The radium century». Endeavour. 23 (3): 100–5. doi:10.1016/S0160-9327(99)01201-6. PMID 10589294.
- ^ Hamilton, Vivien (2016). «The Secrets of Life: Historian Luis Campos resurrects radium’s role in early genetics research». Distillations. 2 (2): 44–45. Archived from the original on 23 March 2018. Retrieved 22 March 2018.
- ^ «The Four Founding Physicians». Archived from the original on 10 March 2015. Retrieved 10 April 2013.
- ^ Dastur, Adi E.; Tank, P. D. (2011). «Howard Atwood Kelly: much beyond the stitch». The Journal of Obstetrics and Gynecology of India. 60 (5): 392–394. doi:10.1007/s13224-010-0064-6. PMC 3394615.
- ^ a b Aronowitz, Jesse N.; Robison, Roger F. (2010). «Howard Kelly establishes gynecologic brachytherapy in the United States». Brachytherapy. 9 (2): 178–184. doi:10.1016/j.brachy.2009.10.001. PMID 20022564.
- ^ Rebecca Skloot (2 February 2010). The Immortal Life of Henrietta Lacks. Random House Digital, Inc. ISBN 978-0-307-58938-5. Archived from the original on 17 June 2013. Retrieved 8 April 2013.
- ^ a b Ceranski, Beate (2008). «Tauschwirtschaft, Reputationsökonomie, Bürokratie». NTM Zeitschrift für Geschichte der Wissenschaften, Technik und Medizin. 16 (4): 413–443. doi:10.1007/s00048-008-0308-z.
- ^ «Lateral Science» Archived 2 April 2015 at the Wayback Machine. lateralscience.blogspot.se. November 2012
- ^ Just, Evan; Swain, Philip W. & Kerr, William A. (1952). «Peacetíme Impact of Atomíc Energy». Financial Analysts Journal. 8 (1): 85–93. doi:10.2469/faj.v8.n1.85. JSTOR 40796935.
- ^ Kuebel, A. (1940). «Extraction of radium from Canadian pitchblende». Journal of Chemical Education. 17 (9): 417. Bibcode:1940JChEd..17..417K. doi:10.1021/ed017p417.
- ^ Emsley, John (2011). Nature’s building blocks: an A-Z guide to the elements. Oxford University Press. p. 437. ISBN 9780199605637.
- ^ Viol, C. H. (1919). «Radium Production». Science. 49 (1262): 227–8. Bibcode:1919Sci….49..227V. doi:10.1126/science.49.1262.227. PMID 17809659.
- ^ Bouchiat, Marie-Anne; Bouchiat, Claude (28 November 1997). «Parity violation in atoms». Reports on Progress in Physics. 60 (11): 1351–1396. Bibcode:1997RPPh…60.1351B. doi:10.1088/0034-4885/60/11/004. S2CID 250910046 – via Institute of Physics.
- ^ Commins, Eugene D.; Jackson, J. D.; DeMille, David P. (10 May 2007). «The electric dipole moment of the electron: An intuitive explanation for the evasion of Schiff’s theorem». American Journal of Physics. 75 (6): 532–536. Bibcode:2007AmJPh..75..532C. doi:10.1119/1.2710486 – via aapt.scitation.org (Atypon).
- ^ Dobaczewski, J.; Engel, J. (13 June 2005). «Nuclear Time-Reversal Violation and the Schiff Moment of $^{225}mathrm{Ra}$». Physical Review Letters. 94 (23): 232502. arXiv:nucl-th/0503057. doi:10.1103/PhysRevLett.94.232502. PMID 16090465. S2CID 328830 – via APS.
- ^ Graner, B.; Chen, Y.; Lindahl, E. G.; Heckel, B. R. (18 April 2016). «Reduced Limit on the Permanent Electric Dipole Moment of $^{199}mathrm{Hg}$». Physical Review Letters. 116 (16): 161601. arXiv:1601.04339. doi:10.1103/PhysRevLett.116.161601. PMID 27152789. S2CID 2230011 – via APS.
- ^ Parker, R. H.; Dietrich, M. R.; Kalita, M. R.; Lemke, N. D.; Bailey, K. G.; Bishof, M.; Greene, J. P.; Holt, R. J.; Korsch, W.; Lu, Z.-T.; Mueller, P.; O’Connor, T. P.; Singh, J. T. (9 June 2015). «First Measurement of the Atomic Electric Dipole Moment of $^{225}mathrm{Ra}$». Physical Review Letters. 114 (23): 233002. arXiv:1504.07477. doi:10.1103/PhysRevLett.114.233002. PMID 26196797. S2CID 41982867 – via APS.
- ^ Nuñez Portela, M.; Dijck, E. A.; Mohanty, A.; Bekker, H.; van den Berg, J. E.; Giri, G. S.; Hoekstra, S.; Onderwater, C. J. G.; Schlesser, S.; Timmermans, R. G. E.; Versolato, O. O.; Willmann, L.; Wilschut, H. W.; Jungmann, K. (1 January 2014). «Ra+ ion trapping: toward an atomic parity violation measurement and an optical clock». Applied Physics B. 114 (1): 173–182. Bibcode:2014ApPhB.114..173N. doi:10.1007/s00340-013-5603-2. S2CID 119948902 – via Springer Link.
- ^ «Energy Levels of Singly Ionized Radium (Ra II)». physics.nist.gov.
- ^ Bieroń, J.; Indelicato, P.; Jönsson, P. (1 May 2007). «Multiconfiguration Dirac-Hartree-Fock calculations oftransition rates and lifetimes of the eight lowest excited levels of radium». The European Physical Journal Special Topics. 144 (1): 75–84. arXiv:physics/0701239. Bibcode:2007EPJST.144…75B. doi:10.1140/epjst/e2007-00110-3. S2CID 18380607 – via Springer Link.
- ^ Antypas, D.; Fabricant, A.; Stalnaker, J. E.; Tsigutkin, K.; Flambaum, V. V.; Budker, D. (28 February 2019). «Isotopic variation of parity violation in atomic ytterbium». Nature Physics. 15 (2): 120–123. arXiv:1804.05747. doi:10.1038/s41567-018-0312-8. S2CID 89612054 – via www.nature.com.
- ^ Committee On Radiation Source Use And Replacement, National Research Council (U.S.); Nuclear And Radiation Studies Board, National Research Council (U.S.) (January 2008). Radiation source use and replacement: Abbreviated version. p. 24. ISBN 978-0-309-11014-3. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Bentel, Gunilla Carleson (1996). Radiation therapy planning. p. 8. ISBN 978-0-07-005115-7. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ «Xofigo US Patent». Xofigo. Xofigo. Retrieved 28 September 2022.
- ^ «FDA OKs pinpoint prostate cancer radiation drug Xofigo from Bayer, Algeta». Archived from the original on 28 June 2013. Retrieved 1 October 2014.
- ^ «FDA Approves Xofigo for Advanced Prostate Cancer». cancer.org. (2013-05-15)
- ^ Maffioli, L.; Florimonte, L.; Costa, D. C.; Correia Castanheira, J.; Grana, C.; Luster, M.; Bodei, L.; Chinol, M. (2015). «New radiopharmaceutical agents for the treatment of castration-resistant prostate cancer». Q J Nucl Med Mol Imaging. 59 (4): 420–38. PMID 26222274.
- ^ Stoll, Wolfgang (2005). «Thorium and Thorium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. p. 717. doi:10.1002/14356007.a27_001. ISBN 978-3-527-31097-5.
- ^ l’Annunziata, Michael F. (2007). «Alpha particle induced nuclear reactions». Radioactivity: Introduction and history. Elsevier. pp. 260–261. ISBN 978-0-444-52715-8.
- ^ Holden, N. E.; Reciniello, R. N.; Hu, J. P.; Rorer, David C. (2004). «Radiation dosimetry of a graphite moderated radium-beryllium source» (PDF). Health Physics. 86 (5 Suppl): S110–2. Bibcode:2003rdtc.conf..484H. doi:10.1142/9789812705563_0060. PMID 15069300. Archived (PDF) from the original on 23 July 2018. Retrieved 25 October 2017.
- ^ Weisgall, Jonathan M. (1994). Operation crossroads: the atomic tests at Bikini Atoll. Naval Institute Press. p. 238. ISBN 978-1-55750-919-2. Retrieved 20 August 2011.
- ^ Fry, Shirley A. (1998). «Supplement: Madame Curie’s Discovery of Radium (1898): A Commemoration by Women in Radiation Sciences». Radiation Research. 150 (5): S21–S29. Bibcode:1998RadR..150S..21F. doi:10.2307/3579805. JSTOR 3579805. PMID 9806606.
- ^ Redniss, Lauren (2011). Radioactive: Marie & Pierre Curie: A Tale Of Love And Fallout. New York, NY: HarperCollins. p. 70. ISBN 978-0-06-135132-7.
- ^ Jenks, Andrew (July 2002). «Model City USA: The Environmental Cost of Victory in World War II and the Cold War». Environmental History. 12 (77): 552–577. doi:10.1093/envhis/12.3.552. (subscription required)
- ^ https://semspub.epa.gov/work/11/176334.pdf[bare URL PDF]
Bibliography
- Kirby, H. W.; Salutsky, Murrell L. (1964). The Radiochemistry of Radium (PDF). National Academies Press.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
Further reading
- Albert Stwertka (1998). Guide to the Elements – Revised Edition. Oxford University Press. ISBN 978-0-19-508083-4.
- Denise Grady (6 October 1998). «A Glow in the Dark, and a Lesson in Scientific Peril». The New York Times. Retrieved 25 December 2007.
- Nanny Fröman (1 December 1996). «Marie and Pierre Curie and the Discovery of Polonium and Radium». Nobel Foundation. Retrieved 25 December 2007.
- Macklis, R. M. (1993). «The great radium scandal». Scientific American. 269 (2): 94–99. Bibcode:1993SciAm.269b..94M. doi:10.1038/scientificamerican0893-94. PMID 8351514.
- Clark, Claudia (1987). Radium Girls: Women and Industrial Health Reform, 1910–1935. University of North Carolina Press. ISBN 978-0-8078-4640-7.
- Marie Curie (1921), The Discovery of Radium: Address by Madame M. Curie at Vassar College May 14, 1921 (1st ed.), Poughkeepsie: Vassar College, Wikidata Q22920166
External links
- «Lateral Science: The Discovery of Radium». 8 July 2012. Archived from the original on 9 March 2016. Retrieved 13 May 2017.
- Photos of Radium Water Bath in Oklahoma
- NLM Hazardous Substances Databank – Radium, Radioactive
- Annotated bibliography for radium from the Alsos Digital Library for Nuclear Issues Archived 25 June 2019 at the Wayback Machine
- Radium at The Periodic Table of Videos (University of Nottingham)
Радий – полезные свойства, особенности и угроза металла
По названию этого химического элемента названо явление радиоактивности. Радий – самый радиоактивный металл на планете. Однако ему нашли применение ученые, геологи и врачи.
Содержание
- Что представляет собой
- Как был открыт
- Физико-химические характеристики
- Нахождение в природе
- Технология получения
- Где используется
- «Философский камень»
- Промышленность
- Другие сферы
- Биологическое воздействие
Что представляет собой
Радий – это химический элемент таблицы Д.И. Менделеева №88.
Металл цвета серебра – продукт многоступенчатого распада урана-238:
- В темноте радий испускает голубоватый свет. По этой характеристике его легко отличить от других элементов.
- В честь него назван феномен радиоактивности.
Радиоактивность измеряется в кюри (Ки). 1 Ки – это 37 миллиардов распадов ежесекундно.
- Относится к щелочноземельным металлам.
- Структура кристаллической решетки – объемно-центрированный куб.
- Известно 35 природных и созданных изотопов элемента, все нестабильны. Самый устойчивый – 226 (период полураспада 1603 года). Некоторые «живут» доли секунды.
Международное обозначение и формула элемента – Radium (Ra).
Как был открыт
Открытие радия (1898 год) – заслуга Марии Кюри:
- Годами она работала с урановой смолкой. Это были отходы с местного предприятия. После извлечения урана они должны были быть «чистыми», но «фонили» сильнее чистого урана.
- Позднее к ней присоединился супруг Пьер и коллега Жан Бемон.
- Лишь через 12 лет была получена первая в истории «песчинка» чистого радия.
В тонне урановой смолки, которую перерабатывали супруги Кюри, было 0,1 г радия.
- Первые образцы стали самым дорогим веществом на планете: цена 1 г радия превосходила стоимость двух центнеров золота.
Попутно Мария открыла элемент, который назвала полонием – в честь своей родной страны Польши.
За открытие радия Марии Склодовской-Кюри присудили в 1911 году Нобелевскую премию.
В радии как металле с «подсветкой» видели неисчерпаемый источник тепла и света. Однако вскоре обнаружилась смертельная опасность радиации для биологических структур.
Название восходит к латинскому radius – луч. Так радиоактивный элемент назвали за постоянную светимость.
Ра – верховный бог Солнца у древних египтян.
Физико-химические характеристики
Химические свойства этого щелочноземельного металла сходны с барием, но проявляются интенсивнее:
- Реакция с водой сопровождается образованием водорода.
- На воздухе радий тускнеет, покрываясь оксидно-нитридным слоем.
- Образует самые прочные (из щелочноземельных металлов) соединения с органическими кислотами.
Главное свойство вещества – радиоактивность:
- Радий беспрерывно продуцирует теплоту. Без «отдушины» нагревается до расплавления.
- Радий испаряется: все изотопы (кроме 228-го) становятся радоном. Газ радиоактивен.
- Радий, продукты его распада испускают лучи всех видов: альфа-, бета-, гамма-.
Благодаря радиоактивности радий, его соединения отсвечивают в темноте.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ра́дий / Radium (Ra), 88 |
| Атомная масса (молярная масса) |
226,0254 а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 7s2 |
| Химические свойства | |
| Радиус иона | (+2e) 143 пм |
| Электроотрицательность | 0,9 (шкала Полинга) |
| Электродный потенциал | Ra←Ra2+ −2,916 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) |
1-й 509,3 (5,2785) кДж/моль (эВ) 2-й 979,0 (10,147) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (при к.т.) 5,5 г/см³ |
| Температура плавления | 1233 K |
| Температура кипения | 2010 K |
| Уд. теплота плавления | 8,5 кДж/моль |
| Уд. теплота испарения | 113 кДж/моль |
| Молярная теплоёмкость | 29,3 Дж/(K·моль) |
| Молярный объём | 45,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,148 |
| Прочие характеристики | |
| Теплопроводность | (300 K) (18,6) Вт/(м·К) |
| Номер CAS | 7440-14-4 |
Нахождение в природе
Радий – рассеянный элемент, микроконцентрации обнаружены в различных объектах.
Элемент распределен по биосфере неравномерно:
- Главный источник металла – урановая руда.
- Радий всегда содержат руды тория.
- Вымываясь оттуда, попадает в воду, нефтяные, газоносные пласты. Найден во вторичных минералах свинца.
Тонна урана из урановой руды содержит 0,34 г радия. Тонна земной коры – 1 мкг.
За более чем 120 лет – со времени открытия – на Земле удалось получить полтора кг вещества.
Все природные изотопы радия сведены в таблицу:
| Изотоп | Историческое название | Семейство | Период полураспада | Тип распада | Дочерний изотоп (историческое название) |
|---|---|---|---|---|---|
| Радий-223 | актиний Х (AcX) | ряд урана-235 | 11,435 дня | α | радон-219 (актинон, An) |
| Радий-224 | торий Х (ThX) | ряд тория-232 | 3,66 дня | α | радон-220 (торон, Tn) |
| Радий-226 | радий (Ra) | ряд урана-238 | 1602 года | α | радон-222 (радон, Rn) |
| Радий-228 | мезоторий I (MsTh1) | ряд тория-232 | 5,75 года | β | актиний-228 (мезоторий II, MsTh2) |
Технология получения
- Радий выделяют из урановой руды, получение металла базируется на электролизе. Рабочим материалом выступают растворенный хлорид радия и ртуть как катод.
- Второй способ получения – из природных вод, которые выщелачивают радий из минералов с ураном в составе.
Производство относится к вредным: требуются специальные средства защиты, соблюдение правил техники безопасности.
Где используется
Использовать новое вещество начали сразу. Супруги Кюри не запатентовали продукт, считая его всеобщим достоянием. Предприимчивые граждане воспользовались этим.
«Философский камень»
Рынок Европы и Америки заполонила чудодейственная продукция: «молодильные» кремы, пудры, зубные пасты. Мошенники изготавливали также хлеб, печенье, шоколадки, «лечебную» воду, средство для повышения потенции.
Бум продержался двадцать лет, пока не была доказана опасность увлечения веществом.
Промышленность
Радий был микрокомпонентом светящейся краски. Ею снабжали циферблаты армейских компасов, часов, авиационных, морских приборов. В 1970-х радий заменили менее агрессивным тритием.
Сферы применения единичны:
- В сплаве с бериллием – производитель альфа-частиц в радиево-бериллиевых накопителях нейтронов.
- Светящиеся составы (с сульфидом цинка).
- Маркер качества литья, сварных швов.
- Нейтрализация электростатических зарядов.
Применение вещества ограничивается главным недостатком – радиоактивностью.
Другие сферы
- Геологи применяют радиевые изотопы для определения возраста минералов, осадочных пород.
- Для геохимиков это индикатор движения океанской воды и концентрации урана.
- Ювелиры облучают радием драгоценные камни для улучшения цвета.
- Для медицины радий – источник газа радона (его добавляют в лечебные ванны). Кратковременное облучение радием – метод борьбы с онкологией.
Биологическое воздействие
Радий проникает в живые организмы:
- В растительном мире его больше в стволах деревьев.
- Организм животных и человека получает его с водой, пищей.
- Четыре пятых поступившего радия оседает в костях.
- Концентрация вещества определяется пищевым рационом и районом проживания.
По стандартам РФ, кубический метр воздуха не должен содержать более 0,000001 мкг радия.
Нанодозы вещества полезны, превышение чревато онкологией. Поэтому критически важно видеть барьер, после которого достоинства материала становятся недостатками.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Автор статьи
Мне 36 и я специалист в области минералогии. Сейчас я в декрете и всё свободное время посвящаю самоцветам. В этом блоге я делюсь информацией про камни и их свойства — присоединяйтесь, задавайте вопросы и пишите комментарии!
| Радий | |
|---|---|
| Серебристo-белый металл | |
 |
|
| Название, символ, номер | Радий / Radium (Ra), 88 |
| Атомная масса (молярная масса) |
226,0254 а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 7s2 |
| Радиус иона | (+2e) 143 пм |
| Электроотрицательность | 0,9 (шкала Полинга) |
| Электродный потенциал | Ra←Ra2+ −2,916 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) |
1-й 509,3 (5,2785) кДж/моль (эВ) 2-й 979,0 (10,147) кДж/моль (эВ) |
| Плотность (при н. у.) | (при к.т.) 5,5 г/см³ |
| Температура плавления | 1233 K |
| Температура кипения | 2010 K |
| Уд. теплота плавления | 8,5 кДж/моль |
| Уд. теплота испарения | 113 кДж/моль |
| Молярная теплоёмкость | 29,3 Дж/(K·моль) |
| Молярный объём | 45,0 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,148 |
| Теплопроводность | (300 K) (18,6) Вт/(м·К) |
| Номер CAS | 7440-14-4 |
Радий — элемент 2-й группы (по устаревшей классификации — главной подгруппы второй группы), седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium). Простое вещество радий — блестящий металл серебристо-белого цвета, быстро тускнеющий на воздухе. Относится к щёлочноземельным металлам, обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226Ra (период полураспада около 1600 лет).
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические и химические свойства
- 6 Применение
- 7 Биологическая роль
- 8 Изотопы
История
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран. Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий. Первое сообщение об открытии радия (в виде смеси с барием) Кюри сделали 26 декабря 1898 года во Французской академии наук. В 1910 году Мария Кюри и Андре Дебьерн выделили чистый радий путём электролиза хлорида радия на ртутном катоде и последующей дистилляции в водороде. Выделенный элемент представлял собой, как сейчас известно, изотоп радий-226, продукт распада урана-238. За открытие радия и полония супруги Кюри получили Нобелевскую премию. Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде.
В России радий впервые был получен в экспериментах известного советского радиохимика В. Г. Хлопина. В 1918 году на базе Государственного рентгеновского института было организовано Радиевое отделение, которое в 1922 году получило статус отдельного научного института. Одной из задач Радиевого института были исследования радиоактивных элементов, в первую очередь — радия. Директором нового института стал В. И. Вернадский, его заместителем — В. Г. Хлопин, физический отдел института возглавил Л. В. Мысовский.
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т. д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
| Изотоп | |
| Эманация радия | 222Rn |
| Радий A | 218Po |
| Радий B | 214Pb |
| Радий C | 214Bi |
| Радий C1 | 214Po |
| Радий C2 | 210Tl |
| Радий D | 210Pb |
| Радий E | 210Bi |
| Радий F | 210Po |
Названная в честь супругов Кюри внесистемная единица активности радиоактивного источника «кюри» (Ки), равная 3,7⋅1010 распадов в секунду, или 37 ГБк, ранее была основана на активности 1 грамма радия-226. Но так как в результате уточнённых измерений было установлено, что активность 1 г радия-226 примерно на 1,3 % меньше, чем 1 Ки, в настоящее время эта единица определяется как 37 миллиардов распадов в секунду (точно).
Происхождение названия
Название «радий» связано с излучением ядер атомов Ra (лат. radius — луч).
Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,1 г радия-226. Весь природный радий является радиогенным — возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468⋅109 лет)/(1602 года)=2,789⋅106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия; кларковое число радия (содержание в земной коре) составляет ~1 мкг/т.
Все природные изотопы радия сведены в таблицу:
| Изотоп | Историческое название | Семейство | Период полураспада | Тип распада | Дочерний изотоп (историческое название) |
|---|---|---|---|---|---|
| Радий-223 | актиний Х (AcX) | ряд урана-235 | 11,435 дня | α | радон-219 (актинон, An) |
| Радий-224 | торий Х (ThX) | ряд тория-232 | 3,66 дня | α | радон-220 (торон, Tn) |
| Радий-226 | радий (Ra) | ряд урана-238 | 1602 года | α | радон-222 (радон, Rn) |
| Радий-228 | мезоторий I (MsTh1) | ряд тория-232 | 5,75 года | β | актиний-228 (мезоторий II, MsTh2) |
Геохимия радия во многом определяется особенностями миграции и концентрации урана, а также химическими свойствами самого радия — активного щёлочноземельного металла. Среди процессов, способствующих концентрированию радия, следует указать в первую очередь на формирование на небольших глубинах геохимических барьеров, в которых концентрируется радий. Такими барьерами могут быть, например, сульфатные барьеры в зоне окисления. Поднимающиеся снизу хлоридные сероводородные радийсодержащие воды в зоне окисления становятся сульфатными, сульфат радия соосаждается с BaSO4 и CaSO4, где он становится практически нерастворимым постоянным источником радона. Из-за высокой миграционной способности урана и способности его к концентрированию формируются многие типы урановых рудообразований в гидротермах, углях, битумах, углистых сланцах, песчаниках, торфяниках, фосфоритах, бурых железняках, глинах с костными остатками рыб (литофациями). При сжигании углей зола и шлаки обогащаются 226Ra. Также содержание радия повышено в фосфатных породах.
В результате распада урана и тория и выщелачивания из вмещающих пород в нефти постоянно образуются радионуклиды радия. В статическом состоянии нефть находится в природных ловушках, обмена радием между нефтью и подпирающими её водами нет (кроме зоны контакта вода—нефть) и в результате имеется избыток радия в нефти. При разработке месторождения пластовые и закачиваемые воды интенсивно поступают в нефтяные пласты, поверхность раздела вода—нефть резко увеличивается, и в результате радий уходит в поток фильтрующихся вод. При повышенном содержании сульфат-ионов растворенные в воде радий и барий осаждаются в виде радиобарита Ba(Ra)SO4, который выпадает на поверхности труб, арматуры, резервуаров. Типичная объёмная активность поступающей на поверхность водонефтяной смеси по 226Rа и 228Rа может быть порядка 10 Бк/л (соответствует жидким радиоактивным отходам).
Основная масса радия находится в рассеянном состоянии в горных породах. Радий — химический аналог щелочных и щёлочноземельных породообразующих элементов, из которых состоят полевые шпаты, составляющие половину массы земной коры. Калиевые полевые шпаты — главные породообразующие минералы кислых магматических пород — гранитов, сиенитов, гранодиоритов и др. Известно, что граниты обладают природной радиоактивностью несколько выше фоновой из-за содержащегося в них урана. Хотя кларк урана не превышает 3 г/т, но в гранитах его содержание составляет уже 25 г/т. Но если гораздо более распространённый химический аналог радия барий входит в состав довольно редких калий-бариевых полевых шпатов (гиалофанов), а «чистый» бариевый полевой шпат, минерал цельзиан BaAl2Si2O8 очень редок, то накопления радия с образованием радиевых полевых шпатов и минералов вообще не происходит из-за короткого периода полураспада радия. Радий распадается на радон, уносящийся по порам и микротрещинкам и вымывающийся с грунтовыми водами. В природе иногда встречаются молодые радиевые минералы, не содержащие уран, например, радиобарит и радиокальцит, при кристаллизации которых из растворов, обогащённых радием (в непосредственной близости от легкорастворимых вторичных урановых минералов), радий сокристаллизуется с барием и кальцием благодаря изоморфизму.
Получение
Получить чистый радий в начале XX века стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало XX века в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Обычно радий добывается из урановых руд. В рудах, достаточно старых для установления векового радиоактивного равновесия в ряду урана-238, на тонну урана приходится 333 миллиграмма радия-226.
Существует также способ добычи радия из радиоактивных природных вод, выщелачивающих радий из урансодержащих минералов. Содержание радия в них может доходить до 7,5×10−9 г/г. Так, на месте нынешнего поселка Водный Ухтинского района Республики Коми с 1931 по 1956 год действовало единственное в мире предприятие, где радий выделяли из подземных минерализованных вод Ухтинского месторождения, так называемый «Водный промысел».
Из анализа документов, сохранившихся в архиве правопреемника этого завода (ОАО Ухтинский электрокерамический завод «Прогресс»), было подсчитано, что до закрытия на «Водном промысле» было выпущено примерно 271 г радия. В 1954 году мировой запас добытого радия оценивался в 2,5 кг. Таким образом, к началу 1950-х годов примерно каждый десятый грамм радия был получен на «Водном промысле».
Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — +2. Гидроксид радия Ra(OH)2 — сильное, коррозионное основание.
Ввиду сильной радиоактивности все соединения радия светятся голубоватым светом (радиохемилюминесценция), что хорошо заметно в темноте, а в водных растворах его солей происходит радиолиз.
Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны:
- 9Be + 24α → 12C + 1n
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут), 192Ir (T1/2 = 74 сут), 198Au (T1/2 = 2,7 сут) и т. д.
Отопление радием: камин 21 века. Французская карточка 1910 года
До 1970-х годов радий часто использовался для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных и морских приборов, специальных часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года). Иногда часы с радиевым светосоставом выпускались и в гражданском исполнении, в том числе наручные. Также радиевую светомассу в быту можно встретить в некоторых старых ёлочных игрушках, тумблерах с подсветкой кончика рычажка, на шкалах некоторых старых радиоприёмников и прочее. Характерный признак светосостава постоянного действия советского производства — краска горчично-жёлтого цвета, хотя иногда цвет бывает и другим (белым, зеленоватым, тёмно-оранжевым и прочее). Опасность таких приборов состоит в том, что они не содержали предупреждающей маркировки, выявить их можно только дозиметрами. Также люминофор с годами деградирует и краска к нашему времени зачастую перестаёт светиться, что, разумеется, не делает её менее опасной, так как радий никуда не девается. Ещё одна опасная особенность радиевой светомассы в том, что со временем краска деградирует и может начать осыпаться, и пылинка такой краски, попавшая внутрь организма с едой или при вдохе, способна причинить большой вред за счёт альфа-излучения.
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
В начале XX века радий даже считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средства для повышения тонуса и потенции.
Изотопы
Основная статья: Изотопы радия
Известны 35 изотопов радия в диапазоне массовых чисел от 201 до 235. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов урана-238, урана-235 и тория-232. Остальные изотопы могут быть получены искусственным путём. Большинство известных изотопов радия претерпевают альфа-распад в изотопы радона с массовым числом, на 4 меньшим, чем у материнского ядра. Нейтронодефицитные изотопы радия имеют также дополнительный канал бета-распада с эмиссией позитрона или захватом орбитального электрона; при этом образуется изотоп франция с тем же массовым числом, что и у материнского ядра. У нейтронно-избыточных изотопов радия (диапазон массовых чисел от 227 до 235) обнаружен только бета-минус-распад; он происходит с образованием ядер актиния с тем же массовым числом, что и у материнского ядра. Некоторые изотопы радия (221Ra, 222Ra, 223Ra, 224Ra, 226Ra) вблизи линии бета-стабильности обнаруживают, помимо альфа-распада, кластерную активность с испусканием ядра углерода-14 и образованием ядра свинца с массовым числом, на 14 меньшим, чем у материнского ядра (например, 222Ra → 208Pb+14C), хотя вероятность этого процесса составляет лишь 10−8…10−10% относительно альфа-распада. Радиоактивные свойства некоторых изотопов радия:
| Массовое число | Период полураспада | Тип распада |
|---|---|---|
| 213 | 2,73(5) мин. | α (80±3%) |
| 219 | 10(3) мс | α |
| 220 | 17,9(14) мс | α |
| 221 | 28(2) с | α |
| 222 | 33,6(4) с | α |
| 223 (AcX) | 11,4377(22) суток | α |
| 224 (ThX) | 3,6319(23) суток | α |
| 225 | 14,9(2) суток | β− |
| 226 | 1600(7) лет | α |
| 227 | 42,2(5) мин. | β− |
| 228 (MsTh1) | 5,75(3) года | β− |
| 230 | 93(2) мин. | β− |
- Продукты с радием
-
Репродукции продуктов, содержащих радий, выпускавшихся в начале XX века, на витрине в Музее Марии Кюри, Париж.
-
Надпись на баночке: «Пудра ТО-РАДИЙ на основе радия и тория по формуле Альфреда Кюри…»
|
Соединения радия |
|---|
|
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
| Ра́дий / Radium (Ra) | |
|---|---|
| Атомный номер | 88 |
| Внешний вид простого вещества | Радий Флюоресцирующий в зеленой области спектра металл |
| Свойства атома | |
| Атомная масса (молярная масса) |
226,0254 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) |
1-й 509,3 кДж/моль 2й 979,0 кДж/моль (эВ) |
| Электронная конфигурация | [Rn] 7s² |
| Химические свойства | |
| Ковалентный радиус | n/a пм |
| Радиус иона | (+2e) 143 пм |
| Электроотрицательность (по Полингу) |
0,9 |
| Электродный потенциал | Ra←Ra2+ −2,916В |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | (при к.т.) 5,5 г/см³ |
| Удельная теплоёмкость | 0,120 Дж/(K·моль) |
| Теплопроводность | (18,6) Вт/(м·K) |
| Температура плавления | 973 K |
| Теплота плавления | 8,5 кДж/моль |
| Температура кипения | 2010 K |
| Теплота испарения | 113 кДж/моль |
| Молярный объём | 45,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Период решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
Ра́дий (лат. Radium), химический элемент II группы периодической системы, относится к щёлочноземельным металлам. Радиоактивен; наиболее устойчивый изотоп 226Ra (период полураспада около 1600 лет).
История
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран. Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий. Первое сообщение об открытии радия (в виде смеси с барием) Кюри сделали 26 декабря 1898 года во Французской Академии наук. В 1902 Кюри и Андре Дебьерн выделили чистый радий путём электролиза хлорида радия на ртутном катоде и последующей дистилляции в водороде. Выделенный элемент представлял собой, как сейчас известно, изотоп радий-226, продукт распада урана-238. За открытие радия и полония супруги Кюри получили Нобелевскую премию.Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде.
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т. д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
| Изотоп | |
| Эманация радия | 222Rn |
| Радий A | 218Po |
| Радий B | 214Pb |
| Радий C | 214Bi |
| Радий C1 | 214Po |
| Радий C2 | 210Tl |
| Радий D | 210Pb |
| Радий E | 210Bi |
| Радий F | 210Po |
Названная в честь Кюри внесистемная единица радиоактивности кюри основана на активности 1 г радия-226: 3,7×1010 распадов в секунду, или 37 ГБк.
Происхождение названия
Название «радий» связано с излучением ядер атомов Ra (лат. radius — луч).
Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226. Весь природный радий возникает при распаде урана-238, урана-235 или тория-232; наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468×109 лет)/(1602 года)=2,789×106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия.
Получение
Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый метал, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — 2.
Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны: 9Be + 4He => 12C + 1n.
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут), 192Ir (T1/2 = 74 сут), 198Au (T1/2 = 2,7 сут) и т. д.
Ранее радий часто использовался для приготовления светящихся красок постоянного свечения (для разметки циферблатов часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года).
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
Изотопы
Известны 13 изотопов радия. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов. Остальные изотопы могут быть получены искусственным путём. Радиоактивные свойства некоторых изотопов радия:
| Массовое число | Период полураспада | Тип распада |
|---|---|---|
| 213 | 2.7 мин | α |
| 219 | 10-3 сек | α |
| 220 | 0.023 | α (99%) |
| 221 | 30 (28) сек | α |
| 222 | 38 (37) сек | α |
| 223 (AcX) | 11.4 дня | α |
| 224 (ThX) | 3.64 дня | α |
| 225 | 14.8 дня | β |
| 226 | 1590, 1602, 1622, 1617 лет | α |
| 227 | 41.2 мин | β |
| 228 (MsTh1) | 6.7 лет | β |
| 230 | 1 час | β |
Ссылки
| Радий на Викискладе? |
- Радий на Webelements
- Радий в Популярной библиотеке химических элементов
|
п·о·р Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na | Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tс, Mn, Te, Rh, Po, Tl, Hg, Ag, Pb, Pd, Os, Ir, Pt, Au |
| → активность металлов → |
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Радий. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
РАДИЙ – радиоактивный химический элемент II группы периодической системы, аналог бария; относится к щелочноземельным элементам. Стабильных изотопов не имеет; наиболее долгоживущие – 226Ra (период полураспада t1/2 = 1600 лет) и 228Ra (t1/2 = 5,75 года). Остальные изотопы (всего их известно 25) «живут» значительно меньше, некоторые – доли секунды; почти все они получены искусственно.
Радий в природе и его свойства.
Несмотря на сравнительно малое время жизни по сравнению с возрастом Земли (около пяти миллиардов лет), некоторые изотопы радия, хотя и в очень малых количествах, встречаются в природе. Происходит это благодаря существованию в природе трех радиоактивных рядов, в которых изотопы радия непрерывно образуются при распаде долгоживущих (так называемых материнских) радионуклидов: урана-238 (из него получается 226Ra), урана-235 (он дает 223Ra, t1/2 = 11,4 суток) и тория-232 (дает 228Ra и 224Ra, t1/2 = 3,7 суток). Очевидно, что чем меньше период полураспада данного радионуклида, тем меньше его содержание в минералах, даже самый долгоживущий, 226Ra, содержится в земной коре в количестве всего одной десятимиллиардной доли процента, обычно в тех же породах, в которых содержится уран.
Чистый радий – блестящий серебристо-белый металл, быстро тускнеющий на воздухе из-за образования на его поверхности оксида и нитрида. С водой реагирует более энергично, чем барий, выделяя водород. Плавится радий при 969° С, кипит при 1507° С, плотность – около 6 г/см3. Любые физические и химические свойства радия изучать трудно из-за его очень высокой радиоактивности. Радий непрерывно выделяет теплоту, и если нет условий для теплоотвода, металл быстро нагревается и может даже расплавиться. Продукт распада радия – радиоактивный газ радон. Радий вместе с продуктами своего распада излучает все три вида радиации – a-, b- и g-лучи. Из-за высокой радиоактивности радий и его соединения светятся в темноте, его бесцветные соли быстро желтеют, а затем приобретают коричневую, вплоть до черной, окраску; их водные растворы разлагают воду, выделяя из нее водород и кислород.
Если не считать сильной радиоактивности, химические свойства радия и его соединений мало отличаются от аналогичных свойств бария. Как и у бария, легко растворимы хлорид, бромид, иодид, нитрат радия, а фторид, карбонат и сульфат почти нерастворимы. Гидроксид Ra(OH)2 – сильная щелочь.
В поисках новых радиоактивных элементов.
Радий неотделим от имени открывших его супругов Кюри, которые посвятили его поискам, выделению и изучению свойств многие годы. Открытые в 1896 А.Беккерелем «урановые лучи» заинтересовали многих ученых, среди них были французский физик Пьер Кюри и его жена Мария Склодовская-Кюри.
Если Беккереля в основном волновали свойства «урановых лучей» и источник их энергии, то Кюри, будучи скорее химиком, задалась вопросом, является ли уран уникальным в этом отношении и нет ли других элементов с подобными свойствами Нужно было научиться точно измерять степень радиации. Сейчас такой вопрос решается просто с помощью приборов, например, счетчиков Гейгера, но они появились только в 1908, а фотопластинки были слишком грубым инструментом и требовали много времени для экспозиции и последующего проявления. Скорость опадания золотых листочков электроскопа тоже зависела от многих невоспроизводимых факторов. П.Кюри сконструировал электрометр, позволяющий точно измерять очень малые токи, измеряемые триллионными долями ампера – пикоамперами (пА). В приборе использовался открытый им вместе с братом Жаком пьезоэлектрический эффект – появление на гранях некоторых кристаллов при их сдавливании электрических зарядов (этот эффект используется, например, в кварцевых часах, в пьезозажигалках). Точно дозируя давление на кристалл, можно было компенсировать и, таким образом, измерять очень малые токи. Конструкция состояла из двух расположенных горизонтально с небольшим зазором металлических дисков, на которые подавалось напряжение около 100 В. Если между дисками находился только слой воздуха, тока не было, но если на нижний диск насыпали тонким слоем определенное количество какого-либо соединения урана, воздух благодаря ионизации под действием «урановых лучей» становился проводником, при этом между дисками протекал очень слабый ток, который можно было измерить и таким образом количественно и довольно точно определить мощность излучения.
Используя этот метод, Кюри начала тестировать одно вещество за другим – все, которые она только могла достать, одолжить в химических лабораториях, выпросить в минералогических музеях (она не только аккуратно возвратила образцы владельцам, но и выразила им благодарность в своей публикации). Из всех веществ, не содержащих уран, активность проявили только соединения тория.
Аналогичными исследованиями занимались и другие ученые. Одновременно и независимо от нее радиоактивность тория обнаружил немецкий физик Герхард Карл Шмидт (1865–1949). Это неудивительно: торий и уран были последними, самыми тяжелыми, элементами в таблице Менделеева тех времен, поэтому от них можно было ждать всяких неожиданностей. Об этом написал в последнем прижизненном издании (1906) своего учебника Основы химии и сам Менделеев: «Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже a priori должна влечь за собою выдающиеся особенности».
Неожиданными оказались количественные результаты измерений. Так, взятый у Муассана металлический уран (он был получен восстановлением оксида углем и содержал примесь углерода) дал ток 23–24 пА; природный монацит (смешанный фосфат редких земель и тория) – 5 пА; чрезвычайно редкий минерал самарскит (смесь оксидов редкоземельных элементов, U, Fe, Nb, Ta и Ti) – 11 пА; черный торит ThSiO4 (обычно содержит примесь урана) – 14 пА, а прозрачные оранжевые кристаллы оранжита (невыветренный силикат тория) – 20 пА; черный оксид урана U2O5 – 27 пА; урановая смоляная руда (урановая смолка) из разных источников (она образует минералы уранинит или настуран примерного состава UO2) – от 16 до 83 пА; желтый минерал отенит Ca(UO2)2(PO4)2·(10–12)H2O – 27 пА; редкий природный минерал хальколит (торбернит) красивого зеленого цвета Cu(UO2)2(PO4)2·(8–12)H2O – 52 пА; желтый минерал карнотит K2(UO2)2V2O8·3H2O – 62 пА.
Результаты не соответствовали содержанию в минералах известных радиоактивных элементов – урана и тория. Так, хальколит, в котором масса урана составляет лишь около 50%, оказался вдвое активнее, чем чистый уран, синтезированный собственноручно М.Кюри искусственный хальколит (двойной фосфат меди – уранила) показал небольшую активность, которая приблизительно соответствовала содержанию в этой соли урана. Стало ясно, что в природных минералах, которые проявили наибольшую активность, содержится, помимо урана, какой-то другой, неизвестный элемент. «Активность этих минералов не представляла бы ничего удивительного, – записала Мария в лабораторном журнале, – если бы была пропорциональна количеству содержащегося в них урана или тория. Но это было не так. Некоторые из этих минералов проявили активность в три или четыре раза большую, чем надлежало по расчету для урана. Я тщательно проверила этот поразительный факт и не могла больше сомневаться в его правильности… Аномальная активность хальколита, обусловлена не его химическим составом; минерал, конечно, содержит в слабой пропорции элемент более активный, чем уран…». Не последнюю роль, возможно, сыграла и «подсказка» самого Беккереля: когда-то в беседе с Пьером Кюри он высказал предположение о том, что обнаруженная им радиоактивность урана может быть связана с какими-то очень активными примесями в этом элементе.
Все известные элементы были уже изучены и не обладали нужным свойством. Химический анализ радиоактивных минералов соответствовал их формуле, это означало, что нового элемента в этих минералах исключительно мало, поэтому этот элемент (возможно, не он один) быть очень активным! Как только стало ясно, что в урановых и ториевых рудах содержится неизвестное вещество с очень высокой радиоактивностью, началась работа по его выделению. Завершилась она выдающимся открытием новых химических элементов – полония и радия.
Впоследствии Кюри писала по этому поводу: «Я назвала радиоактивностью способность испускать такие лучи и создала новый термин, принятый с тех пор в науке». На латыни radius – палочка, спица в колесе, а также радиус круга и луч; radiare – испускать лучи, сиять; в английском слово radiant (излучающий) появилось еще в 15 в., т.е. термин, введенный Кюри, должен был означать самопроизвольное («активное») излучение некоторыми веществами.
Стало ясно, что в урановой смолке присутствует неизвестный радиоактивный элемент (или несколько элементов). Тщательный химический анализ этого вещества привел в 1898 к открытию нового радиоактивного элемента – полония.
В первом исследовании урановой смолки супруги Кюри упустили важное обстоятельство. Оказалось, что если из азотнокислого раствора осадить сульфат бария (потом его перевели в растворимый хлорид), он обнаруживает радиоактивность. Стало очевидным, что это еще один радиоактивный элемент – на этот раз аналог не висмута, а бария. Для того чтобы сконцентрировать этот элемент, был использован метод многократной перекристаллизации – тот самый, с помощью которого были разделены очень близкие по свойствам редкоземельные элементы. В данном случае он был основан на разной растворимости солей бария и радия. Так, в 100 г воды при 20° С растворяется 35,7 г хлорида бария, а хлорида радия – почти в два раза меньше, поэтому если из раствора выделить в осадок 1/3 хлорида бария, то хлорида радия выделится 2/3. По этому методу (он называется фракционной кристаллизацией) раствор хлоридов частично выпаривают до образования кристаллов, в которых доля радия выше, чем в растворе. Эти кристаллы снова растворяют и повторяют все сначала. Таким образом, доля радия в выпадающих кристаллах постепенно растет. Раствор, обедненный радием, не выбрасывают, а подвергают дробной кристаллизации. Кроме бария и радия (и урана) исходный минерал содержал довольно много свинца, кремния, тантала, протактиния, железа, тория, актиния, полония, и все эти элементы следовало предварительно отделить от бария (с ничтожной примесью радия). Этот метод требует очень большого числа операций, но другого способа выделить новый элемент не было. На каждой стадии соответствующую фракцию с помощью электрометра проверяли на радиоактивность и таким образом контролировали степень обогащения.
Постепенно супруги Кюри (с помощью Бемона) получили препарат бария, который был в 60 раз активнее, чем чистый уран, после еще нескольких перекристаллизаций – уже в 900 раз более активный, Но опыты пришлось прекратить: последняя, самая активная, фракция была такой маленькой, что дальше работать с ней было уже невозможно – для выделения нового элемента нужны были не граммы, и даже не килограммы руды, а тонны.
26 декабря 1898 была опубликована статья Мосье Пьера Кюри, мадам П. Кюри и мосье Г.Бемона, О новом сильно радиоактивном веществе, содержащемся в урановой смолке, в которой сообщалось, что был исследован спектр обогащенного препарата, который был в 60 раз активнее урана, и в нем обнаружена едва заметная новая линия в ультрафиолетовой области (длина волны 381 нм), эта же линия была отчетливо видна в последнем образце, в 900 раз более активном, чем уран. Интенсивность спектральной полосы была пропорциональна радиоактивности препаратов, что служило хорошим доводом приписать ее новому радиоактивному элементу. Его решили назвать радием. Попытки определить атомную массу нового элемента (без этого химики не признали бы его за новый элемент, а не радиоактивный изотоп бария) дали значение, почти не отличающееся от бария. Вывод в статье был однозначным: «В новом веществе все еще очень велико содержание бария. Поэтому радиоактивность радия должна быть огромной».
С этой радиоактивностью не все было в порядке. Так, 13 июля 1899 П.Кюри отметил в лабораторном журнале непонятный факт – препарат сульфата радия, активность которого в начале года составляла от 150 до 200 единиц, в середине июля показывал уже 600. На той же странице – аналогичная запись М.Кюри – карбонат радия с активностью 1200 вдруг через полгода показал активность 3000. Объяснить это супруги не могли, лишь впоследствии из работ Резерфорда стало известно, что из радия образуются другие короткоживущие радиоактивные элементы, так что только a-активность радия должна примерно через три недели увеличиться вчетверо. Но при одном условии: препарат должен находиться в закрытом сосуде, так как первый продукт превращения радия – газообразный радон.
Определение атомной массы даже самого активного препарата давало значение, мало отличающееся от атомной массы бария (137). Это означало, что концентрация радия в урановой смолке очень мала. Значит, для выделения нового элемента нужно будет переработать очень много дорогого минерала, которого у них в нужном количестве не было, и сколько его потребуется, не знал никто. В статье от 26 декабря было примечание, в котором говорилось, что «профессор Венского университета мосье Зюсс любезно согласился уговорить австрийское правительство выслать в Париж 100 кг отходов от переработки урановой смолки на шахтах Иоахимсталя».
Как выяснилось, и 100 кг было мало. Урановую смолку добывали в Богемии (латинизированное название Чехии), вблизи знаменитых шахт Иоахимсталя (ныне – город в Чехии Яхимов). Урановую руду сплавляли с содой при доступе воздуха. Плав обрабатывали сначала водой – уран при этом переходил в раствор в виде карбонатного комплекса, затем разбавленной серной кислотой – получался сульфатный комплекс урана. Соединения урана использовали для производства дорогого богемского уранового стекла и глазури по фарфору. Остаток руды после извлечения урана, который содержал весь радий, выбрасывали, и постепенно скопились целые горы отходов, которые сваливали в ближайшем сосновом лесу. Супруги Кюри в конечном счете получили не 100 кг, а более 10 тонн.
Сейчас на стене Парижской Высшей школы физики и химии укреплена памятная доска с надписью: «В 1898 году в лаборатории этой Школы Пьер и Мария Кюри, при помощи Густава Бемона, открыли радий».
Выделение радия.
Работа предстояла огромная – химическая переработка (вручную) многих тонн материала; она заняла четыре года. Вначале остатки кипятили с большим избытком концентрированного раствора соды – при этом содержащиеся в них не растворимые ни в воде, ни в кислотах сульфаты бария и радия (и частично кальция) переходили в карбонаты: Ba(Ra)SO4 + Na2CO3 ® Ba(Ra)CO3 + Na2SO4. Раствор Na2SO4 сливали, а осадок карбонатов бария и радия уже легко растворялся в разбавленной соляной кислоте: Ba(Ra)CO3 + 2HCl ® Ba(Ra)Cl2 + CO2 + H2O. Раствор отфильтровывали от примесей и добавлением серной кислоты из него снова выделяли сульфаты кальция, бария и радия – их получалось от 10 до 20 кг из тонны исходного вещества. Затем весь цикл повторяли, пока не получались чистые соли бария и радия (примерно 8 кг из тонны), отделенные от более растворимого кальция. Использовали и другие химические приемы, необходимые для отделения радия от следов других радиоактивных элементов. Так, свинец, висмут и сопровождающий его полоний осаждали сероводородом в виде нерастворимых сульфидов. Актиний осаждался вместе с железом, алюминием и редкоземельными элементами с помощью раствора аммиака. Затем методом дробной кристаллизации выделяли все более чистую соль радия. По мере увеличения доли радия выпадающие вначале бесцветные кристаллы со временем под действием собственного излучения желтели, затем становились оранжевыми или розовыми, а после растворения снова дали бесцветный раствор.
Сама Кюри много лет спустя призналась, что не уверена, проявила ли бы она такую настойчивость, если бы знала, как мало радия содержится в руде и какая титаническая работа предстоит для получения хотя бы мизерного его количества. Для работы директор Школы выделил им старый сарай с застекленной крышей, где раньше была прозекторская. По подсчетам австрийского физика Стефана Мейера (1872–1950) М.Кюри пришлось переработать вручную свыше 11 тонн отходов, неудивительно, что к вечеру она буквально падала от усталости. Тем не менее, впоследствии она признавалась, что именно в этом сарае провела свои лучшие и счастливейшие годы.
Затем появились помощники и работа пошла быстрее.Весной 1902, после переработки тонны урановых отходов, масса радия (в виде RaCl2) достигла 0,1 г. Позднее подсчитали, что тонна урановой смолки теоретически содержит 0,17 г радия в виде хлорида. Таким образом, потери оказались сравнительно невелики, если учесть колоссальный объем работы в неподходящих условиях и исключительно малое содержание радия в руде: 34 миллионные доли процента. Это и позволило В.Маяковскому написать известные строчки:
Поэзия –
та же добыча радия.
В грамм добыча,
в год труды.
Изводишь,
единого слова ради,
Тысячи тонн
словесной руды.
Чистота препарата была подтверждена Демарсе с помощью спектрального анализа. Полученного вещества было достаточно, чтобы определить атомную массу радия традиционным методом: точную навеску RaCl2 растворяли, осаждали нитратом серебра нерастворимый AgCl, который высушивали и взвешивали. Получилось 225 – именно это значение стояло на месте предполагаемого, еще не открытого элемента в таблице, помещенной Менделеевым в первом издании своего учебника Основы химии.
После переработки восьми тонн у М.Кюри был уже целый грамм радия. Активность нового элемента оказалась в миллион (!) раз выше, чем у урана. Под действием его излучения светились алмазы, а бумага и хлопчатобумажная ткань разрушались, на коже появлялись ожоги, а потом язвы. Необычные свойства нового элемента требовали все больших его количеств. К концу 1903 Кюри имели уже 10 тонн отходов из 20, зарезервированных для них при содействии Венской академии наук. Возросли и расходы на доставку – их оплатил банкир Эдмонд Ротшильд. Исходного сырья стало так много, что обработать его в сарае было уже невозможно. Пьер Кюри организовал первоначальную обработку отходов на химическом заводе в Ножан-на-Марне – небольшом городке к востоку от Парижа. На нем использовали несколько упрощенную методику Марии Кюри, а дробную кристаллизацию осуществляли не с хлоридами, а с бромидами бария и радия (для них коэффициент разделения оказался выше). Промышленную добычу радия консультировали супруги Кюри и их друг и коллега французский физикохимик Андре Луи Дебьерн (1874–1949), который в 1899 открыл в урановой смолке еще один радиоактивный элемент – актиний. Финансовую помощь пришла из нескольких источников (среди них были и анонимные). Французская академия наук предоставила грант в 20 000 франков (около 4000 долл.). Когда в других странах также начались работы по добыче радия, супруги Кюри могли заработать намного больше, чем получили за Нобелевскую премию. Однако они отказались взять патент на свое открытие, хотя цена радия уже достигла 750 тыс. франков за грамм. Кюри безвозмездно снабжала своим радием всех ученых, которые хотели изучать это замечательное вещество. Супруги Кюри убедили Беккереля вернуться к исследованию радиоактивности нового элемента. Он доказал, что сильно отклоняемые магнитным полем b-лучи идентичны «катодным лучам», т.е. представляют собой быстро летящие электроны.
По мере увеличения количества добытого радия стало возможным более подробно исследовать его свойства, а также свойства его соединений. Оказалось, что под влиянием собственного излучения как сами бесцветные соединения радия, так и стеклянные сосуды, в которых они хранятся, со временем темнеют. Все соединения радия в темноте испускают голубоватое свечение (светятся возбужденные атомы азота).
Пьер и Мария Кюри обнаружили потемнение стекла под влиянием излучения радия (сейчас стекла для очков тонируются тоже с помощью радиации). Немецкий физик Ф.О.Гизель обнаружил, что лучи радия окрашивают и природные кристаллы каменной соли (NaCl) и плавикового шпата (CaF2). Он же показал, что RaBr2 окрашивает пламя в карминовый цвет (как стронций), а в спектре радия есть линии в красной, сине-зеленой и фиолетовой областях спектра.
В 1904 Пьер Кюри в Королевском институте в Лондоне продемонстрировал, как писали английские ученые, «поразительный эксперимент». Ему помогал английский физик и химик Джеймс Дьюар (1842–1923), который в 1898 впервые получил большое количество жидкого водорода и изобрел «сосуды Дьюара» для хранения сжиженных газов (в быту их называют «термосами»). Эксперимент показывал, что излучение радия и выделяемая им теплота не меняются при охлаждении до температуры жидкого воздуха (около –190° С) и даже жидкого водорода (–252,8° С). Измерения показали, что сам радий (за счет a-излучения) выделяет в час более 105 Дж/г, а радий вместе с продуктами его распада – почти 590 Дж/ч, причем на долю a-частиц приходится около 89%, на долю b-частиц – 4,5%, остальное дает g-излучение.
В 1910 М.Кюри и Дебьерн впервые получили металлический радий. Они использовали метод, примененный ранее для выделения бария. Для этого водный раствор RaCl2 был подвергнут электролизу с ртутным катодом и платино-иридиевым анодом. Образовавшуюся на катоде амальгаму радия нагревали в потоке водорода, постепенно повышая температуру до 700° С (почти до плавления радия), чтобы отогнать ртуть (она кипит при 357° С).
На Международном конгрессе по радиоактивности и электричеству, собравшемся в Брюсселе в 1910, М.Кюри была поручена подготовка международного эталона радия; он был нужен в качестве стандарта радиоактивности. Несмотря на заметное ухудшение здоровья (помимо переутомления, начала сказываться лучевая болезнь, о которой в то время ничего не знали и потому не предпринимали никаких мер безопасности), Мария приготовила эталон в течение одного месяца. В последующие годы на основании этого эталона были изготовлены многочисленные вторичные эталоны, которые были переданы в Австрию, Германию, Англию, Францию, США, Канаду, Швецию, Японию, Португалию, Данию, Бельгию, Чехословакию, Венгрию, СССР, Австралию Конгресс, свидетельству английских физиков, дал название единице радиоактивности «кюри» в честь Марии Кюри. Однако сама Мария писала, что «конгресс пожелал дать этой единице название кюри, чтобы почтить память Пьера Кюри и его труды в области радиоактивности».
В ноябре 1911 года впервые Нобелевская премия была вручена повторно. Как было отмечено в протокольном решении Шведской академии наук, премия по химии присуждалась «Марии Склодовской-Кюри в знак признания ее вклада в развитие химии, который она внесла открытием радия и полония, определением свойств радия и выделением радия в металлической форме, и, наконец, за ее эксперименты с этим элементом».
«Радиевый бум».
Отказ супругов Кюри на извлечение материальных выгод из своего открытия открыл дорогу к получению и применению радия для ученых всех стран. Начали выходить специальные журналы, посвященные радию и радиоактивности. В 1913 осуществилась мечта Пьера Кюри – в Париже был организован Институт радия. Руководителем одной из двух его лабораторий была Мария Кюри. В том же году был основан Национальный институт радия в США. Еще раньше, в 1910, Институт радия открылся в Вене, его директором был назначен Стефан Мейер. В 1913 лаборатория по радиоактивности открылась в Варшаве. В 1932 при активной помощи сестры Марии Брониславы был создан варшавский Институт радия (ныне – Онкологический институт имени Марии Склодовской-Кюри). В 1922 Радиевый институт был основан в Петрограде; его директором стал В.И.Вернадский (1863–1945). За год до этого в нашей стране первые препараты радия из отечественной ферганской руды получили радиохимик Виталий Григорьевич Хлопин (в будущем – академик и директор Института) и физикохимик и металлург Иван Яковлевич Башилов (1892–1953), предложивший технологию извлечения радия, урана и ванадия (эти элементы содержатся в минерале карнотите).
Когда выяснилась возможность использования радия в медицине, в мире развернулась настоящая «радиевая лихорадка». На всех континентах интенсивно велся поиск и добыча радиоактивных урановых руд, из которых радий добывали в основном по методу М.Кюри.
Цена на радий начала стремительно расти и вскоре значительно превысила стоимость алмазов (в середине 1910-х – почти 180 тыс. долл. за грамм). При тогдашней цене золота (35 долл. за унцию) 1 г радия стоил столько же, сколько 160 кг золота.
Резкое подорожание радия в начале века было связано также с тем, что в конце 1903 австрийское правительство наложило эмбарго на вывоз из Иоахимсталя как самой урановой руды, так и остатков от ее переработки и вскоре само построило там завод по добыче радия. К 1910 на нем получили уже 13 граммов радия, и до 1922 этот завод оставался европейским лидером по производству радия. Огромная цена радия стимулировала поиск его руд и добычу на всех континентах. В 1920–1930-е один за другим открывались новые предприятия по переработке урановых руд и добыче радия – как на своем сырье, так и на привозном. Завод в Ножане, организованный еще Пьером Кюри, работал на разнообразном сырье: урановую смолку ввозили из Венгрии, Швеции, Канады и Колорадо, отенит добывался в самой Франции, а также привозился из Португалии, хальколит – из Богемии, карнотит – из Португалии и Юты (США), а торианит (содержащий уран ThO2) – даже из Цейлона. Добывали торианит и в Японии. В Лондоне перерабатывали руду, добываемую на шахтах юго-западной оконечности Англии (полуостров Корнуолл), часть этой руды перевозили также на переработку во Францию. На заводе близ Стокгольма радий добывали из собственных урансодержащих сланцев и урановой смолки из Норвегии (которая в 1905 стала независимой). В Австралии радий получали из руд, найденных в южных пустынях…
Россия включилась в гонку в 1910, переработку вела частная компания в Фергане, хотя руда оказалась довольно бедной. Во время войны работа прекратилась, но после революции был построен уже государственный завод на Каме, а в 1931 – еще один в Москве. Есть и позорные страницы в отечественной истории радия. Еще в 1930-е малограмотный горнорабочий И.Г.Прохоров начал рассказывать и писать в высокие партийные инстанции о своей мифической встрече в 1914 в Восточной Сибири с Марией Кюри, которая якобы лично подтвердила наличие богатых радиево-урановых месторождений в Минусинском уезде Енисейской губернии. Этот рассказ (вошедший даже в серьезные научные сборники) впоследствии был использован органами госбезопасности СССР для массовых репрессий против советских геологов в 1949 под предлогом сокрытия ими радиево-урановых месторождений.
С 1913 по 1922 основным поставщиком радия на мировой рынок были США. Радий там добывался в штате Колорадо, а его извлечением занималось несколько компаний, лидером была «Стандард Кемикл», которая извлекала радий из карнотитовых руд. Пик добычи пришелся на 1921 – 35 г радия, всего же с 1913 по 1923 США получили 196 г радия. Теперь уже уран выбрасывался как ненужный балласт или продавался за бесценок: основной целью был радий.
Но вскоре радиевая промышленность США пришла в упадок: с 1921 начали разрабатываться месторождения в Бельгийском Конго (провинция Катанга), и в 1922 в Бельгии заработал завод близ Антверпена. Африканская руда оказалась очень богатой: она содержала в среднем 50% оксида урана, и если для получения 1 грамма радия в США надо было переработать 300–400 тонн карнотитовой руды, то заводу в Бельгии для того же требовалось всего 10 тонн. С 1922 по 1933 там было выделено 326 г радия. Пик добычи пришелся на конец 1920-х – 60 г радия в год. Но и бельгийцам пришлось сократить производство ввиду сильной конкуренции со стороны Канады. Руду там добывали с 1932 на побережье Большого Медвежьего озера, добыча радия в 1938 достигла 75 г. Данные за последующие годы были засекречены, так как отражали добычу нового стратегического сырья – урана, известно только, что производство радия в Канаде продолжалось до 1954, а в Бельгии – до 1960. С 1930-х весь рынок радия был под контролем бельгийских и канадских компаний. В небольшом количестве радий производили также в Англии, Франции, СССР. В Чехословакии его добывали (в Яхимове) вплоть до 1937.
Общее количество добытого радия увеличивалось быстрыми темпами. Если к 1916 во всем мире было получено 48 г радия, то через 10 лет его было уже 340 г. Постепенное накопление мировых запасов радия, который практически не расходуется (за 10 лет его количество уменьшается за счет распада менее чем на 0,5%), привело к быстрому снижению цены более чем вдвое к началу 1920-х, а затем еще в несколько раз в последующие десятилетия.
Тем не менее, радий оставался очень дорогим элементом. В настоящее время радия накоплено около 3 кг, и больше его практически не добывают. Более того, при переработке урановых руд радий считается вредным побочным продуктом, требующим безопасного захоронения!
Применение радия.
В течение многих десятилетий радий применялся в основном в медицинских целях и лишь в очень малых количествах – для научных исследований. Излучением радия лечили прежде всего злокачественные опухоли, для этого использовали содержащие радий иголки, трубочки или пластинки; их накладывали на больное место или же хирургическим путем вводили на некоторое время прямо в опухоль. Когда цена радия снизилась, в некоторых больницах стали использовать «радиевые пушки» с дистанционным облучением пациентов, они содержали несколько граммов радия. Конечно, не обошлось и без шарлатанов, которые предлагали «чудодейственный радий» от всех недугов – начиная с психических заболеваний и кончая бессонницей. Дошло до продажи «радиевых удобрений», якобы повышающих урожай. В результате некоторые поля в США, Канаде и Франции были «удобрены» радиоактивными веществами.
Широко применялся радий и для получения светящихся составов; с этой целью соли радия смешивали с подходящим люминофором (см. ЛЮМИНЕСЦЕНЦИЯ. СВЕЧЕНИЕ ВЕЩЕСТВ). Такие составы наносили на стрелки часов и компасов, на шкалы военных приборов и даже на предметы быта, не подозревая об опасности. В таких покрытиях обычно использовали сульфид цинка, содержащий от 0,0025 до 0,03% радия. Использовали также способность радия ионизировать воздух и таким образом снимать статический заряд, предотвращая возможность воспламенения горючих паров. В 1930-х в США производились даже ткани из искусственного шелка «с радием», который снимал статическое электричество и предотвращал их слипание. Все это прекратилось, когда стала широко известна опасность радиоактивного облучения и лучевой болезни, более того, после взрыва первых ядерных бомб всеобщее увлечение «радием» и радиацией сменилось прямо противоположной и тоже не всегда обоснованной радиофобией.
Сейчас радий находит лишь ограниченное применение и для этого его накопленных запасов более чем достаточно. В медицине радий иногда используют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта. Радий используют и как источник радона для приготовления радоновых ванн. Радий можно использовать и в компактных источниках нейтронов, для этого небольшие его количества помещают в ампулу вместе с бериллием, под действием альфа-излучения (ядер гелия) из бериллия выбиваются нейтроны: 9Be + 4He ® 12C + 1n. Однако сейчас есть множество более дешевых радионуклидов с нужными свойствами, которые получают на ускорителях или ядерных реакторах, например, 60Co (с периодом полураспада t1/2 = 5,3 года), 137Cs (t1/2 = 30,2 года), 182Ta (t1/2 = 115 сут), 192Ir (t1/2 = 74 сут), 198Au (t1/2 = 2,7 сут). В приборах постоянного свечения радий также заменяют теперь тритием (t1/2 = 12,3 года) или 147Pm (t1/2 = 2,6 года).
Радий сильно токсичен; допустимая его концентрация в воздухе исчезающе мала – не более 10 мг/км3 или 10–11 г/м3. При такой концентрации в 1 м3 происходит чуть больше двух распадов атомов радия в секунду. Работа с радием и его препаратами, как и с другими радиоактивными веществами, требует строгого соблюдения защитных мер.
Илья Леенсон
| Радий | |
|---|---|
| Атомный номер | 88 |
| Внешний вид простого вещества | Флюоресцирующий в зеленой области спектра металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
226,0254 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1-й 509,3 кДж/моль 2й 979,0 кДж/моль (эВ) |
| Электронная конфигурация | [Rn] 7s2 |
| Химические свойства | |
| Ковалентный радиус | n/a пм |
| Радиус иона | (+2e) 143 пм |
|
Электроотрицательность (по Полингу) |
0,9 |
| Электродный потенциал | Ra←Ra2+ −2,916В |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | (при к.т.) 5,5 г/см³ |
| Молярная теплоёмкость | 29,3 Дж/(K·моль) |
| Теплопроводность | (18,6) Вт/(м·K) |
| Температура плавления | 973 K |
| Теплота плавления | 8,5 кДж/моль |
| Температура кипения | 2010 K |
| Теплота испарения | 113 кДж/моль |
| Молярный объём | 45,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
Радий — элемент главной подгруппы второй группы, седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (Radium). Простое вещество радий (CAS-номер: 7440-14-4) — блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчивый изотоп 226Ra (период полураспада около 1600 лет).
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран. Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий. Первое сообщение об открытии радия (в виде смеси с барием) Кюри сделали 26 декабря 1898 года во Французской Академии наук. В 1902 Кюри и Андре Дебьерн выделили чистый радий путём электролиза хлорида радия на ртутном катоде и последующей дистилляции в водороде. Выделенный элемент представлял собой, как сейчас известно, изотоп радий-226, продукт распада урана-238. За открытие радия и полония супруги Кюри получили Нобелевскую премию. Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде.
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т. д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
| Изотоп | |
| Эманация радия | 222Rn |
| Радий A | 218Po |
| Радий B | 214Pb |
| Радий C | 214Bi |
| Радий C1 | 214Po |
| Радий C2 | 210Tl |
| Радий D | 210Pb |
| Радий E | 210Bi |
| Радий F | 210Po |
Названная в честь Кюри внесистемная единица радиоактивности кюри основана на активности 1 г радия-226: 3,7×1010 распадов в секунду, или 37 ГБк.
Происхождение названия
Название «радий» связано с излучением ядер атомов Ra (radius — луч).
Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226. Весь природный радий возникает при распаде урана-238, урана-235 или тория-232; наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468×109 лет)/(1602 года)=2,789×106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия.
Получение
Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — 2.
Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны: 9Be + 4He → 12C + 1n.
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут.), 192Ir (T1/2 = 74 сут.), 198Au (T1/2 = 2,7 сут.) и т. д.
Ранее радий часто использовался для приготовления светящихся красок постоянного свечения (для разметки циферблатов часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года).
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
Изотопы
Известны 25 изотопов радия. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов. Остальные изотопы могут быть получены искусственным путём. Радиоактивные свойства некоторых изотопов радия.
| Массовое число | Период полураспада | Тип распада |
|---|---|---|
| 213 | 2,74(6) мин. | α |
| 219 | 10(3) мс | α |
| 220 | 17,9(14) мс | α (99%) |
| 221 | 28(2) с | α |
| 222 | 38,0(5) с | α |
| 223 (AcX) | 11,43(5) дня | α |
| 224 (ThX) | 3,6319(23) дня | α |
| 225 | 14,9(2) дня | β |
| 226 | 1602(7) лет | α |
| 227 | 42,2(5) мин. | β |
| 228 (MsTh1) | 5,75(3) года | β |
| 230 | 93(2) мин. | β |
Радий
Радий Свойства атома Химические свойства Термодинамические свойства простого вещества Кристаллическая решётка простого вещества
| Атомный номер | 88 |
| Внешний вид простого вещества | Флюоресцирующий в зеленой области спектра металл |
| Атомная масса (молярная масса) | 226,0254 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 1-й 509,3 кДж/моль 2й 979,0 кДж/моль (эВ) |
| Электронная конфигурация | [Rn] 7s2 |
| Ковалентный радиус | n/a пм |
| Радиус иона | (+2e) 143 пм |
| Электроотрицательность (по Полингу) | 0,9 |
| Электродный потенциал | Ra←Ra2+ −2,916В |
| Степени окисления | 2 |
| Плотность | (при к.т.) 5,5 г/см³ |
| Молярная теплоёмкость | 29,3 Дж/(K·моль) |
| Теплопроводность | (18,6) Вт/(м·K) |
| Температура плавления | 973 K |
| Теплота плавления | 8,5 кДж/моль |
| Температура кипения | 2010 K |
| Теплота испарения | 113 кДж/моль |
| Молярный объём | 45,0 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
Радий — элемент главной подгруппы второй группы, седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (Radium). Простое вещество радий (CAS-номер: 7440-14-4) — блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчивый изотоп 226Ra (период полураспада около 1600 лет).
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран.
Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий. Первое сообщение об открытии радия (в виде смеси с барием) Кюри сделали 26 декабря 1898 года во Французской Академии наук.
В 1902 Кюри и Андре Дебьерн выделили чистый радий путём электролиза хлорида радия на ртутном катоде и последующей дистилляции в водороде. Выделенный элемент представлял собой, как сейчас известно, изотоп радий-226, продукт распада урана-238. За открытие радия и полония супруги Кюри получили Нобелевскую премию.
[attention type=yellow]
Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде.
[/attention]
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т. д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
| Изотоп | |
| Эманация радия | 222Rn |
| Радий A | 218Po |
| Радий B | 214Pb |
| Радий C | 214Bi |
| Радий C1 | 214Po |
| Радий C2 | 210Tl |
| Радий D | 210Pb |
| Радий E | 210Bi |
| Радий F | 210Po |
Названная в честь Кюри внесистемная единица радиоактивности кюри основана на активности 1 г радия-226: 3,7×1010 распадов в секунду, или 37 ГБк.
Происхождение названия
Название «радий» связано с излучением ядер атомов Ra (radius — луч).
Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226.
Весь природный радий возникает при распаде урана-238, урана-235 или тория-232; наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238.
В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468×109 лет)/(1602 года)=2,789×106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия.
Получение
Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия.
Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в.
в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — 2.
Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны: 9Be + 4He → 12C + 1n.
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут.), 192Ir (T1/2 = 74 сут.), 198Au (T1/2 = 2,7 сут.) и т. д.
Ранее радий часто использовался для приготовления светящихся красок постоянного свечения (для разметки циферблатов часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года).
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
Изотопы
Известны 25 изотопов радия. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов. Остальные изотопы могут быть получены искусственным путём. Радиоактивные свойства некоторых изотопов радия.
Массовое число Период полураспада Тип распада
| 213 | 2,74(6) мин. | α |
| 219 | 10(3) мс | α |
| 220 | 17,9(14) мс | α (99%) |
| 221 | 28(2) с | α |
| 222 | 38,0(5) с | α |
| 223 (AcX) | 11,43(5) дня | α |
| 224 (ThX) | 3,6319(23) дня | α |
| 225 | 14,9(2) дня | β |
| 226 | 1602(7) лет | α |
| 227 | 42,2(5) мин. | β |
| 228 (MsTh1) | 5,75(3) года | β |
| 230 | 93(2) мин. | β |
№88 Радий
Мария Кюри
(1867 — 1934)
Первооткрыватель радия и полония (Википедия)
В конце 19 века во Франции А. Беккерель и супруги Пьер и Мария Кюри предположили, что в урановой руде кроме урана содержатся и другие радиоактивные элементы. В 1898 г работа супругов Кюри по извлечению привела к открытию двух элементов полония и радия. Чистый металлический радий был получен в 1910-м году.
За работы по изучению радиоактивности супруги Кюри в 1903 получили Нобелевскую премию по физике, а М. Кюри в 1911 — Нобелевскую премию по химии. В России первый препарат радия был получен в 1921 В.Г. Хлопиным и И.Я. Башиловым.
Название «радий» связано с излучением ядер атомов Ra (от латинского radius — луч).
Получение:
радия в земной коре 1·10-10% по массе. Радионуклиды Ra входят в состав природных радиоактивных рядов урана-238, урана-235 и тория-232 и постоянно образуются при их распаде.
Период полураспада наиболее устойчивого изотопа, радия-226 составляет 1600 лет, кроме него в природе существует еще несколько изотопов, с периодом полураспада от нескольких дней до нескольких лет: 223Ra, 224Ra, 228Ra. В ничтожных концентрациях радий может присутствовать в природных водах.
Радий выделяют из отходов переработки урановых руд осаждением, дробной перекристаллизацией. Металлический радий получают электролизом раствора RaCl2 с использованием ртутного катода.
Физические свойства:
Радий — серебристо-белый металл, светится в темноте. Кристаллическая решетка металлического радия кубическая. Температура плавления — 969°C, температура кипения — 1507°C, плотность — 5,5-6,0 г/см3.
Ядра Ra-226 испускают альфа-частицы с энергией 4,777МэВ и гамма-кванты с энергией 0,188 МэВ. За счет этого 1 г Ra выделяет 550 Дж/ч теплоты и металл быстро нагревается.
В процессе распада радия образуется радиоактивный газ радон:
226Ra = 222Rn + 4He.
Химические свойства:
По химическим свойствам радий похож на барий, но более активен. На воздухе покрывается пленкой, состоящей из оксида, гидроксида, карбоната и нитрида радия.
При сгорании его на воздухе или в кислороде образуется смесь оксида RaO и пероксида RaO2. Энергично взаимодействует с галогенами, при нагревании реагирует с водородом.
Радий бурно реагирует с водой, образуя сильное основание: Ra + 2H2O = Ra(OH)2 + H2
Он также легко реагирует с кислотами.
Важнейшие соединения:
Оксид радия, RaO — основной оксид, твердое вещество, энергично взаимодействует с водой, образуя гидроксид Ra(OH)2.
Гидроксид радия, Ra(OH)2 — белое кристаллическое вещество, мало растворимо в воде. Сильное основание.
Соли радия. Большинство солей радия хорошо растворимо в воде.
Растворы содержат бесцветные ионы Ra2+, которые сообщают жидкости горький вкус. Вследствие высокой радиоактивности в растворах солей радия идет постепенное разложение воды на водород и кислород («радиолиз»).
Галоидные соли радия расплываются на воздухе и легкорастворимы в воде, выделяются из растворов в виде кристаллогидратов (напр. RaCl2*6H2O).
При их нагревании происходит отщепление части галоидоводородной кислоты и образуются труднорастворимые в воде основные соли.
Исключением является RaF2, растворимость которого весьма мала (0,08 г/л). Малорастворимы также сульфат и карбонат радия.
Гидрид радия, RaH2 Сильный восстановитель, при нагревании плавится и разлагается, реагирует с водой, кислотами. Окисляется на воздухе.
Применение:
Соли радия используются в медицине как источник радона для приготовления радоновых ванн.
Соединения радия использовались как инициирующая добавка для приготовления постоянно светящихся составов (циферблаты приборов).
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения радия протекает ядерная реакция: 9Be + 4He = 12C + 1n.Радий сильно токсичен. Около 80% поступившего в организм радия накапливается в костной ткани.
Большие концентрации радия вызывают остеопороз, самопроизвольные переломы, злокачественные опухоли костей и кроветворной ткани.
А. Агафонова
ХФ ТюмГУ, 581 группа, 2011 г.
Источники:
Радий. Википедия, свободная энциклопедия. http://ru.wikipedia.org/Радий.
Онлайн Энциклопедия Кругосвет. Радий. http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/RADI.html.
С.И. Венецкий О редких и рассеянных. Рассказы о металлах. «В грамм добыча, в год труды» (радий)
Что такое Радий
Радий — Радиоактивный химический элемент, серебристо-белый металл.
Значение слова Радий по Ожегову:
Радий — Химический элемент — металл, обладающий радиоактивными свойствами
Радий в Энциклопедическом словаре:
Радий — (лат. Radium) — Ra, химический элемент II группы периодическойсистемы, атомный номер 88, атомная масса 226,0254, относится кщелочно-земельным металлам. Радиоактивен. наиболее устойчивый изотоп 226Ra(период полураспада 1600 лет). Название от лат. radius — луч.Серебристо-белый блестящий металл.
плотность 5,5-6,0 г/см3, tпл 969 .С.Химически очень активен. В природе встречается в урановых рудах.Исторически первый элемент, радиоактивные свойства которого нашлипрактическое применение в медицине и технике. Изотоп 226Ra в смеси сбериллием идет на приготовление простейших лабораторных источниковнейтронов.
Значение слова Радий по словарю Ушакова:
РАДИЙ
радия, мн. нет, м. (от латин. radius — луч) (хим., физ.). Химический элемент, металл, обладающий способностью излучать тепловую и лучистую энергию, распадаясь при этом в последовательный ряд простых веществ. Лечение радием.
Значение слова Радий по словарю Брокгауза и Ефрона:
Радий — химический элемент, принадлежащий ко второй группе периодической системы и открытый г-жой Кюри при исследовании урановой смоляной руды (см. Эманация). По своим химическим свойствам радий является аналогом бария, соответственно своему атомному весу (225) занимая в периодической системе место под ним в 12-м ряду.
Для выделения радия из смоляной руды сернокислые соли стронция, бария и радия переводятся кипячением с содой в углекислые, а затем растворяются, всего лучше в бромистоводородной кислоте. При фракционированной кристаллизации бромистых солей радий скопляется в первых фракциях, так как он труднее растворяется, чем бромистый барий.
Этим путем Гизелю впервые удалось получить свободный от бария бромистый радий, при помощи 9 последовательных кристаллизаций. Чистая соль фосфоресцирует голубоватым светом и при внесении в пламя бунзеновской горелки вызывает карминово-красное окрашивание.
Спектр радия содержит две интенсивные полосы в красно-желтой части, яркую линию в голубой и две нерезких в фиолетовой (длина воли главнейших линий 4825, 896. 3649,712. 3814,661. 4682,149). Радиоактивность радия приблизительно в 1000000 больше, чем урана, и потому почти все работы, относящиеся к изучению свойств и действий лучей, производились и производятся именно с радиевыми препаратами.
К сожалению, урановая смоляная руда до сих пор является почти единственным источником радия, хотя и в ней он составляет менее 1/1000000 по весу. Поэтому цена на радий все повышается, и ныне 1 мгр. стоит около 400 франков. Ни на одном элементе не изучен так хорошо радиоактивный процесс — ход распада атома, как на радии (см. Радиоактивность).
Тела, подобного UrX или ThX, радий не образует, так что первым продуктом здесь является инертный газ с темп. сжижения около — 150° — эманация (см. это слово). В свою очередь, эманация образует твердый продукт — вторичную радиоактивность, оседающую на стенках сосуда с эманацией или на отрицательно заряженной металлической пластинке или проволоке, подвергающейся действию эманации.
Подобно ториевой, эта вторичная активность представляет собой растворимое в кислотах и улетучивающееся при накаливании твердое тело, частицы которого заряжены положительным электричеством и, подобно ториевой, она оказалась смесью нескольких продуктов последовательного разложения атома.
Тщательное изучение кривых потери силы металлических пластинок, активированных эманацией радия, показало, что мы имеем здесь дело с тремя продуктами: эманация образует RaA, который, разлагаясь (со скоростью половины в 3 минуты), образует RaB. последний продукт переходит в RaC, причем превращение половины количества RaB требует 26,7 минут. RaC разлагается дальше, выделяя α.
-, β. — и γ. — лучи, причем половина его превращается в 19 минут. Продукты дальнейшего превращения радия исследованы Резерфордом, который определил еще три ступени (RaD, RaE и RaF). эти тела характеризуются медленностью разложения и, вследствие того, значительно большей продолжительностью существования.
Если активированную радием пластинку оставить на 24 часа, то RaA, RaB и RaC разлагаются совершенно, но активность не исчезает окончательно, и пройдя через минимум, начинает снова возрастать. При этом β.-лучи растут быстро, в 40 дней достигая некоторой максимальной величины (половина ее достигается в 6 дней), а затем остаются постоянными.
Этот процесс, совершенно напоминая образование UrX из урана, указывает, что и после исчезновения RaC на пластинке остается еще новый продукт (RaD), который и дает, в свою очередь, тело (RaE), испускающее β.-лучи. Интенсивность α.-лучей, как и β., сначала равна почти нулю, — вероятно, RaD не испускает лучей. Но затем сила α.
-лучей все растет, и, судя по кривой роста, может достигнуть максимума только через 2,8 года. Эти α.-лучи зависят от RaF, который образуется из RaE и, в свою очередь, распадается далее. что при этом последнем распаде, кроме α.-луча, получается, пока не выяснено. Период полураспада RaF в 143 дня.
его радиоактивная константа определяется тем легче, что этот продукт удобно изолировать: при погружении в солянокислый раствор смеси RaD, RaE и RaF палочки висмута только RaF осаждается на этом металле в виде тончайшего слоя, а RaD и RaE остаются в растворе. Три продукта эти различаются и по своей летучести: так, при 1000° RaF улетучивается легко, RaD — труднее, а RaE не летит вовсе.
Как радиоактивная константа, так и химические свойства заставили признать тождество RaF с открытым г-жой Кюри и признанным ею за самостоятельный элемент продуктом, которому она дала имя полония. Впрочем, полоний, по-видимому, содержит еще и RaD, ибо нацело активность его не теряется и через 3 года. более чистый RaF изолировал из той же смоляной руды Марквальд, назвав его радиотеллуром.
Гофманн и Цербан описали еще один радиоактивный элемент, близкий к свинцу, вследствие чего они назвали его радиосвинцом. судя по его радиоактивным свойствам, это не что иное, как RaD. В общем, ход распада радия, по нынешним данным, может быть представлен следующей таблицей: Что касается времени распада самого радия, то суждение о нем основывается на следующих данных.
Как известно, α.-лучи заряжены положительным электричеством. Резерфорд измерил количество этого электричества, отдаваемое α.-лучами определенного количества радиоактивного вещества в определенный промежуток времени, и мог отсюда вычислить, принимая заряд каждого α.-луча равным обыкновенному заряду иона, что 1 гр. радия испускает в 1 секунду 6,2 ×.
1010 α.-лучей. По теории дезинтеграции атомов, испускание одного α.-луча означает распад одного атома, а так как 1 куб. см. водорода содержит 3,6 ×.1019 молекул, и атомный вес радия 225, то 1 гр. радия содержит около 3,6 ×.1021 атомов, из которых 6,2 ×.1010 в секунду разлагается.
отсюда и вычислено, что половина данного количества радия разложится в 1280 лет. Где конец процесса, каков тот нерадиоактивный атом, который является стойким продуктом распада радия — пока неизвестно. Когда было доказано, что эманация радия образует гелий, то думали, что гелий и есть окончательный продукт.
Оказывается, однако, что и эманация актиния дает гелий, и теперь склоняются к мысли, что гелий — это α.-лучи, лишенные заряда. Есть основания предполагать, что таким конечным продуктом является свинец, всегда сопровождающий в минералах радий. но это пока совершенно не доказано.
С другой стороны, атом радия настолько нестоек, что этот металл давно должен был бы разложиться, и нахождение его в древней урановой руде делает вероятным, что радий постоянно образуется заново. Естественно предположить, что исходным материалом для радия должен быть уран — этот постоянный спутник радия в минералах, и, наоборот, — всегда содержащий небольшие количества радия. Исследование показало, что отношение количеств урана и радия для всех минералов сохраняется то же, — обстоятельство, подкрепляющее гипотезу происхождения радия из урана. Наконец, были поставлены прямые опыты, которые, действительно, показали, что 1 кг очищенной от радия урановой соли через несколько месяцев начинает выделять небольшие количества эманации радия. Таким образом, приведенную таблицу можно бы дополнить так: U →.UrX→…. Ra и т. д. Литературу см. в ст. Радиоактивность. Ю. Залькинд.
Определение слова «Радий» по БСЭ:
Радий (лат. Radium)
Ra, радиоактивный химический элемент II группы периодической системы Менделеева, атомный номер 88. Известны изотопы Р. с массовыми числами 213, 215, 219-230. Самым долгоживущим является &alpha.-радиоактивный 226Ra с периодом полураспада около 1600 лет.
В природе как члены естественных радиоактивных рядов встречаются 222Ra (специальное название изотопа — актиний-икс, символ AcX), 224Ra (торий-икс, ThX), 226Ra и 228Ra (мезоторий-I, MsThI).
Об открытии Р. сообщили в 1898 супруги П. и М. Кюри совместно с Ж. Бемоном вскоре после того, как А. Беккерель впервые (в 1896) на солях урана обнаружил явление радиоактивности.
В 1897 работавшая в Париже М. Склодовская-Кюри установила, что интенсивность излучения, испускаемого урановой смолкой (минерал Уранинит), значительно выше, чем можно было ожидать, учитывая содержание в смолке урана. Склодовская-Кюри предположила, что это вызвано присутствием в минерале ещё неизвестных сильно радиоактивных веществ.
Тщательное химическое исследование урановой смолки позволило открыть два новых элемента — сначала Полоний, а чуть позже — и Р. В ходе выделения Р. за поведением нового элемента следили по его излучению, поэтому и назвали элемент от лат. radius — луч. Чтобы выделить чистое соединение Р.
, супруги Кюри в лабораторных условиях переработали около 1 т заводских отходов, оставшихся после извлечения урана из урановой смолки. Было выполнено, в частности, не менее 10 000 перекристаллизаций из водных растворов смеси BaCl2 и RaCl2 (соединения Бария служат т. н. изоморфными носителями при извлечении Р.). В итоге удалось получить 90 мг чистого RaCI2.
В СССР работы по выделению Р. из отечественного сырья были начаты вскоре после Октябрьской революции 1917 по прямому указанию В. И. Ленина. Первые препараты Р. были получены в СССР в 1921 В. Г. Хлопиным и И. Я. Башиловым. Образцы солей Р. демонстрировались в мае 1922 участникам 3-го Менделеевского съезда.
Р. — чрезвычайно редкий элемент.
В урановых рудах, являющихся главным его источником, на 1 т U приходится не более 0,34 г Ra. Р. принадлежит к сильно рассеянным элементам и в очень малых концентрациях обнаружен в самых различных объектах.
Все соединения Р. на воздухе обладают бледно-голубоватым свечением. За счёт самопоглощения &alpha.- и &beta.
-частиц, испускаемых при радиоактивном распаде 226Ra и его дочерних продуктов, каждый грамм 226Ra выделяет около 550 дж (130 кал) теплоты в час, поэтому температура препаратов Р. всегда немного выше окружающей.
Р. — серебристо-белый блестящий металл, быстро тускнеющий на воздухе. Решётка кубическая объёмноцентрированная, расчётная плотность 5,5 г/смі.
По разным источникам, tпл. составляет 700-960°C, tкип около 1140°C. На внешней электронной оболочке атома Р. находятся 2 электрона (конфигурация 7sІ). В соответствии с этим Р. имеет только одну степень окисления +2 (валентность II). По химическим свойствам Р. больше всего похож на барий, но более активен. При комнатной температуре Р.
соединяется с кислородом, давая окисел RaO, и с азотом, давая нитрид Ra3N2. С водой Р. бурно реагирует, выделяя H2, причём образуется сильное основание Ra (OH)2. Хорошо растворимы в воде хлорид, бромид, иодид, нитрат и сульфид Р., плохо растворимы карбонат, сульфат, хромат, оксалат.
Изучение свойств Р. сыграло огромную роль в развитии научного познания, т.к.
позволило выяснить многие вопросы, связанные с явлением радиоактивности. Долгое время Р. был единственным элементом, радиоактивные свойства которого находили практическое применение (в медицине. для приготовления светящихся составов и т.д.). Однако сейчас в большинстве случаев выгоднее использовать не Р., а более дешёвые искусственные радиоактивные изотопы др. элементов. Р.
сохранил некоторое значение в медицине как источник Радона при лечении радоновыми ваннами. В небольших количествах Р. расходуется на приготовление нейтронных источников (в смеси с бериллием) и при производстве светосоставов (в смеси с сульфидом цинка).
Лит.: Вдовенко В. М., Дубасов Ю. В., Аналитическая химия радия, Л., 1973. Погодин С. А., Либман Э. П., Как добыли советский радий, М., 1971.С. С. Бердоносов.
Радий в организме. Из естественных радиоактивных изотопов наибольшее биологическое значение имеет долгоживущий 226Ra. Р. неравномерно распределён в различных участках биосферы. Существуют Геохимические провинции с повышенным содержанием Р. Накопление Р.
в органах и тканях растений подчиняется общим закономерностям поглощения минеральных веществ и зависит от вида растения и условий его произрастания. Как правило, в корнях и листьях травянистых растений Р. больше, чем в стеблях и органах размножения. больше всего Р. в коре и древесине. Среднее содержание Р.
в цветковых растениях 0,3-9,0·10&minus.11 кюри/кг, в мор. водорослях 0,2-3,2·10&minus.11 кюри/кг.
В организм животных и человека поступает с пищей, в которой он постоянно присутствует (в пшенице 20-26·10&minus.15г/г, в картофеле 67-125·10&minus.15г/г, в мясе 8·10&minus.15 г/г), а также с питьевой водой. Суточное поступление в организм человека 226Ra с пищей и водой составляет 2,3·10&minus.12 кюри, а потери с мочой и калом 0,8·10&minus.13 и 2,2·10&minus.12 кюри.
Около 80% поступившего в организм Р. (он близок по химическим свойствам Ca) накапливается в костной ткани. Р. в организме человека зависит от района проживания и характера питания. Большие концентрации Р. в организме вредно действуют на животных и человека, вызывая болезненные изменения в виде Остеопороза, самопроизвольных переломов, опухолей. Р. в почве свыше 1·10&minus.7-10&minus.8 кюри/кг заметно угнетает рост и развитие растений.
Лит.: Вернадский В. И., О концентрации радия растительными организмами, «Докл. АН СССР. Сер. А», 1930, № 20. Радиоэкологические исследования в природных биогеоценозах, М., 1972.
В. А. Кальченко, В. А. Шевченко.
План:
- Введение
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 5 Физические и химические свойства
- 6 Применение
- 7 Биологическая роль
- 8 Изотопы
- 9 Интересные факты
Примечания
Ра́дий — элемент главной подгруппы второй группы, седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium). Простое вещество радий (CAS-номер: 7440-14-4) — блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226Ra (период полураспада около 1600 лет).
1. История
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран.
Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий. Первое сообщение об открытии радия (в виде смеси с барием) Кюри сделали 26 декабря 1898 года во Французской Академии наук.
В 1910 Кюри и Андре Дебьерн выделили чистый радий путём электролиза хлорида радия на ртутном катоде и последующей дистилляции в водороде. Выделенный элемент представлял собой, как сейчас известно, изотоп радий-226, продукт распада урана-238. За открытие радия и полония супруги Кюри получили Нобелевскую премию.
[attention type=yellow]
Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде.
[/attention]
В России радий впервые был получен в экспериментах известного советского радиохимика В. Г. Хлопина. В 1918 году на базе Государственного рентгеновского института было организовано Радиевое отделение.
Это отделение в 1922 году получило статус отдельного научного института. Одной из задач Радиевого института были исследования радиоактивных элементов, в первую очередь — радия. Директором нового института стал В. И. Вернадский, его заместителем — В. Г.
Хлопин, физический отдел института возглавил Л. В. Мысовский.[3]
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т. д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
| Изотоп | |
| Эманация радия | 222Rn |
| Радий A | 218Po |
| Радий B | 214Pb |
| Радий C | 214Bi |
| Радий C1 | 214Po |
| Радий C2 | 210Tl |
| Радий D | 210Pb |
| Радий E | 210Bi |
| Радий F | 210Po |
Названная в честь Кюри внесистемная единица радиоактивности кюри основана на активности 1 г радия-226: 3,7×1010 распадов в секунду, или 37 ГБк.
2. Происхождение названия
Название «радий» связано с излучением ядер атомов Ra (лат. radius — луч).
3. Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226.
Весь природный радий является радиогенным — возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468×109 лет)/(1602 года)=2,789×106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия или 1,02 мкг/т (кларк в земной коре).
Все природные изотопы радия сведены в таблицу:
ИзотопИсторическое названиеСемействоПериод полураспадаТип распадаДочерний изотоп (историческое название)
| Радий-223 | актиний Х (AcX) | ряд урана-235 | 11,435 дня | α | радон-219 (актинон, An) |
| Радий-224 | торий Х (ThX) | ряд тория-232 | 3,66 дня | α | радон-220 (торон, Tn) |
| Радий-226 | радий (Ra) | ряд урана-238 | 1602 года | α | радон-222 (радон, Rn) |
| Радий-228 | мезоторий I (MsTh1) | ряд тория-232 | 5,75 года | β | актиний-228 (мезоторий II, MsTh2) |
Геохимия радия во многом определяется особенностями миграции и концентрации урана, а также химическими свойствами самого радия — активного щёлочноземельного металла.
Среди процессов, способствующих концентрированию радия, следует указать в первую очередь на формирование на небольших глубинах геохимических барьеров, в которых концентрируется радий. Такими барьерами могут быть, например, сульфатные барьеры в зоне окисления.
Поднимающиеся снизу хлоридные сероводородные радийсодержащие воды в зоне окисления становятся сульфатными, радий осаждается с BaSO4 и CaSО4, где он становится практически нерастворимым постоянным источником радона.
Из-за высокой миграционной способности урана и способности его к концентрированию, формируются многие типы урановых рудообразований в гидротермах, углях, битумах, углистых сланцах, песчаниках, торфяниках, фосфоритах, бурых железняках, глинах с костными остатками рыб (литофациями). При сжигании углей зола и шлаки обогащаются 226Ra. Также содержание радия повышено в фосфатных породах.
В результате распада урана и тория и выщелачивания из вмещающих пород в нефти постоянно образуются радионуклиды радия.
В статическом состоянии нефть находится в природных ловушках, обмена радием между нефтью и подпирающими ее водами нет (кроме зоны контакта вода-нефть) и в результате имеется избыток радия в нефти.
При разработке месторождения пластовые и закачиваемые воды интенсивно поступают в нефтяные пласты, поверхность раздела вода-нефть резко увеличивается и в результате радий уходит в поток фильтрующихся вод.
При повышенном содержании сульфат-ионов растворенные в воде радий и барий осаждаются в виде радиобарита Ва(Ra)SО4, который выпадает на поверхности труб, арматуры, резервуаров. Типичная объёмная активность поступающей на поверхность водонефтяной смеси по 226Rа и 228Rа может быть порядка 10 Бк/л (соответствует жидким радиоактивным отходам).
Основная масса радия находится в рассеянном состоянии в горных породах. Радий — химический аналог щелочных и щёлочноземельных породообразующих элементов, из которых состоят полевые шпаты, составляющие половину массы земной коры.
Калиевые полевые шпаты — главные породообразующие минералы кислых магматических пород — гранитов, сиенитов, гранодиоритов и др. Известно, что граниты обладают природной радиоактивностью несколько выше фоновой из-за содержащегося в них урана. Хотя кларк урана не превышает 3 г/т, но в гранитах его содержание составляет уже 25 г/т.
Но если гораздо более распространённый химический аналог радия барий входит в состав довольно редких калий-бариевых полевых шпатов (гиалофанов), а «чистый» бариевый полевой шпат, минерал цельзиан BaAl2Si2O8 очень редок, то накопления радия с образованием радиевых полевых шпатов и минералов вообще не происходит из-за короткого периода полураспада радия. Радий распадается на радон, уносящийся по порам и микротрещинкам и вымывающийся с грунтовыми водами. В природе иногда встречаются молодые радиевые минералы, не содержащие уран, например радиобарит и радиокальцит, при кристаллизации которых из растворов, обогащённых радием (в непосредственной близости от легкорастворимых вторичных урановых минералов), радий сокристаллизуется с барием и кальцием благодаря изоморфизму.
4. Получение
Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия.
Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в.
в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
5. Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — +2. Гидроксид радия Ra(OH)2 — сильное, коррозионное основание.
6. Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны: 9Be + 4He → 12C + 1n.
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут.), 192Ir (T1/2 = 74 сут.), 198Au (T1/2 = 2,7 сут.) и т. д.
До 70-х годов XX века радий часто использовался для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных и морских приборов, специальных часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года). Опасность таких приборов состоит в том что они не содержали предупреждающей маркировки, выявить их можно только дозиметрами.
7. Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
8. Изотопы
Известны 25 изотопов радия. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов. Остальные изотопы могут быть получены искусственным путём. Радиоактивные свойства некоторых изотопов радия[4]:
Массовое числоПериод полураспадаТип распада
| 213 | 2,74(6) мин. | α |
| 219 | 10(3) мс | α |
| 220 | 17,9(14) мс | α (99%) |
| 221 | 28(2) с | α |
| 222 | 38,0(5) с | α |
| 223 (AcX) | 11,43(5) дня | α |
| 224 (ThX) | 3,6319(23) дня | α |
| 225 | 14,9(2) дня | β |
| 226 | 1602(7) лет | α |
| 227 | 42,2(5) мин. | β |
| 228 (MsTh1) | 5,75(3) года | β |
| 230 | 93(2) мин. | β |
9. Интересные факты
В начале века, после своего открытия, радий считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средство для повышения тонуса и потенции.[5][6]
- Продукты с радием
- Репродукции продуктов, содержащих радий, выпускавшихся в начала 20-го века, на витрине в Музее Марии Кюри, Париж.
- Надпись на баночке: «Пудра ТО-РАДИЙ на основе радия и тория по формуле Альфреда Кюри…»
Примечания
- Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1995. — Т. 4. — С. 153-154. — 639 с. — 20 000 экз. — ISBN 5—85270—092—4
- WebElements Periodic Table of the Elements | Radium | crystal structures — www.webelements.
com/radium/crystal_structure.html
- Мещеряков М. Г., Перфилов Н. А. Памяти Льва Владимировича Мысовского (К семидесятипятилетию со дня рождения) — ufn.ru/ru/articles/1963/11/g/ // Выпуск УФН : Сборник УФН. — М.: 1963. — В. Ноябрь.
- Audi, Bersillon, Blachot, Wapstra.
The Nubase2003 evaluation of nuclear and decay properties — amdc.in2p3.fr/web/nubase_en.html, Nuc. Phys. A 729, pp. 3-128 (2003).
- ANR | Radium Face Cream, 1918 — home.gwi.net/~dnb/gallery/radior/radior.htm
- 10 Radioactive Products That People Actually Used — www.environmentalgraffiti.
com/ofeat-news/10-radioactive-products-that-people-actually-used/1388
скачать
Данный реферат составлен на основе статьи из русской Википедии. Синхронизация выполнена 09.07.11 18:31:48
Похожие рефераты: НПП Радий, Радий-226, Радий-224, Радий-228, Погодин Радий, Радий Погодин, Радий (предприятие), Фиш Радий Геннадиевич, Радий Овчинников.
Категории: Химические элементы, Радий, Щёлочноземельные металлы, Радиоактивные элементы.
Текст доступен по лицензии Creative Commons Attribution-ShareA.
История
Ра́дий (как и полоний) был открыт в конце 19 века во Франции А. Беккерелем и супругами Пьером и Марией Кюри.
Титаническая работа супругов Кюри по извлечению радия, по получению первых миллиграмм чистого хлорида этого элемента RaCl2 стала символом подвижнической работы ученых-исследователей.
За работы по изучению радиоактивности супруги Кюри в 1903 году получили Нобелевскую премию по физике, а Мария Кюри в 1911 году — Нобелевскую премию по химии.
В России первый препарат радия был получен в 1921 году В. Г. Хлопиным и И. Я. Башиловым.
Ссылки
- Радий на Webelements
- Радий в Популярной библиотеке химических элементов
Категории:
- Химические элементы
- Щёлочноземельные металлы
- Радиоактивные элементы